猪肺表面活性物质对新生儿呼吸窘迫综合征患儿血气分析及机械通气参数的影响
李浩文
洛阳市妇幼保健院新生儿科,河南 洛阳 471000
新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)多见于早产儿,主要指新生儿出生4~21h内出现进行性呼吸困难、呻吟、吸气三凹征等症状,若不及时治疗,可引起呼吸衰竭,危及患儿生命[1]。目前,辅助通气是治疗NRDS患儿常用手段,可予以患儿呼吸支持,缓解呼吸困难等症状,纠正机体缺氧状态。但NRDS主要因内源性肺表面活性物质(pulmonary surfactant,PS)分泌不足所致,应及早采用PS替代疗法,以加快患儿病情稳定[2]。猪PS及牛PS均属于天然型PS,可有效补充内源性PS不足,增强肺泡细胞稳定性,加快肺泡表面细胞发育,从而改善肺通气换气功能,促进病情好转,但临床对于两种PS疗效尚存在一定争议[3]。鉴于此,本研究就猪PS与牛PS治疗NRDS的临床效果展开分析,现报道如下。
1 资料与方法
1.1 一般资料选取2018年6月—2019年12月于我院治疗的110例NRDS患儿,按随机数字表法分为两组,各55例。对照组男28例,女27例;胎龄31~36周,平均胎龄(34.67±1.12)周;体重1 642~3 145g,平均体重(2 536.41±218.36)g;分娩方式:41例剖宫产、14例顺产。观察组男29例,女26例;胎龄32~36周,平均胎龄(34.69±1.13)周;体重1 648~3 150g,平均体重(2 536.49±218.38)g;分娩方式:40例剖宫产、15例顺产。本研究经医学伦理委员会审核通过。两组一般资料对比,差异无统计学意义(P>0.05)。
1.2 入选标准纳入标准:符合《2019年欧洲新生儿呼吸窘迫综合征管理指南》[4]推荐意见介绍中相关诊断;胎龄38周内;伴随呼吸困难、吸气三凹征等症状;患儿家属签署知情同意书。排除标准:吸入羊水及胎粪;伴随先天性呼吸道畸形;合并重症肺炎。
1.3 方法两组患儿均于确诊后开放气道,予以持续气道正压通气支持,并依据治疗过程中血气分析变化调整呼吸机参数,维持血氧饱和度85%~93%。对照组采用注射用牛肺表面活性剂(华润双鹤药业股份有限公司;批准文号:国药准字H20052128;规格:70m g)治疗,于气管插管内分4次滴注40~100m g/kg,每次间隔1min。观察组给予猪肺磷脂注射液(Chiesi Farmaceutici S.P.A.;注册证号:H20 181201;规格:1.5mL:0.12g)治疗,于气管插管内分4次滴注100~200mg/kg,每次间隔1min。两组待患儿病情稳定,且血气分析结果正常后方可逐步撤机。
1.4 观察指标①血气分析:于治疗前及治疗24h后,通过血气分析仪监测两组患儿动脉血压分压(PaO2)及二氧化碳分压(PaCO2)变化。②机械通气参数:于上述时间,记录两组患儿吸气峰压(peak inspiratory pressure,PIP)、呼气末正压(positive end-expiratory pressure,PEEP)及吸氧浓度(fraction of inspiration O2,FiO2)变化。③通气时间及住院时间:比较两组通气时间及住院时间。
1.5 统计学方法采用SPSS 22.0软件分析数据,计数资料以百分数表示,进行χ2检验;计量资料以()表示,进行t检验;P<0.05为差异有统计学意义。
2 结果
2.1 血气分析两组治疗前及治疗后血气分析相比,差异无统计学意义(P>0.05);两组治疗后PaO2高于治疗前,PaCO2低于治疗前,差异有统计学意义(P< 0.05),见表1。
表1 两组患者血气分析对比(,mmHg)Tab 1 Comparison of blood gas analysis between two groups(,mmHg)
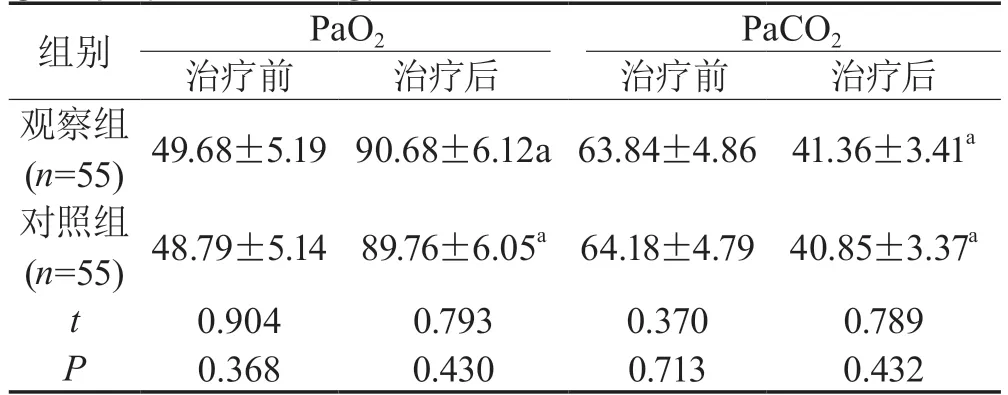
表1 两组患者血气分析对比(,mmHg)Tab 1 Comparison of blood gas analysis between two groups(,mmHg)
注:与本组治疗相比,a为P<0.05
2.2 机械通气参数两组治疗前机械通气参数相比,差异无统计学意义(P>0.05);观察组治疗后PIP、PEEP及FiO2水平低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者机械通气参数对比()Tab 2 Comparison of mechanical ventilation parameters between two groups()
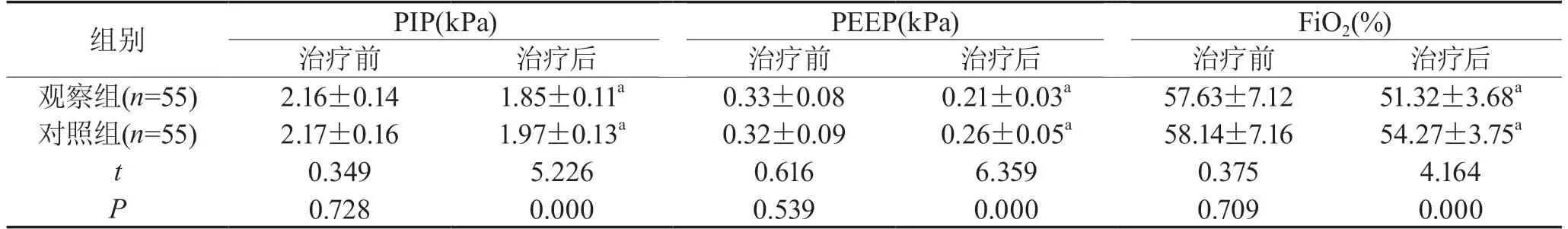
表2 两组患者机械通气参数对比()Tab 2 Comparison of mechanical ventilation parameters between two groups()
注:与本组治疗相比,a为P<0.05
2.3 通气时间及住院时间观察组通气时间、住院时间短于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者通气时间及住院时间对比()Tab 3 Comparison of ventilatory time and hospitalization time between two groups()

表3 两组患者通气时间及住院时间对比()Tab 3 Comparison of ventilatory time and hospitalization time between two groups()
3 讨论
NRDS发病复杂,患儿肺发育尚未成熟、PS分泌不足是诱发该病的主要因素。当新生儿体内PS分泌不足时,会增大肺表面张力,降低顺应性,导致肺泡膨胀不足,且新生儿呼吸力量薄弱,多种因素共同作用下肺通气及换气功能出现障碍,进而诱发NRDS[5-6]。目前,临床常规治疗多予以无创正压通气支持,可有效阻止患儿肺泡萎缩,减轻呼吸做功,改善临床症状,但其难以纠正内源性PS分泌不足。
PS属于肺泡Ⅱ型上皮细胞分泌的多功能物质,其可提高肺顺应性,降低肺表面张力,从而稳定肺泡容积,预防肺泡萎缩[7-8]。同时,PS可消除肺泡液,维持患儿呼吸通畅,并平衡肺部毛细血管及肺泡间流体压力,减少肺水肿发生。此外,PS能降低肺部毛细血管张力,增强肺泡通气量及氧分压,促进呼吸困难等症状消失[9]。猪PS及牛PS均是临床常用PS制剂,可补充内源性PS不足,加快改善患儿肺通气换气功能。然而,不同PS制剂的黏度、抗氧化磷脂含量等存在差异,对临床疗效可能产生不同影响。本研究结果显示,两组均可改善血气分析状况,但观察组PIP、PEEP及FiO2水平低于对照组,通气时间、住院时间短于对照组,表明猪PS及牛PS治疗NRDS均可取得良好疗效,但猪PS可改善机械通气参数,缩短住院时间。杨锦明[10]研究显示,猪PS治疗NRDS疗效优于牛PS,可降低机械通气参数,缩短患儿住院时间,与本研究结果相类似。分析原因如下,牛PS属于冻干粉制剂,通常储存温度在-10℃以下,临床使用时需先进行加热,待到室温后,方可加入2mL注射用水混匀滴注,但溶解过程中易出现泡沫或无法完全溶解现象,使得药物难以100%利用,降低治疗效果。而猪PS自猪肺内提取而出,属于混悬液制剂,在2℃~8℃环境下保存,使用时直接加热至37℃,药物利用度高,故而猪PS治疗NRDS疗效更佳。
综上所述,猪PS治疗NRDS可降低机械通气参数,改善血气分析状况,减少患儿通气时间,加快疾病康复。

