UPLC-PDA-MS-ABTS阳离子自由基在线分析藤茶的抗氧化活性成分
甘小娜,彭 博,李廷钊,李 波,
(1.安利(中国)研发中心,上海 201203;2.安利(中国)植物研发中心,江苏 无锡 214145)
藤茶,亦称银茶、霉茶,是葡萄科蛇葡萄属植物显齿蛇葡萄的干燥茎叶,为多年生藤本植物,主要分布于长江流域,如湖北恩施、湖南张家界和衡阳、贵州梵净山、福建武夷山等地[1]。藤茶在我国民间(尤其是少数民族地区)应用历史悠久,是土家族药用珍品,也是客家的民俗茶饮,还是瑶族的传统浴波植物之一,在拉祜族、侗族、基诺族等少数民族中均有广泛应用,用以治疗口腔溃疡、咽炎,以及胃肠不适症等[2]。藤茶中富含黄酮类化合物,占干制样品的40%[3],其中又以二氢杨梅素(dihydromyricetin,DMY)含量最为突出[4]。现代药理研究藤茶具多种功效,如抗氧化[5-6]、抗菌抗炎[7]、降血脂[8]、护肝解酒[9]、保护心脏[10]、抗肿瘤[11]等。2013年12月24日,国家卫生计生委批准显齿蛇葡萄叶为新资源食品;作为茶药两用植物资源,藤茶开发潜力巨大。
常规活性成分的筛选是将原植物进行提取、分离并鉴定后,再针对单体化合物进行活性测定,该方法费时费力,且原药材用量较大;近年来,国内外有不少学者对该方法进行改进,将活性分析(如抗氧化剂[12-15]、乙酰胆碱酯酶抑制剂[16]、α-葡萄糖苷酶抑制剂[17]、肝细胞色素P450配体[18]、磷酸二酯酶抑制剂[19]、血管紧张素转换酶抑制剂[20]等)和现代分析仪器设备结合起来,在进行化学成分分析的同时完成化合物活性筛选和鉴定,大大提高了天然植物活性化合物筛选和鉴定的效率。但目前发表的抗氧化活性筛选相关文献基本都是将活性分析与普通高效液相色谱仪结合,鲜见有超高效液相色谱(ultra-high performance liquid chromatography,UPLC)[21]在线抗氧化方法的运用;UPLC分析速度快、分离度好,可在很大程度上缩短实验时间、提高实验效率,其在分析领域的应用,尤其对不稳定物质的快速分析,有其不可替代的优势。
本实验旨在利用在线活性分析的方法,采用液相色谱-质谱联用的手段,获得化合物的保留时间、紫外吸收图谱及相对分子质量信息,对比文献对化合物进行初步推断,并结合已有标准品对推断的结论进一步验证,从而鉴定藤茶中主要的抗氧化成分;建立UPLC-二极管阵列检测器-质谱-2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(UPLC-photo-diode array-mass spectrometry-2,2’-amino-bis-(3-ethylbenzothiazoline-6-sulphonic acid)ammonium salt,UPLC-PDA-MS-ABTS)阳离子自由基藤茶抗氧化活性的定量方法,并分析比较不同产地藤茶抗氧化活性的高低,以期为后续质量标准的建立提供物质基础,同时也为UPLC串联在线抗氧化活性测定提供参考方法和实验条件。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈(均为色谱纯) 德国Merck公司;乙醇(分析纯) 中国General-Reagent公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Thermo Fisher Scientific公司;甲酸(色谱纯) 美国Honeywell公司;ABTS、过硫酸钾(K2(SO4)2)、Trolox中国Adamas Reagent公司;超纯水由美国Milli-Q超纯水机制备;DMY、杨梅素-3-O-鼠李糖苷、杨梅素深圳振强生物技术有限公司;藤茶药材由安利(中国)研发中心陈亮博士鉴定,并存样于药材库,其产地及来源见表1。

表1 藤茶产地及来源信息Table 1 Information about vine tea samples used in this study
1.2 仪器与设备
Milli-Q超纯水系统 上海技舟化工科技有限公司;WF-600EHT型超声波清洗机 宁波海曙五方超声设备有限公司;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;XS2051/10万分之一电子天平、MS3002S型电子分析天平 梅特勒-托利多国际贸易有限公司;UPLC仪(配PDA检测器、串联QDa质谱仪) 美国Waters公司。
1.3 方法
1.3.1 藤茶中化合物的鉴别与在线抗氧化活性筛选
1.3.1.1 供试品溶液的制备
取藤茶粉末约100 mg,精密称质量,置于50 mL容量瓶中,加60%乙醇溶液定容至刻度线,超声提取30 min,以0.22 μm有机滤膜过滤,取续滤液,待测。
1.3.1.2 ABTS溶液的制备[22]
精密称取ABTS粉末约50 mg,加适量PBS溶解;精密称取过硫酸钾粉末约50 mg,加入10 mL PBS溶解;取适量过硫酸钾溶液加入ABTS溶液中,混匀,使ABTS终浓度为3.6 nmol/L,过硫酸钾终浓度为1.2 nmol/L;室温避光反应过夜(12~16 h),于4 ℃保存备用,自由基溶液有效期为2 d,使用时用PBS调节至所需吸光度(729 nm波长处吸光度为0.7±0.02)。
1.3.1.3 藤茶中化合物的鉴别与在线抗氧化活性筛选流程
UPLC-PDA-MS-ABTS阳离子自由基在线鉴别藤茶中的抗氧化成分装置流程见图1。路径A:供试品溶液经色谱柱分离后,进入柱后反应模块,与柱后反应体系泵入的PBS混合后先后流经PDA和质谱,即可得到化合物在290 nm波长处的正吸收峰图及质谱图,根据质谱得到的化合物分子质量信息并结合文献数据,即可初步推断供试品中化合物的结构。路径B:将柱后体系中的溶剂置换成ABTS溶液,并设置PDA检测波长为729 nm,以相同的条件进样,供试品溶液经分离后与柱后反应体系泵入的ABTS溶液混合并反应后进入PDA,即可得到由于自由基的清除作用而形成的负吸收峰。
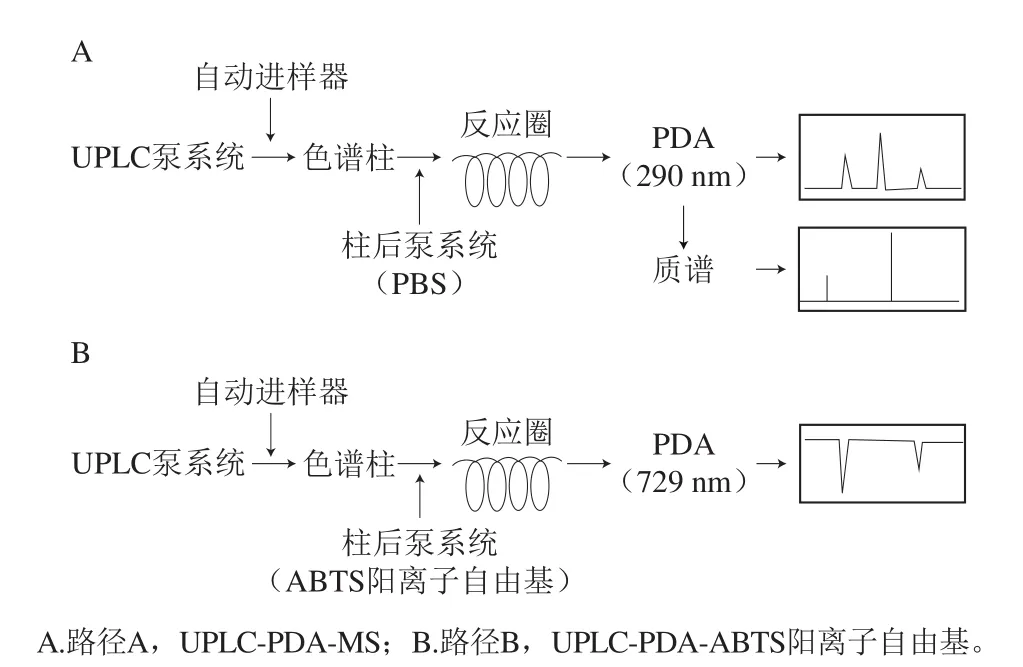
图1 在线检测藤茶抗氧化成分示意图Fig.1 Schematics of UPLC-PDA-MS (A) and UPLC-PDA-ABTS cation radical (B) for screening and identification of antioxidants in vine tea
1.3.1.4 藤茶中化合物的鉴别与在线抗氧化活性筛选条件
UPLC条件:色谱柱:ACQUITY UPLC®BEH C18(2.1 mm×50 mm,1.7 μm);流动相:0.1%甲酸溶液(A)-乙腈(B),梯度洗脱:0~2.5 min,90% A,10% B;1.5~6 min,90%~10%A,10%~90% B;6~8 min;10% A,90% B;8~10 min,10%~100% A,90%~0% B;流速:0.4 mL/min;柱温:25 ℃;检测波长:290 nm/729 nm(具体设置见1.3.1.3节);进样量:1 μL。
质谱条件:离子源:电喷雾离子源,负离子检测模式;雾化气:氮气;锥孔电压:15 V;质量扫描范围:m/z100~800。
柱后反应系统条件:反应环体积:1 mL;流动相:ABTS阳离子自由基溶液(729 nm波长处吸光度为0.7±0.02);流速:0.4 mL/min,柱后反应模块温度:37 ℃。
1.3.2 藤茶中DMY的含量测定
采用标准曲线法,以DMY为标准品,通过其质量浓度与峰面积之间的关系,对藤茶中DMY进行定量分析。
1.3.2.1 标准品溶液的制备
取DMY标准品约5 mg,精密称定,置于5 mL容量瓶中,加甲醇定容至刻度线,充分摇匀,备用。
1.3.2.2 供试品溶液的制备
取藤茶粉末约80 mg,精密称质量,置于250 mL容量瓶中,加60%乙醇溶液200 mL,超声提取30 min,再加60%乙醇溶液定容至刻度线,充分混匀,以0.22 μm有机滤膜过滤,取续滤液,待测。
1.3.2.3 仪器工作条件
设备连接见1.3.1节,选用路径A,断开质谱连接;超高效液相系统及柱后反应体系其他条件同1.3.1.4节,检测波长选用290 nm,柱后反应系统的流动相选用PBS。
1.3.3 藤茶的抗氧化活性定量分析
以Trolox为标准品,采用标准曲线法,对其中DMY的抗氧化活性进行分析;其活性用Trolox当量抗氧化能力(trolox-equivalent antioxidant capacity,TEAC)评价,按下式[23]进行计算:

式中:Y=kX+b为Trolox的浓度与倒峰面积标准曲线方程;A为供试品中DMY的倒峰面积;b为标准曲线方程的截距;V为供试品的体积;k为标准曲线方程的斜率;M为供试品的质量。
1.3.3.1 标准品溶液的制备
取Trolox标准品约5 mg,精密称定,置于5 mL容量瓶中,加甲醇定容至刻度线,充分摇匀,备用。
1.3.3.2 供试品溶液的制备
同1.3.2.2节。
1.3.3.3 仪器工作条件
设备连接见1.3.1节,选用路径B;UPLC系统及柱后反应体系其他条件同1.3.1.4节,检测波长选用729 nm,柱后反应系统的流动相选用ABTS溶液。
1.4 数据采集及分析
采用Empower 3FR3和Excel 2016软件进行处理。
2 结果与分析
2.1 系统方法的优化
2.1.1 ABTS阳离子自由基最大波长的选择
ABTS阳离子自由基波长大概分布在410、645、730 nm三个波长附近[24-28],本实验对自由基的吸收光谱从300~800 nm扫描;取ABTS储备液适量,加40 倍体积的PBS溶液,稀释,摇匀,用紫外-可见分光光度仪进行扫描,结果与文献一致,ABTS阳离子自由基在413、645、729 nm波长处达到吸收峰值,为尽量减小干扰,本实验最终选择729 nm作为ABTS阳离子自由基的测定波长。
2.1.2 流动相的选择
本实验比较甲醇和乙腈两种有机相对出峰的影响,结果表明,藤茶提取物在两种有机相下均能获得较好的峰形,但以甲醇为有机相时,Trolox出峰较晚且基线漂移较大,故本实验选择乙腈为实验的有机相;水相考察纯水、0.1%甲酸、0.1%乙酸的影响,结果表明流动相中添加少量甲酸和添加少量乙酸的效果相当,相对于用纯水作为流动相,加入少量酸能获得更好的峰形,并改善DMY与邻峰之间的分离度,本实验最终选择甲酸作为流动相添加剂。
2.1.3 UPLC系统流速及柱后反应系统流速的选择
整个系统流速的选择是影响实验的关键因素。在相同梯度条件下,UPLC系统流速过低会导致出峰延迟且影响分离度。柱后反应系统流速过低时,图谱噪音基线提高,且色谱峰展宽明显;而当柱后部分流速过大时,负吸收峰的面积逐渐减小,反应程度呈下降的趋势。因此,为兼顾化合物的分离度、峰形和实验的反应程度,本实验通过设置不同的流速进行比较,最终选择液相系统流速和柱后反应系统流速均为0.4 mL/min。
2.1.4 柱温的选择
实验比较柱温在25、30、35、40 ℃出峰情况,结果表明,温度越高,化合物出峰越早,分离度越差;在25 ℃,化合物的保留及分离度均能达到较好状态。
2.2 抗氧化成分的鉴定
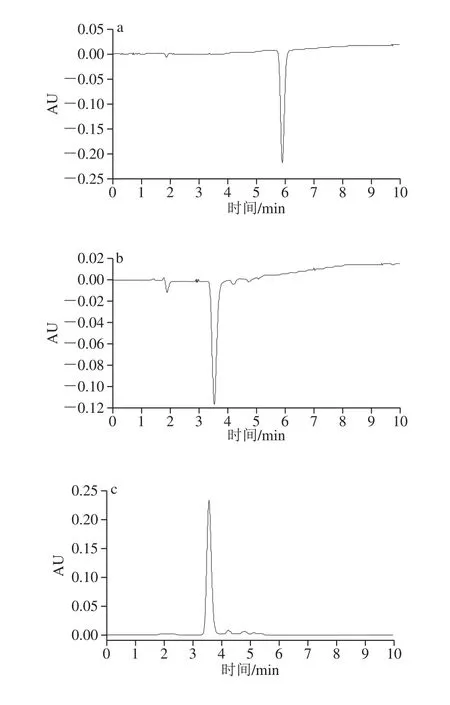
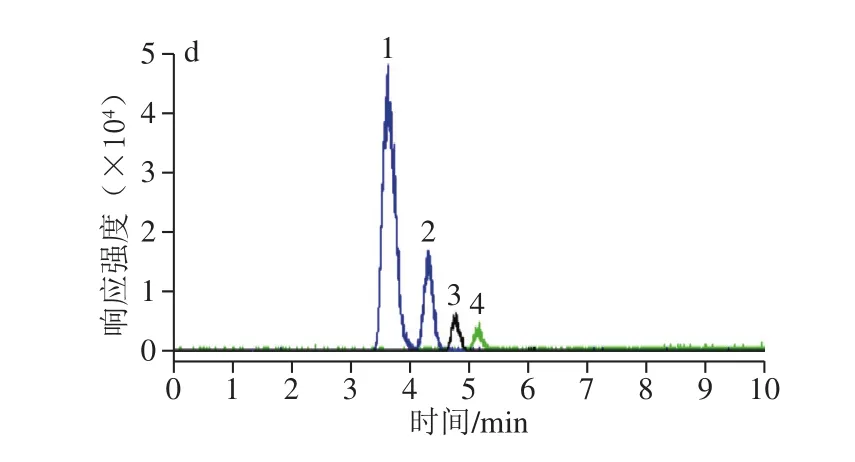
图2 Trolox色谱图(a)、藤茶样本原色谱图(b)、在线ABTS色谱图(c)及负离子模式下提取离子流图(d)Fig.2 Liquid chromatograms of Trolox (a) and vine tea (b), on-line ABTS assay chromatogram (c) and extracted ion chromatogram in negative ion mode (d)
取供试品溶液按优化条件进行分析,得到藤茶提取液原色谱图、在线ABTS色谱图及负离子模式下提取离子流图(图2)。分别对其中的质谱峰进行分析,得化合物1的分子离子峰[M-H]-的m/z为319.16,化合物2的分子离子峰[M―H]-的m/z为319.13,化合物3的分子离子峰[M―H]-的m/z为463.24,化合物4的分子离子峰[M-H]-的m/z为316.97。根据化合物的紫外吸收、保留时间及分子质量信息,结合文献[29-30]初步推断化合物1为DMY,化合物2为异二氢杨梅素,化合物3为杨梅素-3-O-鼠李糖苷,化合物4为杨梅素;取标准品溶液,以相同色谱条件进样,标准品溶液与所推断化合物在相同时间出峰,进一步证明推断正确。由图2可知,以上4 个化合物均有不同程度的抗氧化活性,其中主要抗氧化成分为DMY。
2.3 DMY含量测定方法学考察
2.3.1 线性关系考察
取DMY标准品溶液,加甲醇配制成质量浓度为0.01、0.025、0.05、0.1、0.25、0.5 mg/mL的标准曲线溶液,按1.3.1.4节方法进行测定,以质量浓度为横坐标,以DMY峰面积为纵坐标,进行线性回归,回归方程为Y=6 675 318.17X-11 262.08,R2=1.000,表明DMY在0.01~0.5 mg/mL之间线性关系良好。
2.3.2 精密度实验
精密吸取质量浓度为0.1 mg/mL的对照品溶液1 μL,连续进样6 次,记录DMY的峰面积,其RSD为0.43%,说明仪器精密度良好。
2.3.3 重复性实验
取同一样品6 份,按1.3.2.2节和1.3.2.3节处理并进行测定,记录峰面积并计算其相对含量,结果平均值为40.8%,RSD为0.78%,表明方法重复性良好。
2.3.4 稳定性实验
取供试品溶液,分别于0、1、2、4、8、12、24 h进样,每次1 μL,结果表明DMY峰面积在24 h内变化很小,RSD为1.59%,表明供试品在室温(25 ℃)24 h内稳定性良好。
2.3.5 加样回收率实验
取藤茶粉末适量于250 mL容量瓶,加入标准品粉末,按1.3.2.2节方法制备藤茶样本并进样,计算其回收率,结果见表2。
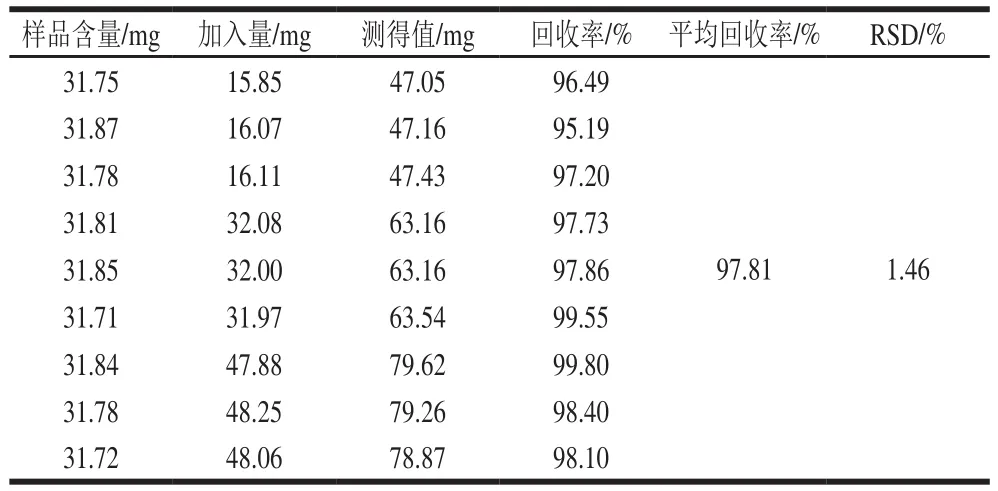
表2 DMY在藤茶样品中的加样回收率Table 2 Recovery of DMY in spiked vine tea
2.4 活性定量方法学考察结果
2.4.1 线性关系考察结果
取Trolox标准品溶液,加甲醇配制成质量浓度为0.02、0.04、0.10、0.20、0.40 mg/mL的标准曲线溶液,按1.3.1.4方法进行测定,以质量浓度为横坐标,以倒峰面积为纵坐标,进行线性回归,回归方程为Y=6 366 664.72X+13 021.76,R2=0.999,表明Trolox在0.02~0.4 mg/mL线性关系良好。
2.4.2 精密度实验
取Trolox和DMY标准品,配制成两者均为0.1 mg/mL的混合标准品溶液,进样。精密吸取同一对照品溶液1 μL,连续进样6 次,测定Trolox和DMY的峰面积,其RSD分别为0.39%和0.54%,说明仪器精密度良好。
2.4.3 重复性实验
取同一样品6 份,按1.3.2.2节和1.3.2.3节处理并进行测定,记录峰面积,计算TEAC值,结果平均值为0.41,RSD为0.19%,表明方法重复性良好。
2.4.4 稳定性实验
取供试品溶液,分别于0、0.5、1、2、5、10 h进样,每次1 μL,结果DMY倒峰峰面积在10 h内变化很小,RSD为1.91%,表明供试品在室温(25 ℃)10 h内稳定性良好,也说明所配制的ABTS阳离子自由基在10 h内可对样品进行稳定测定。
2.5 样品测定结果
取藤茶药材粉末80 mg,精密称定,按1.3.2.2节方法制备,吸取供试品溶液1 μL,依法测定倒峰面积,按标准曲线法计算TEAC值,结果见表3。
由表3可知,不同产地来源的藤茶抗氧化能力差异较大,其中来源于湖北恩施凤硒藤茶有限公司(S7)和福建武夷山(S4)的样本抗氧化能力最强。
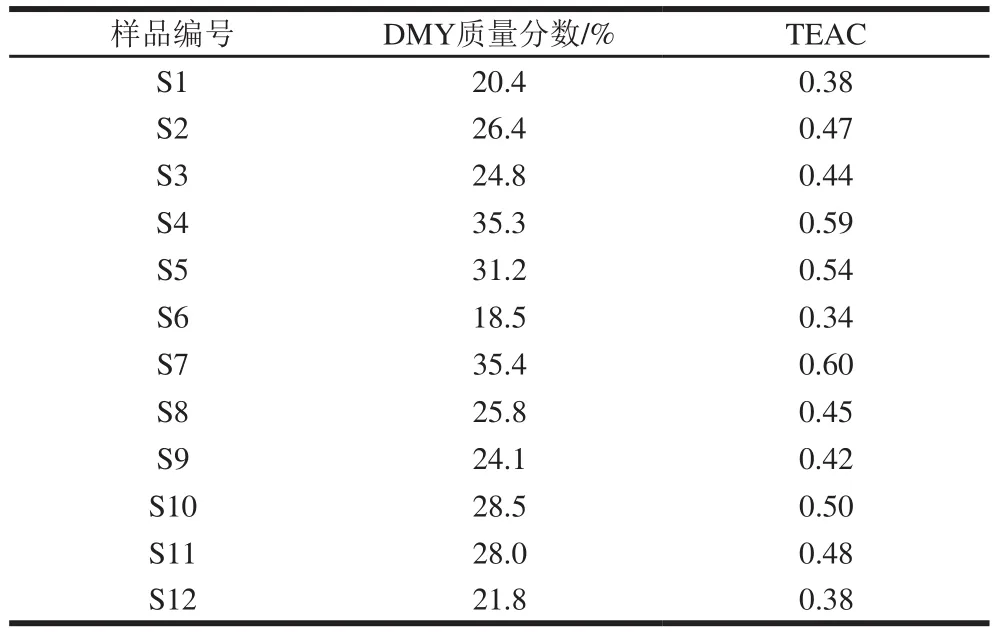
表3 不同来源藤茶样本DMY含量及抗氧化活性测定结果Table 3 Antioxidative capacities of vine tea samples from different sources
3 结 论
本研究采用UPLC-PDA-MS-ABTS阳离子自由基在线筛选藤茶中的抗氧化活性物质,推断出主要抗氧化活性物质DMY,并以Trolox为标准物质,建立藤茶抗氧化活性分析的定量方法,对市场上来源不同的12 批藤茶样本进行分析,来源于湖北恩施和福建武夷山的藤茶抗氧化效果较为突出。DMY既是藤茶含量最高的化合物,也是其抗氧化活性最好的成分,可作为其质量控制的指标。
将抗氧化活性数据与藤茶中DMY的含量数据进行比较分析,发现其含量与活性之间呈现良好的量效关系,也进一步证明了该定量方法对藤茶中DMY活性评估的可靠性。
本方法将UPLC与柱后反应系统相结合,利用UPLC分离效率高的优势,可有效缩短分析时间,提高实验效率;然而由于这两套系统本身在管路设计上存在差异,对于成分复杂的提取物的活性定量具有较大的挑战性,后期可尝试对管路进行优化和改造,使该方法应用于更多复杂体系的分析。

