发酵陈皮黑茶的化学成分差异及体外活性
侯 粲,杜昱光,王 曦,肖 杰,范怡航,董志忠,常国生,王 伟,李 颂,应 剑,
(1.中粮营养健康研究院,北京 102209;2.中国科学院过程工程所生化工程重点实验室,北京 100190;3.营养健康与食品安全北京市重点实验室,北京 102209;4.广州市艺洋实业有限公司,广东 广州 510360;5.中茶湖南安化第一茶厂有限公司,湖南 益阳 413513;6.中茶科技(北京)有限公司,北京 102209)
陈皮(Pericarpium Citri Reticulatae)是芸香科植物橘(Citrus reticulataBlanco)及其栽培变种的干燥成熟果皮[1]。目前认为陈皮中标志性的黄酮类化合物为橙皮苷、川陈皮素、橘皮素等成分[2-4],这些成分经过提取、分离及鉴定研究[5-7],目前已成为判别陈皮质量、产地、品种的成分标准之一。现有记载和研究较多的陈皮功能为理气健脾、燥湿化痰[8]。现代药理学研究发现,陈皮及其复配产品具有调节糖脂代谢的作用。高血糖模型小鼠分别饲喂基础饲料、添加10%柑橘皮基础饲料和添加10%瓯柑橘皮基础饲料1 周,结果表明柑橘皮和瓯柑皮对小鼠有极显著的降糖作用[9]。二陈汤方加减(由陈皮、半夏、茯苓、僵蚕及地龙等成分组成)可在一定程度上改善糖尿病并发脂肪肝大鼠的血糖、血脂水平及胰岛素抵抗状况[10]。
发酵陈皮黑茶是由一定比例的陈皮和黑毛茶为原料,经特殊“发花”工艺发酵形成。“发花”工艺是茯砖茶加工中形成茯砖茶独特品质的关键工艺,其实质是通过控制一定的外界条件,促使微生物优势菌——冠突散囊菌(Eurotium cristatum)的生长繁殖,产生金黄色的闭囊壳,俗称“金花”,是区别于其他黑茶的标志性特征[11]。冠突散囊菌一般被认为是茯砖茶生产过程中“金花”的优势菌种,也是形成茯砖茶独特品质的主要因素。目前,对发酵陈皮黑茶这一创新产品的成分和活性特征的研究鲜见报道。
代谢组学方法在植物代谢和食物成分组研究领域有广泛的应用基础[12-29]。本研究基于超高效液相色谱-四极杆静电场轨道阱质谱系统(ultra-high performance liquid chromatography-quadrupole-exactive,UPLC-Q-Exactive)结合代谢组学轮廓分析技术,从化学物质组学方面阐明陈皮黑茶的物质基础及发酵前后的变化规律。通过对比不同茶叶原料制成的陈皮黑茶成品的化学成分变化规律,阐释茶叶原料对陈皮黑茶成品品质的影响。利用体外活性评价模型(α-葡萄糖苷酶、α-淀粉酶、脂肪酶)对陈皮黑茶体外活性进行研究,以期从不同角度考察与揭示陈皮黑茶的功效作用,探索其成分与功效之间的关系,为陈皮黑茶制品的开发及功效机制提供科学依据。
1 材料与方法
1.1 材料与试剂
黑毛茶分别购自中茶湖南安化第一茶厂有限公司(厂家1)、湖南浩茗茶业食品有限公司(厂家2);新会陈皮购自广州市艺洋实业有限公司。黑毛茶加质量分数10%新会陈皮通过“发花”工艺发酵形成陈皮黑茶,按照黑毛茶厂家和存放时间(0、1、2 a),编号为1-1、1-2、1-3;2-1、2-2、2-3。
去离子水 美国Millipore公司;蒽酮、硫酸、氯化镁、无水乙醇(均为分析纯)、福林-酚试剂、阿卡波糖、奥利司他 国药集团化学试剂有限公司;甲醇、乙腈(色谱纯) 赛默飞世尔科技公司;VC稳定液(10 mg/mL)、脂肪酶、荧光素钠盐、2,2’-偶氮二异丁基脒二盐酸盐、奎诺二甲基丙烯酸酯、4-甲基伞形酮酯((4-methyl-2-oxochromen-7-yl)octanoate,4-MUO)、二甲基亚砜、对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-galactopyranoside,PNPG)、α-葡萄糖苷酶、α-猪胰淀粉酶美国Sigma试剂公司;碳酸钠 北京化工厂;可溶性淀粉(分析纯) 北京奥博星生物技术有限责任公司;植物总糖和还原糖检测试剂盒 北京雷根生物技术有限公司;磷酸缓冲(phosphate buffer,PB)溶液 国家标准溶液中心。
1.2 仪器与设备
Milli-Q Integral5水处理系统 美国Millipore公司;Thermo Scientific 2842水浴锅、UPLC-Q-Exactive仪(电喷雾离子源、Xcalibur工作站) 赛默飞世尔科技公司;BioTek Synergy Mx全自动酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 总多糖的测定
精密称取0.2 g茶粉,加入0.45 g氯化镁,准确加入30 mL沸水,沸水浴中浸提45 min,每隔10 min振荡一次,3 000 r/min离心5 min后,取上清液。50 mL离心管中加入5 mL水提样品溶液,缓慢加入20 mL无水乙醇,边加边摇匀,涡旋振荡1 min,4 000 r/min离心10 min,去掉上清液,沉淀用10 mL 80%乙醇溶液涡旋洗涤,离心后弃去上清液,沉淀加入5 mL去离子水,超声溶解,待测。
2 mL深孔板中加入200 μL去离子水(空白组)、0.4 mg/mL葡萄糖(对照组)、样品,将深孔板置于冰水浴中,缓慢加入800 μL蒽酮-硫酸溶液,加盖摇匀,沸水浴中反应10 min,冰水冷却至室温,转移至透明酶标板中,620 nm波长处比色,计算方法参照曹永等[30]。
1.3.2 总黄酮的测定
根据NY/T 1295—2007《荞麦及其制品中总黄酮含量的测定》方法、三氯化铝法测定[31]。
1.3.3 总多酚的测定
根据GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》方法测定[32]。
1.3.4 高分辨质谱结合化学计量学方法分析陈皮黑茶样品成分
精密称取干燥茶样2 g至250 mL具塞三角瓶,加沸水100 mL,置沸水浴中浸提30 min,期间每10 min摇瓶一次,浸提结束后,精细抽滤于100 mL容量瓶中,冷却并定容,过0.22 μm滤膜,待测。
色谱条件:使用Thermo Fisher Accucore Vanquish -C18(2.1 mm×50 mm,1.7 μm)色谱柱,流动相A为乙腈溶液,流动相B为0.3%乙酸溶液,梯度洗脱,条件如下:0~45 min,4%~40% A,96%~60% B;45~55 min,40%~95% A,60%~5% B;55~60 min,95%~4% A,5%~96% B,流速0.3 mL/min,柱温35 ℃,进样量10 μL。
质谱条件:UPLC-Q Exactive质谱仪,鞘气流速50 arb,辅助气流速15 arb,喷雾电压3 500 V,离子传输毛细管温度320 ℃,辅助气加热温度300 ℃,全扫描模式,质量扫描范围m/z50~1 500。离子响应大于100 cps、质量数偏差小于50 mDa进行二级质谱信息采集:碰撞能量40 V,开启动态背景扣除。
谱库筛查:利用Compounds Discovery软件,同时参照化合物的同位素分布和精确质量数匹配信息(匹配误差小于5×10-6),结合化合物的二级质谱信息,利用mzVault(含1 200多种中药化合物标准品一级、二级碎片质谱图信息)、mzCloud(化合物高精确质量数碎片数据库)、ChemSpider等数据库进行化合物谱库匹配。
1.3.5α-葡萄糖苷酶活性抑制率的测定
精密称取2 g茶样,置于100 mL具塞锥形瓶中,加入30 mL沸水,沸水浴浸提45 min,期间每10 min摇匀一次,冷却后3 000 r/min离心10 min,取上清液。水提物原液60 ℃减压浓缩后,真空冷冻干燥,测得粗提物含量,计算粗提物质量浓度。
α-葡萄糖苷酶使用pH 6.8的20 mmol/L PB溶液稀释至125 U/mL,现配现用。取水提物原液分别稀释10、50、100、200 倍,反应体系为60 μL待测样品加入50 μLα-葡萄糖苷酶和50 μL PNPG,37 ℃、405 nm发射波长条件下,每1 min测定一次吸光度,共测定20 min,抑制率计算如下:
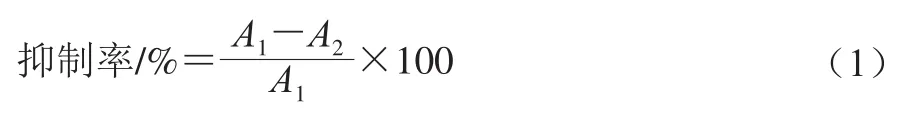
式中:A1、A2分别为空白对照和不同样品溶液在405 nm波长处的吸光度。以粗提物质量浓度为横坐标、抑制率为纵坐标,绘制抑制曲线,计算IC50值。
1.3.6α-淀粉酶活性抑制率的测定
精密称取2 g茶样,置于100 mL具塞锥形瓶中,加入30 mL沸水,沸水浴浸提45 min,期间每10 min摇匀一次,冷却后3 000 r/min离心10 min后,取上清液。
α-淀粉酶使用pH值为6.8的20 mmol/L PB溶液配制成浓度为24 U/mL的工作液,现用现配。反应体系为50 μL待测样品加入50 μL 1 μg/mLα-淀粉酶,37 ℃水浴10 min;随后加入100 μL 1.7%淀粉溶液,37 ℃水浴3 min;取出后加入200 μL DNS显色剂100 ℃水浴5 min;取出后置于冰上迅速冷却;取50 μL反应液加100 μL ddH2O于96 孔板中,在540 nm波长处测定吸光度,抑制率计算如式(2)所示:
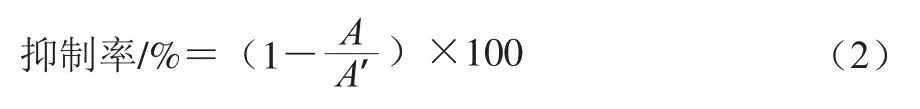
式中:A为扣除本底之后的样品吸光度,A′为扣除本底之后空白对照的吸光度。
1.3.7 脂肪酶活性抑制率的测定
精密称取2 g茶样,置于100 mL具塞锥形瓶中,加入30 mL沸水,沸水浴浸提45 min,期间每10 min摇匀一次,冷却后3 000 r/min离心10 min,取上清液。
猪胰脂肪酶使用pH值为7.4的0.2 mol/L PB溶液配制成质量浓度为0.6 mg/mL的溶液,现配现用。反应体系为20 μL待测样品(阳性对照)加20 μL 4-MUO溶液和130 μL酶溶液,37 ℃条件下,激发波长327 nm,发射波长449 nm,每5 min读取吸光度,测定30 min。抑制率计算同式(2)。
1.4 数据处理
UPLC-Q-Exactive质谱仪采集数据后导入Compounds Discovery软件,噪音过滤、自动排除无用峰等,对数据降维,并使用主成分分析(principal component analysis,PCA)方法进行统计学分析。采用EXCEL软件进行数据分析、GraphPad Prism 7软件作图,数据用±s表示。
2 结果与分析
2.1 发酵前后陈皮黑茶成分差异分析
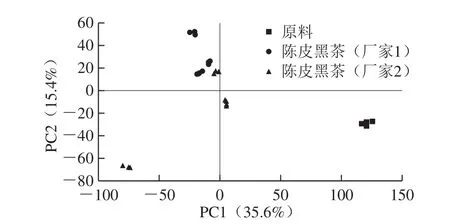
图1 陈皮黑茶原料及成品PCA得分图Fig.1 PCA score plot of raw dark tea and fermented dark tea with Pericarpium Citri Reticulatae
通过高分辨质谱结合化学计量学的方法,根据PCA分析发酵过程对样品成分的影响,考察发酵过程中成分的变化规律,结果如图1所示,发酵改变了陈皮黑茶的原料组成特征。原料与陈皮黑茶成品相比,成分差异显著(P<0.05),说明由于发酵过程中微生物的参与,小分子物质被优先利用形成新的聚合物,大分子物质被微生物分解、利用与转化,生成新的小分子及聚合物,从而形成发酵后新的特征成分组合。来自2 个厂家的陈皮黑茶成分有所差异,使用厂家1的黑毛茶原料发酵而成的陈皮黑茶成品,存放不同时间后,陈皮黑茶成品间成分差异不显著,质量稳定性高。而使用厂家2的黑毛茶原料发酵而成的陈皮黑茶成品,存放不同时间后,其成分差异显著,质量稳定性相对不高,可能是由于原料及工艺的不稳定、贮藏条件的差异等带来成分的差异。因此,为保证产品品质的稳定,应对原料及加工过程进行控制。
2.2 发酵前后陈皮黑茶总多糖、总黄酮及总多酚变化规律分析
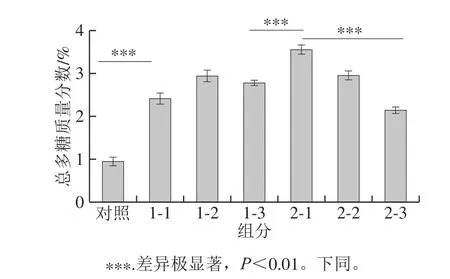
图2 陈皮黑茶总多糖含量结果Fig.2 Contents of tea polysaccharides in raw dark tea and fermented dark tea with Pericarpium Citri Reticulatae
由图2可以看出,原料中总多糖的质量分数为0.96%,经过发酵之后,陈皮黑茶成品中的总多糖质量分数上升至2.15%~3.56%。其中,样品2-1的总多糖含量与其他样品差异极显著(P<0.01),与原料稳定性、发酵程度控制及加工工艺有关。从原料到成品的总多糖含量表现出增加的趋势,除样品2-1外,随着存放时间的延长,成品中总多糖含量出现先增加,后降低的趋势。茶叶原料中的茶多糖被初期微生物分解利用,部分多糖被分解为单糖,表现为总多糖含量下降、还原糖含量的上升,随着发酵程度的加深,微生物种类及丰度的变化,还原糖被优先利用,同时寡糖等成分含量上升,表现为发酵后期总多糖含量的上升。贮存过程中由于环境微生物的参与,多糖、寡糖等成分被分解继而被利用,表现为短期总多糖含量的上升,后期总多糖含量的下降。
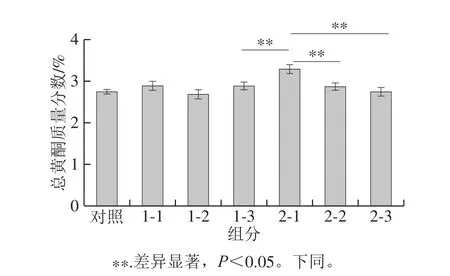
图3 陈皮黑茶总黄酮含量结果Fig.3 Contents of flavonoids in raw dark tea and fermented dark tea with Pericarpium Citri Reticulatae
由图3可以看出,除样品2-1之外,发酵前后陈皮黑茶中黄酮的含量变化差异不显著(P>0.05),总黄酮质量分数在2.69%~2.89%之间。样品2-1含量明显高于其他样品,与原料稳定性、发酵程度控制及加工工艺有关。陈皮是柑橘及其栽培变种的干燥成熟果皮制成,3 a之内称为果皮,3 a以上称为陈皮。陈皮中黄酮类化合物含量较高,标志性的成分如橙皮苷、川陈皮素、橘皮素等,与黑茶共同发酵后,部分黄酮转化为黄酮苷类,但发酵前后黄酮类化合物的总含量差异较小。
茶多酚是茶叶的主要品质成分,柑橘类中也含有较丰富的酚酸类物质。如图4所示,原料中多酚质量分数为14.96%,陈皮黑茶(厂家1)的多酚质量分数为11.00%~12.44%(组内差异不大),陈皮黑茶(厂家2)的多酚质量分数为8.99%~12.02%(样品2-1含量明显低于其他样品,与加工工艺有关)。从原料发酵成为陈皮黑茶产品后,多酚含量呈现下降的趋势,一方面是由于茶叶在发酵过程中,多酚类物质发生氧化、聚合,形成茶黄素和茶红素等成分,导致发酵度高的茶叶中儿茶素类成分含量有一定程度的降低;另一方面发酵过程中微生物的参与,使得陈皮、茶叶中的酚酸类小分子物质优先被利用、转化,从而表现出总多酚含量的下降。
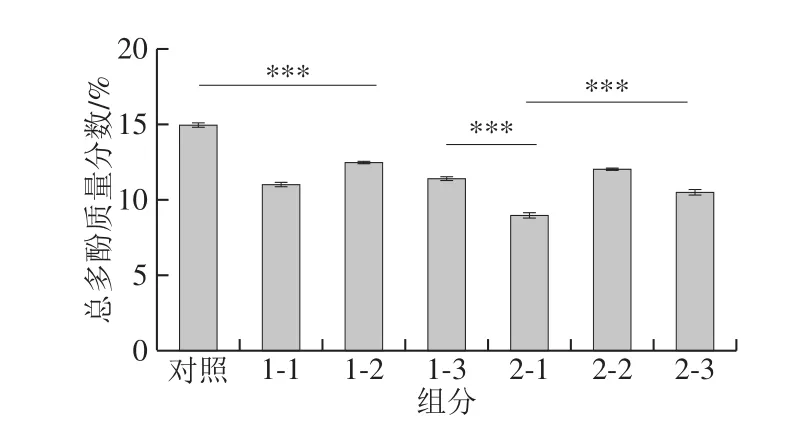
图4 陈皮黑茶样品总多酚含量结果Fig.4 Contents of tea polyphenols in raw dark tea and fermented dark tea with Pericarpium Citri Reticulatae
2.3 发酵陈皮黑茶成分数据库匹配结果
基于高分辨质谱扫描结果,利用mzVault、mzCloud、ChemSpider等数据库进行化合物谱库匹配,再结合化合物的二级结构断裂信息与数据库中的结构式信息,进行化合物的确证工作,判定化合物可能的结构式信息。匹配出的化合物按照综合得分的高低进行排列。陈皮黑茶样品化合物匹配结果见表1,共匹配出31 种化合物,包括酚酸类、黄烷醇类、黄酮及黄酮苷类等物质,其中所有化合物的一级、二级质谱及同位素丰度综合匹配分数均大于85 分。
如表1所示,相对含量在发酵后上升的有13 种,包括柠康酸、川陈皮素、柚皮苷、牡荆素、柚皮素、橙皮素、山柰酚-3-O-香豆酰葡萄基鼠李糖苷、异牡荆素、杨梅素-3-半乳糖苷、槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-鼠李糖苷、山柰酚3-O-α-L-吡喃葡萄糖苷、槲皮素-3-O-鼠李糖苷-7-O-葡萄糖苷、槲皮素-3-O-鼠李糖苷-7-O-葡萄糖苷。相对含量在发酵后下降的有17 种。相对含量在发酵前后基本持平的是阿魏酸。
酚酸类、黄烷醇类、黄酮及黄酮苷类化合物在发酵后均有量的变化,每一种化合物在发酵过程中的变化趋势并不一致。如同属黄酮苷类化合物的柚皮苷、蜜橘黄素和槲皮素、芦丁,前者在发酵过后相对含量较原料上升,后者则表现出下降的趋势。对比山柰酚3-O-α-L-吡喃葡萄糖苷、槲皮素3-β-D-葡萄糖苷及槲皮素-3-O-鼠李糖苷-7-O-葡萄糖苷上升幅度却有不同。
2.4 发酵陈皮黑茶对α-淀粉酶的抑制能力分析
成分变化会导致功效及活性的差异。如图5所示,厂家1的陈皮黑茶样品1-1粗提物在3 个质量浓度下均对于α-淀粉酶都有较好的抑制作用,而且随着粗提物质量浓度的升高,抑制作用增强,减缓淀粉消化分解速率,从而减少葡萄糖的产生,降低血糖水平;样品1-2粗提物仅在低质量浓度(2.17 μg/mL)条件下对α-淀粉酶有较好的抑制作用。厂家2的陈皮黑茶样品,存放1 a后的样品粗提物在低质量浓度(2.17 μg/mL)下对于α-淀粉酶有微弱的抑制作用,其余样品均表现出激活作用,样品2-3粗提物随着质量浓度的增高,对于α-淀粉酶激活作用增强。有研究表明,茶多酚、茶红素和水浸出物与抑制淀粉酶的活性呈显著正相关[33],是多种成分相互作用的结果。
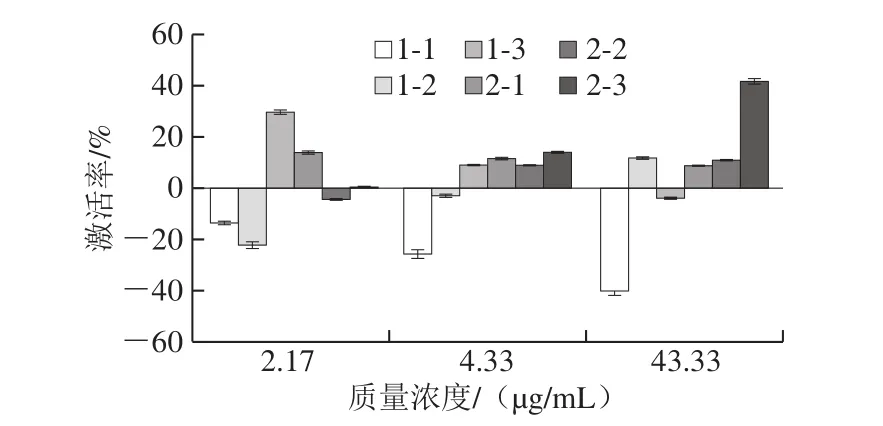
图5 陈皮黑茶粗提物质量浓度对α-淀粉酶的激活率Fig.5 Activating effect on α-amylase of fermented dark tea with Pericarpium Citri Reticulatae
2.5 发酵陈皮黑茶对α-葡萄糖苷酶的抑制能力分析
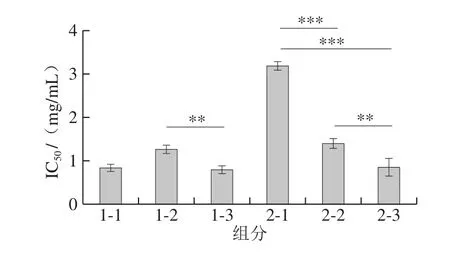
图6 陈皮黑茶对α-葡萄糖苷酶抑制作用IC50结果Fig.6 IC50 of fermented dark tea with Pericarpium Citri Reticulatae for α-glucosidase
如图6所示,发酵陈皮黑茶成品均对α-葡萄糖苷酶有抑制作用。除样品2-1之外,成品对于α-葡萄糖苷酶有很好的抑制作用,IC50值为0.79~1.39 mg/mL,对于厂家1的样品而言,不同存放时间的样品对于α-葡萄糖苷酶的抑制作用始终维持在高水平。费群勤等[34]指出茶多酚和EGCG对α-葡萄糖苷酶有较强的抑制作用。样品2-1的IC50值最大,表明抑制α-葡萄糖苷酶的作用相比其他样品较弱,从而推断其多酚含量在所有样品中含量最低。对于所有陈皮黑茶成品而言,存放1~2 a时间,其IC50值呈现下降的趋势,表明在此期间,陈皮黑茶成品对于α-葡萄糖苷酶的抑制作用增大,与其EGCG的含量有关,有待进一步确认样品中含量的变化规律。
2.6 发酵陈皮黑茶对脂肪酶的抑制能力分析
如图7所示,对于脂肪酶的抑制作用,样品的IC50值为1.93~4.06 mg/mL,陈皮黑茶整体对于脂肪酶抑制作用的IC50值均较高,即陈皮黑茶对于脂肪酶的抑制作用处在较低的水平。通过0~2 a的存放,陈皮黑茶(厂家1)样品的抑制作用差异不显著(P>0.05);陈皮黑茶(厂家2)样品的IC50值差异较大,呈现出先向上升后下降的趋势,说明在该产品的存放过程中成分差异较大,进而导致对于脂肪酶抑制作用差别较大。研究表明,茶褐素、茶多糖与抑制脂肪酶活性能力呈显著相关[33],同时茶多酚和花色苷对脂肪酶的抑制具有一定的协同作用[35]。本研究结果表明样品对于脂肪酶的抑制作用与茶多糖、茶多酚的含量变化趋势基本一致,说明茶多酚、茶多糖是影响陈皮黑茶脂肪酶的活性的主要因素,与已有报道结论一致。
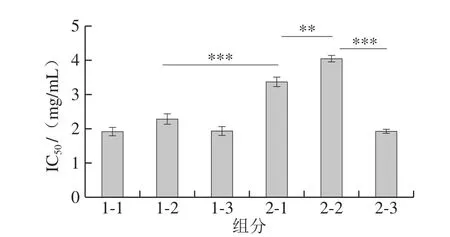
图7 陈皮黑茶对脂肪酶抑制作用IC50结果Fig.7 IC50 of fermented dark tea with Pericarpium Citri Reticulatae for lipase
3 结 论
本研究以一定比例的陈皮和黑毛茶为原料,通过在“发花”前对原料灭菌,再接种特定冠突散囊菌菌株,发酵后形成陈皮黑茶。实验结果表明,由于环境微生物的参与,陈皮黑茶的化学成分发生了显著变化。总多糖质量分数由原料中的0.96%上升至发酵后的2.15%~3.56%;除样品2-1之外,发酵前后陈皮黑茶中黄酮的含量变化差异不显著(P>0.05),总黄酮质量分数在2.69%~2.89%之间。茶多酚含量呈下降趋势(由原料中的14.96%下降至成品中的8.99%~12.44%)。此外,采用高分辨质谱结合数据库信息,共匹配出31 种化合物,包括酚酸类、黄烷醇类、黄酮及黄酮苷类等物质。
不同原料来源的陈皮黑茶成品对于α-淀粉酶的抑制及激活作用存在差异,与其物质成分组成特点有关。样品1-1在3 个浓度下均对于α-淀粉酶有较好的抑制作用,而且随着浓度的升高,抑制作用增强;样品1-2仅在低浓度条件下对于α-淀粉酶有较好的抑制作用。发酵之后的陈皮黑茶成品均对α-葡萄糖苷酶有抑制作用;对于脂肪酶的抑制作用处在较低的水平。
综上所述,原料、加工工艺及贮存环境的不稳定,会导致成品中化学成分组成的差异,并进一步导致功效的差别。为了生产品质稳定、功能明确的功能性食品,需要借助现代科学技术,如食品组学的统计学模型实时监控等,通过对原料与工艺的把控,维持产品特征性成分组的稳定性。本实验对于化合物的确证分析,还需借助代谢组学未知化合物鉴定与确证的方法进行进一步研究。

