橄榄果实潜伏病原真菌的分离与鉴定
陈蓬莲,陈南泉,林河通,,林育钊,陈艺晖
(1.福建农林大学食品科学学院,福建 福州 350002;2.亚热带特色农产品采后生物学(福建农林大学)福建省高校重点实验室,福建 福州 350002;3.福建农林大学农产品产后技术研究所,福建 福州 350002)
橄榄(Canarium album(Lour.) Raeusch),又名青果、青橄榄等,是中国南方亚热带的名特优水果,主产于福建、广东、广西和台湾等地[1-2]。橄榄富含多糖、氨基酸、多酚等营养保健成分,具有生津止渴、开胃健脾、助消化、除口臭等保健功效[3-4],其鲜果及各种加工制品深受消费者喜爱。随着市场、消费者对橄榄鲜果和加工品的需求量增大,橄榄采后病害问题日益突显,现有橄榄保鲜技术已不能满足产业发展和实际生产的需求[5-8]。有研究表明,病原真菌侵染是引起采后橄榄果实腐烂败坏、影响橄榄果实货架期和降低其果实经济价值的主要因素,极大地限制了橄榄果实采后的贮藏、运输和销售[3,9-10]。Seifer[11]和Milholl[12]研究表明,病原真菌的侵染主要是通过其分生孢子从机械伤口、气孔或者是直接穿透表皮入侵寄主,而后在寄主表面形成附着胞进一步入侵,破坏寄主细胞,从而破坏果实表皮细胞而致使果实迅速腐烂败坏。因此,开展橄榄果实的潜伏侵染病害研究,对橄榄果实采前或采后的真菌病害防治,延长橄榄果实货架期,减少其经济损失具有重要意义。
本课题组研究发现,小孢拟盘多毛孢(Pestalotiopsis microspora)是引起采后橄榄果实果腐病和导致果实腐烂的主要病原菌[8,13]。目前,相关研究未能明确导致采后橄榄果实腐烂的主要病原菌种类及其采前侵入时期,为了进行橄榄果实无公害保鲜,本实验以福建省主栽品种‘长营’橄榄(Canarium album(Lour.)Raeusch cv.Changying)果实为研究材料,在橄榄不同生长阶段对其花器、果实上的真菌进行分离和鉴定,旨在明确引起采后橄榄果实贮藏期病害的主要病原真菌种类,并讨论橄榄潜伏性真菌病害的发生规律,为控制橄榄果实采后病害发生、延长其果实贮藏保鲜期和提高橄榄果实的经济价值提供科学依据。
1 材料与方法
1.1 材料与试剂
橄榄样品采自福建省闽侯县白沙镇绿百合农场橄榄果园(商业无污染管理果园):在果园的不同方位选定10 棵‘长营’橄榄树,从橄榄花期至果实成熟期(5~11月)的5 个不同生长阶段取样(图1),即从每株橄榄树随机摘取橄榄盛花期花器(5月28日)、幼果(6月20日)、膨大期果实(7月8日)、成熟前期果实(8月26日)和成熟期果实(11月23日)各30 个,同时也采收果实不同生长阶段的病叶,之后分别装袋、贴标签,采收当天运回福建农林大学食品科学学院食品贮藏保鲜实验室。

图1 ‘长营’橄榄潜伏性侵染病原菌分离的5 个不同时期Fig.1 Five different stages for pathogen isolation from ‘Changying’Chinese olive
马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA) 广东环凯微生物科技有限公司;酒精、次氯酸钠、苯酚、氯仿、异戊醇、十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)等(均为分析纯) 国药集团化学试剂有限公司;真菌通用引物ITS-1(5’-TCCGTAGGTGAACCTGCGG-3’)、ITS-4(5’-TCCTCCGCTTATTGATATGC-3’) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
YXQ-LS-3立式压力蒸汽灭菌器 上海博迅实业有限公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;DRX-260低温人工气候箱 宁波江南仪器厂;Olympus HB光学显微镜 日本奥林巴斯公司;Applied Biosystems实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 潜伏病原真菌的分离与纯化
参考张居念[14]和秦士维[15]等的方法,对橄榄花器、果实进行表面消毒,然后运用常规组织分离法[10,16]得到组织块、并接种在含有100 μg/mL青霉素和100 μg/mL链霉素的PDA培养基平板上,之后放置在人工气候箱中28 ℃恒温培养。当菌落直径长至1 cm左右时,用无菌接种针挑取菌落边沿菌丝、并接种在新的PDA平板上进行培养,重复上述操作3 次,即可获得纯化菌株。
1.3.2 病原菌的致病性测定与形态鉴定
运用科赫氏法则[17-18]进行。采后健康的橄榄果实,经酒精消毒、无菌水清洗晾干,用损伤接种(针刺)法,将菌饼(φ=5 mm)接种在橄榄果实表面,用塑料托盘装接种的橄榄果实、外用聚乙烯薄膜保鲜袋密封包装,在28 ℃人工气候箱中培养;以接种无菌的PDA培养基块(φ=5 mm)作为对照。以上处理重复3 次。病原菌接种橄榄果实发病后,从橄榄果实发病部位再分离病原菌,并与原接种病原菌菌株进行比较,其余橄榄果实继续培养观察、并记载发病症状。
将再分离的病原菌接种在PDA平板上,置于28 ℃恒温箱中培养,根据病原菌在PDA平板上的培养性状、菌落颜色、及显微镜下病原菌分生孢子形态、大小等特征,初步鉴定橄榄病原菌种类,并用显微镜测微尺测量病原菌分生孢子的大小、并拍照记录。
1.3.3 病原菌的分子生物学鉴定
1.3.3.1 菌丝体的收集及其基因组DNA的提取
将病原菌接种于铺有无菌玻璃纸的PDA平板上,置于28 ℃人工气候箱中培养,待菌落快长满整个平板时,用无菌钥匙刮取菌丝体、并用无菌水清洗3 次,然后用无菌滤纸吸干表面水分,液氮研磨后转移至1.5 mL离心管中,运用改良的CTAB法[19],提取病原菌基因组DNA作为PCR扩增的模板。
1.3.3.2 病原菌ITS区PCR扩增及其序列测定
选用真菌通用引物ITS-1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS-4(5’-TCCTCCGCTTATTGATATGC-3’)[20-21]对病原菌基因组DNA进行PCR扩增。
20 μL PCR反应体系:包括10×ExTaqbuffer 2.0 μL,2.5 mmol/L dNTP Mix 1.6 μL,引物ITS-1和ITS-4各0.8 μL,5 U/μL ExTaq0.2 μL,模板0.5 μL,ddH2O 14.1 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35 个循环;72 ℃修复延伸10 min,4 ℃保持。之后用1 mg/mL琼脂糖凝胶电泳法检测PCR扩增产物,电压100 V,时间40~45 min,溴化乙锭溶液染色10 min。
参照SanPrep柱式DNA胶回收试剂盒所介绍的方法,对目的产物片段进行纯化回收。PCR产物序列的测定由生工生物工程(上海)股份有限公司完成。
1.3.3.3 序列比对和系统发育树的构建
测序结果在NCBI网站(http://www.ncbi.nlm.nih.gov/)上进行BLAST分析,获得亲缘关系最近的菌株的ITS序列,运用MEGA 6.0软件的邻接法(neighborjoining,NJ)构建系统发育树[22-24],采用Bootstrapsjoining法进行检验,重复1 000 次。
2 结果与分析
2.1 橄榄不同生长阶段果实和叶片潜伏性真菌的分离结果
在橄榄果实和叶片的5 个生长阶段(盛花期、幼果期、果实膨大期、果实成熟前期和果实成熟期),共分离到6 个属的真菌,分别编号GL-1、GL-3、GL-5、GL-6、GL-7、GL-8,其中以GL-8和GL-3的分离频率最高。在橄榄5 个不同生长阶段的果实和叶片中,分离到的病原菌种类和频率有所差异(表1和表2)。其中GL-8和GL-3在橄榄果实和叶片中的分离频率都最高,而GL-1、GL-5、GL-6和GL-7这4 种真菌的分离频率都比较低。据此认为,GL-8和GL-3是橄榄果实和叶片最主要的潜伏性病原真菌,在橄榄盛花期即可侵染。
进一步比较发现,与果实成熟前期相比,成熟期橄榄果实中2 个主要真菌GL-8和GL-3的分离频率下降(表1),而果实成熟期采收的叶片中GL-8和GL-3的分离频率上升(表2);此外,成熟期橄榄果实中GL-1、GL-5、GL-7的分离频率上升(表1),但果实成熟期采收的叶片中GL-1、GL-5、GL-7的分离频率下降(表2)。因此认为,橄榄果实和叶片的病原菌之间存在相互侵染现象;而成熟期橄榄果实的主要病原真菌侵染源,可能是该病原真菌在橄榄叶片上越夏或越冬造成的。
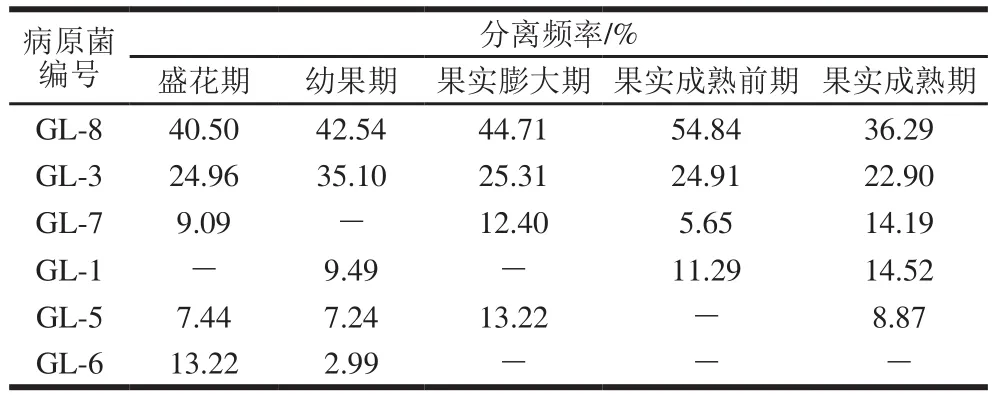
表1 橄榄果实不同生长阶段分离的病原菌种类及其分离频率Table 1 Pathogens isolated from Chinese olive fruit at different development stages and their isolation frequency
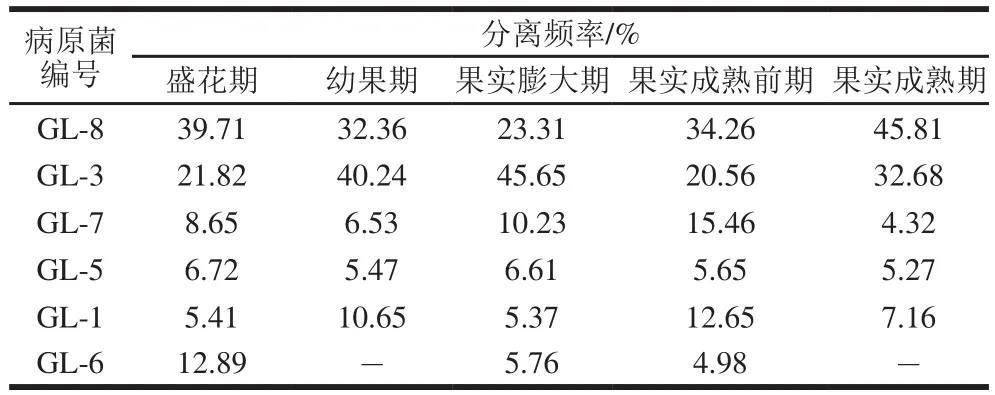
表2 橄榄果实不同生长阶段采收的叶片分离的病原菌种类及其分离频率Table 2 Pathogens isolated from the leaves of Chinese olive at different fruit development stages and their isolation frequency
2.2 2 种主要潜伏性真菌的致病性测定和形态鉴定
2.2.1 GL-8

图2 橄榄GL-8的形态特征、致病性测定及病果症状Fig.2 Morphological features, pathogenicity identification and fruit disease symptoms of GL-8
取无病虫害、无机械损伤的橄榄果实,经表面消毒后,在橄榄果实表面接种GL-8的菌丝块。接种后的第2天,在橄榄果实病原菌接种处出现水渍状病斑;接种后的第3天,橄榄果实病斑上出现稀薄的灰色絮状菌丝;接种3 d之后,随培养时间的延长,橄榄果实的病斑逐渐扩大,培养至第6天,橄榄果实全部腐烂,菌丝逐渐由灰色变为深灰色。而自然未接种的橄榄果实在发病前期,其果实局部变褐色、并伴有较少的白色菌丝;在橄榄果实发病后期,整个橄榄果实表面呈深灰色且部分凹陷,橄榄果实局部出现黑色斑点、并伴有灰色菌丝体。接种GL-8菌丝块的橄榄果实病害症状与自然发病的橄榄果实症状相同(图2A、B);进一步观察证实,从GL-8菌丝块接种的橄榄果实中再次分离病原菌GL-8,在PDA培养基上培养,其菌落形态、菌丝形态及分生孢子与自然分离得到的GL-8相同。显微镜下观察发现,GL-8的分生孢子无色、无隔、纺锤形,大小为(18.0~28.5 μm)×(3.5~6.0 μm)(图2F),分生孢子着生于子囊内(图2D),子囊着生于子囊腔内(图2E)。GL-8在PDA培养基上培养,最初出现白色气生菌丝、而后逐渐变为灰色到深灰色;在PDA培养基上培养的初期,PDA平板背面的颜色为白色,培养2~3 d之后,其颜色从PDA平板背面的中心开始变为墨绿色、橄榄绿,之后着色逐渐扩展到PDA平板背面的边缘、而且PDA平板背面的中心颜色进一步加深,直到整个菌落都成为黑色(图2C)。根据菌落形态、菌丝和分生孢子形态特征,将GL-8初步鉴定为子囊菌门葡萄座腔菌科(Botryosphaeriacea)的小新壳梭孢(Neofusicoccum parvum)。
2.2.2 GL-3
取无病虫害、无机械损伤的橄榄果实,经表面消毒后,在橄榄果实表面接种GL-3菌丝块。接种后的第2天,在橄榄果实病原菌接种处出现淡褐色并伴有微量菌丝(图3B);接种培养后期,橄榄果实表面凹陷、且产生大量的疏松菌丝,菌丝颜色呈白色(图3C)。而自然未接种的橄榄果实发病前期,橄榄果实表面出现微量灰白色菌丝、并伴有不规则黑色斑点;在橄榄果实发病后期,整个橄榄果实被灰白色菌丝包裹,且菌丝体表面伴有黑色小粒分生孢子盘,橄榄果实表面凹陷、且伴有淡黄色晕圈。接种GL-3菌丝块的橄榄果实病害症状与自然发病的橄榄果实症状相同(图3A);进一步观察证实,从GL-3菌丝块接种的橄榄果实中再次分离病原菌GL-3,将其在PDA培养基上培养,其菌落形态、菌丝形态及分生孢子与自然分离得到的GL-3相同。GL-3在PDA培养基上培养,出现白色的菌落及菌丝,并呈现花瓣式轮纹状(图3D)。显微镜下发现,GL-3的分生孢子有5 个细胞,呈纺锤状,中间3 个细胞呈褐色;孢子顶端无色,有2~3 根顶部附属丝;尾部细胞无色,有1 根中生式尾毛(图3E)。根据菌落形态、菌丝及分生孢子形态特征,将GL-3初步鉴定为小孢拟盘多毛孢(P.microspora)。
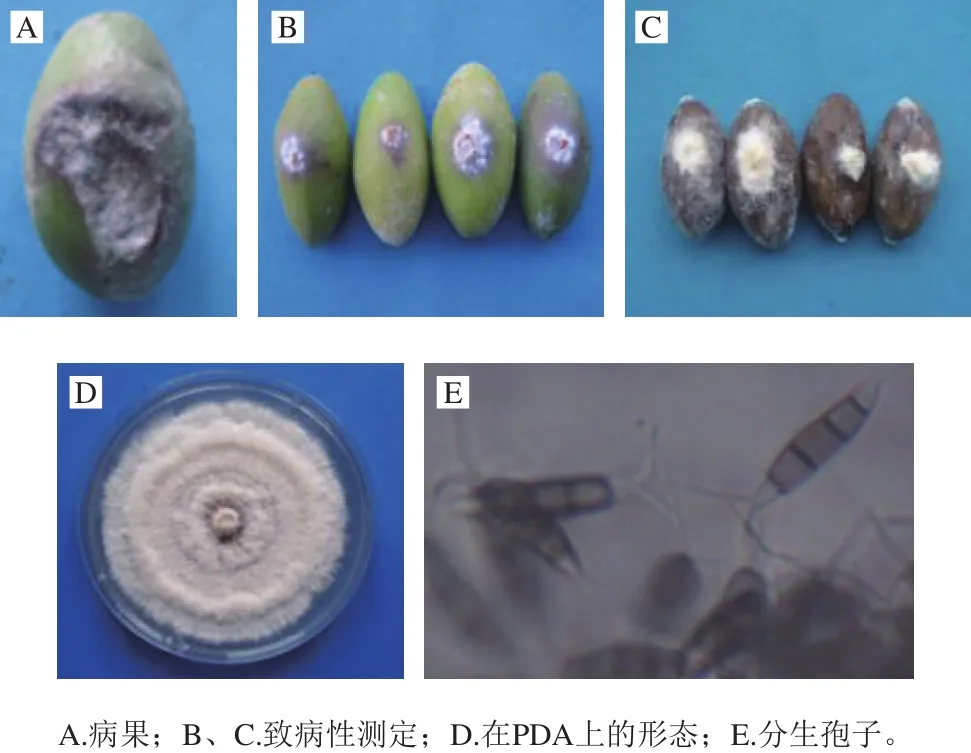
图3 橄榄GL-3的形态特征、致病性测定及病果症状Fig.3 Morphological features, pathogenicity identification and fruit disease symptoms of GL-3
2.3 橄榄果实主要潜伏性侵染病原菌的分子生物学鉴定
2.3.1 基因组DNA提取和PCR扩增
采用CTAB法提取病原菌总DNA,以通用引物ITS-1和ITS-4对分离到的6 种病原菌核糖体基因转录间隔区(ribosomal gene internal transcribed spacer,rDNA-ITS)序列进行扩增,并将得到的PCR扩增产物进行琼脂糖凝胶电泳检测,结果显示,6 种病原菌扩增产物都是单一条带,无非特异扩增现象,且各菌株的rDNA-ITS序列片段大小均在600 bp左右(图4)。

图4 橄榄果实6 种潜伏性病原菌的rDNA-ITS扩增电泳图Fig.4 Electrophoresis of PCR-amplified rDNA-ITS products of six latent pathogens from Chinese olive fruit
2.3.2 rDNA-ITS序列同源性比对及系统发育分析
运用GenBank的序列局部相识查询BLAST工具,在NCBI(http://www.ncbi.nlm.nih.gov/)网站上的GenBank序列数据库中,搜索与上述6 株病原真菌所测得的序列相似的rDNA-ITS序列,并进行分析比较。然后用MEGA6.0软件的NJ法构建系统发育树,并通过Bootstraps法进行检验,重复次数为1 000。
如表3和图5所示,分离到的6 种病原真菌与相关属内参比菌株的rDNA-ITS序列相似度都为99%或100%。据此认为,GL-1为拟茎点霉属(Phomopsis)、GL-3为小孢拟盘多毛孢(P.microspora)、GL-5为革菌属(Phanerochaete)、GL-6为出芽短梗霉(Aureobasidium pullulans)、GL-7为球座菌属(Guignardia)、GL-8为小新壳梭孢(N.parvum)。
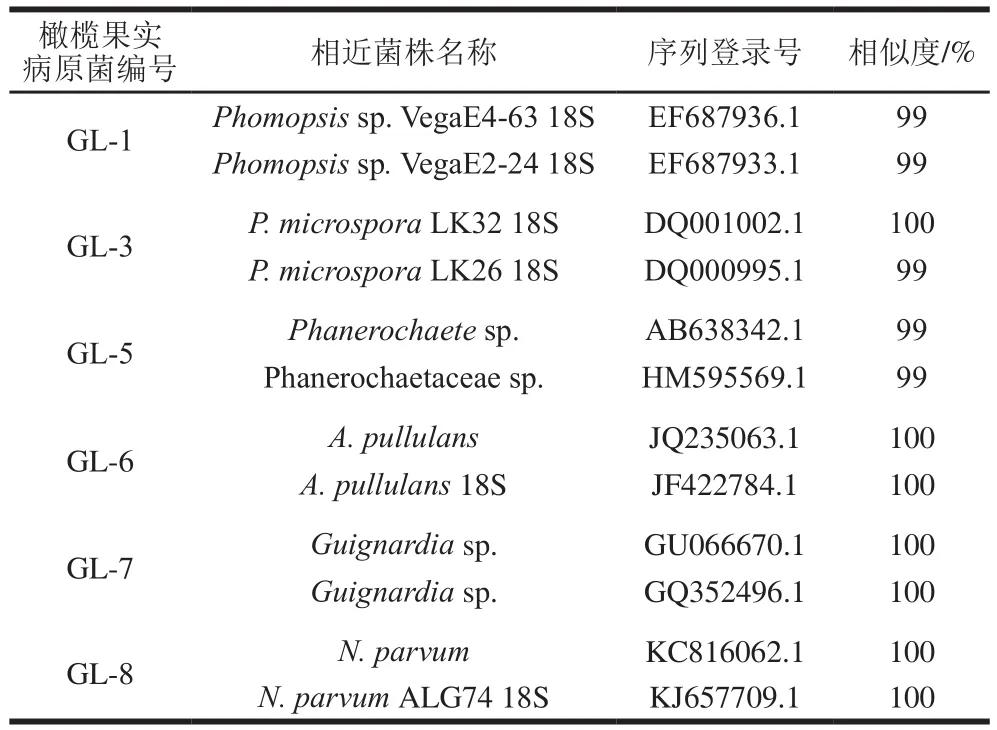
表3 橄榄果实病原真菌rDNA-ITS序列与相近菌株相似性比对Table 3Similarity of rDNA-ITS sequence between strains isolated from Chinese olive fruit and related strains
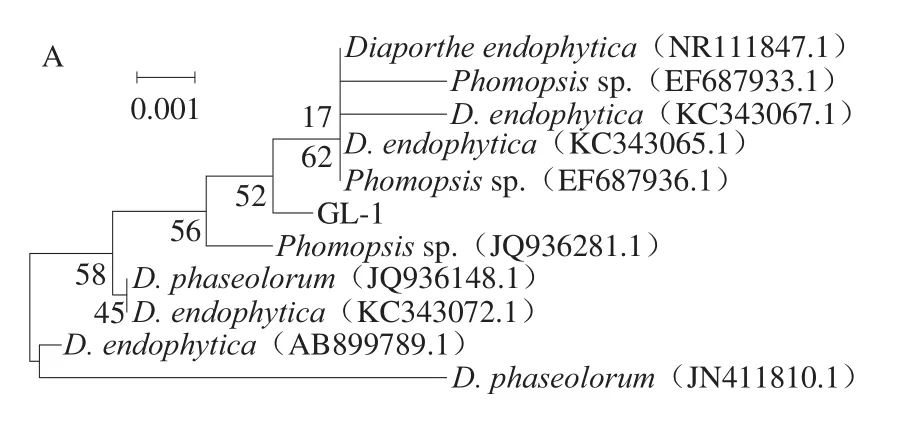

图5 橄榄果实6 种潜伏性病原菌的系统发育树(NJ法)Fig.5 Phylogenetic tree established by the Neighbor-joining method for each of six latent pathogens from Chinese olive fruit
3 讨 论
陈瑾[25]和张绍升[26]等从橄榄果实中分离到多种病原微生物,但未能明确导致采后橄榄果实腐烂的主导病原真菌种类、及其侵入时期。本实验采用组织分离法,在橄榄不同生长阶段的果实和叶片中,分离出橄榄潜伏病原真菌种类、并统计其分离频率,进一步对橄榄潜伏病原真菌的致病性测定、形态学鉴定和分子生物学鉴定,明确了橄榄果实采后贮藏期腐烂败坏、主要是由于病原真菌的采前潜伏侵染所导致,且明确了主要病原菌种类为小新壳梭孢(N.parvum)和小孢拟盘多毛孢(P.microspora)。而球座菌属(Guignardia)、拟茎点霉属(Phomopsis)、革菌属(Phanerochaete)和出芽短梗霉(A.pullulans)等病原菌在橄榄不同生长阶段的分离频率都处于较低水平,这可能是由于橄榄果实中存在抗性物质、能有效抑制以上分离频率较低的4 种病原真菌生长,或者是由于病原菌生长的竞争作用、导致以上4 种病原真菌不能有效生长繁殖。
此外,本实验通过分离橄榄果实不同生长阶段叶片的病原真菌种类、并统计其分离频率,发现各生长阶段的橄榄叶片主要病原菌种类与橄榄果实的主要潜伏性病原菌种类一致。因此认为,橄榄果实和叶片的病原菌之间存在相互侵染的现象。
属于葡萄座腔菌科(Botryosphaeriacea)的小新壳梭孢(N.parvum)是导致柑橘[27]、草莓[28]、鳄梨[29]、苹果[30]、桃[31]、葡萄[32]等果实腐烂的病原菌,N.parvum侵染果实初期,在果实表面会出现水渍状凹陷;随着果实腐烂的加剧,果实表面产生大量菌丝,随后干瘪,表面长出许多黑色分生孢子器。小孢拟盘多毛孢(P.microspora)是番石榴果实的重要致病菌,该病原菌爆发会严重影响番石榴果实品质及其经济价值[33]。本实验研究发现,N.parvum和P.microspora在橄榄盛花期就已经潜伏侵染于花器中,而病原菌的活性一直处于较低水平,待橄榄果实采摘后,因采后橄榄果实抗性下降,其病原菌活性增强,从而导致采后橄榄果实病害大量爆发、果实腐烂败坏,严重影响橄榄果实经济价值。
本研究选用橄榄花器、果实作为实验材料,对其潜伏性病原真菌进行分离、鉴定。由于病原菌的生长繁殖受外界气候条件影响较大,且同一橄榄品种在同一地区不同年份、及不同橄榄品种中,其病原菌种类及其分离频率存在一定的差异,具体差异有待于进一步研究。此外,本实验尚未研究橄榄病原菌的侵染来源及其侵染过程,因此,需要进一步研究橄榄病原菌的来源及其侵染机制,将为橄榄果实采前病害的防治提供理论依据。
另外,本实验虽然已鉴定出N.parvum、P.microspora为橄榄果实最主要的潜伏性病原真菌,但有关自然状态下贮藏,这2 种病害的发生率值得进一步研究;另外,本实验研究认为,橄榄潜伏性病原真菌推测为盛花期侵染,但病原真菌在盛花期侵染后潜伏于何处、最后又如何转移到橄榄果实上,病原真菌在盛花期侵染如何在橄榄果实上潜伏至采后贮藏后期,以及橄榄果实不同部位潜伏侵染菌分布是否存在差异等问题值得今后进一步探讨。
4 结 论
综合以上分析,发现小新壳梭孢(N.parvum)、小孢拟盘多毛孢(P.microspora)、拟茎点霉属(Phomopsis)、革菌属(Phanerochaete)、球座菌属(Guignardia)、出芽短梗霉(A.pullulans)6 种病原真菌是引起采后‘长营’橄榄腐烂的病原菌。其中小新壳梭孢(N.parvum)和小孢拟盘多毛孢(P.microspora)为‘长营’橄榄果实最主要的潜伏性病原真菌,在橄榄盛花期即可侵染。上述结果为制定病原真菌采前侵染橄榄果实的控制策略提供科学依据,进而为控制橄榄果实采后病害发生、延长其保鲜期提供一定科学依据和生产实践指导。

