甲醛和苯复合污染下悬垂植物叶绿素含量变化
鲁敏周智敏谭蕾张凌方
(1.山东建筑大学 学报编辑部,山东 济南250101;2.山东建筑大学 艺术学院,山东 济南250101)
0 引言
随着人类社会发展进程的加快,现代人的工作、生活方式也发生了转变,人们在室内工作、学习及生活的时间逐渐增多,约有>80%的时间都在室内度过,为此室内空间作为现代人们长期工作、生活的主要场所,已成为决定并直接影响人们身心健康的重要人居生态环境[1-3]。 然而,当今人类已经进入了以室内化学污染为主的“第三污染期”,尤其是称之为“室内三大隐形杀手”的甲醛和苯是室内化学污染的主要污染物,具有强致癌性,并对人类的生命健康与安全具有严重的威胁,因而寻求安全、有效地清除室内化学污染的手段已经成为当前人们研究的重点与难点[2,4-8]。
诸多研究表明,植物对室内甲醛和苯等化学污染有很强的吸收、净化能力,而室内植物可以在室内环境空间长期、稳定的生长,不仅具有极高的观赏价值,而且还具有吸碳放氧、杀菌保健等多种功能,所以利用植物治理室内化学污染具有安全、美观、经济、持续高效等优点,目前已成为室内化学污染生态修复技术的前沿和热点[9-15]。 植物对室内污染物必须具有较强的抗性,才能在污染环境中生存并能生长良好,此为室内植物能够最大限度并长期可持续发挥对污染物吸收净化能力的前提和基础,为此研究室内植物对化学污染物的抗性能力,以筛选抗性强的室内植物是净化、修复室内污染的有效途径和重要手段[16-17]。
植物叶片作为植物与外界环境进行气体交换的主要场所,叶片上的气孔是植物呼吸的通道,当植物受到室内空气化学污染的侵害时,会在植物叶片产生生理反应,通过测定植物体内各项生理生化指标的变化情况,可以了解植物对室内化学污染的抗性能力大小和强弱。 其中植物体内叶绿素(Chl)含量变化是判断植物受室内空气化学污染胁迫下抗性大小的重要依据[18]。
Chl 是植物的主要光吸收色素,在室内化学空气污染等不良环境迫害下,由于组织缺水导致植物叶片气孔关闭,使叶绿体受伤,致使植物体内部分参与光合作用的酶变性甚至失去活性,从而使Chl 的含量降低[19-21]。 以往研究表明,室内化学空气污染气体的浓度和胁迫时间与植物体内Chl 含量变化率成正比例关系[22]。 不同植物处在同样的污染环境中,体内Chl 含量变化率也有所不同,抗性植物体内受到的Chl 合成抑制性较小,植物体内Chl 含量变化率越小,表明其对空气污染的抗性较强[23]。 通过测定经室内空气化学污染前后植物体内的Chl 含量及其变化率,能够筛选出对室内空气化学污染抗性较强的植物[19]。
目前室内植物治理甲醛和苯单一污染的研究较多,对甲醛和苯的复合污染抗性研究报道较少[24]。但是室内污染并不是单一的某种污染物质,室内环境污染物质是多种复合、长期动态变化的过程,因此研究不能局限于单一的甲醛和苯的污染[25]。 室内悬垂植物以其优美的造型和灵活的室内空间布置,而备受居民的青睐,成为了室内植物观赏应用的主要类型。 为了研究室内悬垂植物对甲醛和苯的复合污染的抗性能力,研究采用人工熏气模拟实验,通过方差分析和多重比较及差异显著性检验,分析8 种常见的室内悬垂植物在3 种不同浓度甲醛和苯胁迫下的Chl 含量变化,并运用隶属函数值法对室内悬垂植物的抗性能力与强弱进行综合评价排序,从而为选择高效清除室内化学污染的植物提供科学依据[26]。
1 材料与方法
1.1 实验材料
1.1.1 实验地点
实验在山东建筑大学市政与环境工程学院实验室中进行。
1.1.2 植物试材
选用栽培养护年限和株形大小与高度基本一致、生长状态良好、栽培基质特性等皆相同的室内悬垂植物共8 种,见表1。

表1 植物试材表
1.2 实验方法
1.2.1 实验设计(1) 实验设备
采用模拟舱密闭熏气法进行植物熏气实验[27-28]。 选择4 个普通玻璃材质厚度为8 mm 的熏气箱,分别标记为1 ~4 号,箱体边长均为80 cm,熏气箱顶盖能够自由拉动,其他箱体部位则用玻璃胶密封之后涂抹少量凡士林试剂;将实验植物与实验试剂放入熏气箱后立即封闭顶盖,并用海绵胶带缠绕密封,避免气体外泄。
(2) 实验环境
将熏气箱内的相对湿度控制为60%,温度控制在(25±0.5) ℃。 为促进甲醛和苯溶液的挥发,在熏气箱内各放置一个小型风扇(安装功率为80 W、额定电压220 V)。 保证4 个熏气箱内基本环境一致。
(3) 植物处理
在1 号熏气箱内放入1 盆受试植物但不注入甲醛和苯溶液,作为空白对照组;另取3 盆植物分别放入2~4 号熏气箱,并分别注入定量的甲醛和苯溶液,随即密封熏气箱,对植物熏气处理24 h。
(4) 实验浓度设置
依据国家室内空气质量标准(0.10 mg/m3的甲醛和0.11 mg/m3的苯)分别设立3 个甲醛和苯复合浓度梯度为F1(1.0 mg/m3的甲醛和1.1 mg/m3苯的复合)、F2(3.0 mg/m3的甲醛和3.3 mg/m3的苯复合)和F3(5.0 mg/m3的甲醛和5.5 mg/m3的苯复合),其中甲醛和苯浓度分别为国家标准的10、30、50倍;以CK 为对照组,甲醛和苯的浓度均为0,具体见表2。 熏气24 h后,随机采取实验植物的叶片,测定实验植物的Chl 含量变化,重复3 次,并记录数据。

表2 甲醛和苯复合污染浓度设置表/(mg·m-3)
1.2.2 指标测定方法
(1) 按照1∶1 的比例将95%的丙酮和95%的乙醇放入烧杯中混合,用搅拌棒充分搅拌均匀后,配制成乙醇丙酮混合液,放入茶色广口瓶,并置于阴暗处进行遮光密封储存。
(2) 将熏气24 h 后的植物从玻璃熏气箱内取出,在植株冠层采用对角线取样法在样点部位采取适量的植物叶片,冲洗后擦干、剪碎,混合均匀,称取0.05 g 作为一次重复实验的植物试材样品放入大比色管中,并向其中加入10 mL 的乙醇丙酮溶液,遮光密封静置36 h 备用。
(3) 吸取大比色管中经过36 h 后遮光密封静置的溶液上清液5 mL,放置于比色皿中,使用紫外分光光度计,在663、645 nm 波长下,分别测定其吸光光度值。
(4) 将读取出的吸光光度值由式(1)~(3)表示为

植物叶片中总Chl 的含量由式(4)表示为

式中:Ca为叶绿素a 的质量浓度,g/L;Cb为叶绿素b 的质量浓度,g/L;C(a+b)为总叶绿素的质量浓度,mg/L。
1.3 统计分析方法
利用Excel 软件对实验测定的叶绿素含量数据进行统计计算,并通过SPSS 24.0 分析软件进行方差分析、多重比较及差异显著性检验后,运用隶属函数值法对8 种室内悬垂植物的抗性能力与强弱进行综合评价排序[29]。
2 结果与分析
在3 种不同浓度(F1、F2、F3)甲醛和苯复合污染胁迫24 h 后,实验植物体内Chl 含量变化结果见表3。
通过分析表3 数据可知,受甲醛和苯复合污染后植物体内Chl 含量与对照相比均呈下降趋势,且Chl 含量变化率随胁迫浓度的增加而增大。 将实验植物种类和甲醛和苯复合污染的浓度作为两个因素,对实验植物体内Chl 含量变化率进行双因子方差分析,其结果见表4。

表3 不同浓度甲醛和苯复合污染后植物Chl 含量变化表

表4 不同浓度甲醛和苯复合污染后Chl 含量变化率方差分析表
通过分析表4 数据可知,植物种类与甲醛和苯复合污染的胁迫浓度对实验植物体内Chl 含量变化率的影响都达极显著水平,以及两因素之间的交互作用对实验植物体内的Chl 含量变化率的影响也达到极显著水平;且胁迫浓度均方比F为224.063,远远大于植物种类的58.884,表明胁迫浓度的对植物体内Chl 含量变化率的影响比植物种类更显著。
2.1 F1 浓度下Chl 含量变化结果与分析
F1 浓度甲醛和苯复合污染胁迫下,对不同种类的实验植物进行Chl 含量变化率的单因素方差分析,分析结果见表5。
通过分析表5 数据可知,当甲醛和苯复合污染的浓度为F1 浓度时,植物种类对植物体内Chl 含量变化率的影响差异达极显著水平,对其进行多重比较,结果见表6。
通过分析表6 数据可知,在甲醛和苯复合胁迫污染的浓度为F1 时,8 种实验植物中,A3(绿萝)的Chl 含量变化率除与A4 差异不显著以外,与其他植物差异皆达极显著水平;A4(金边吊兰)的Chl 含量变化率除与A2 差异不显著以外,与A1、A5、A8、A7之间的差异达极显著水平,与A6 有显著差异;A2(吊竹梅)的Chl 含量变化率与A6 无显著差异,与A7 差异达显著水平,与A1、A5、A8 的之间差异达极显著水平;A6(全绿吊兰)的Chl 含量变化率与A1、A5 的之间差异达极显著水平,与A8 差异达显著水平,与A7 差异不显著;A7(银边吊兰)的Chl 含量变化率与A1 差异极显著,与A5 差异达显著水平,与A8 差异不显著;A8(银心吊兰)的Chl 含量变化率与A1 达显著水平,与A5 差异不显著;A5(金心吊兰)的Chl 含量变化率与A1 无显著性差异。
受F1 浓度甲醛和苯复合污染胁迫后,8 种实验植物体内的Chl 含量较空白实验对照组均有所降低。 其中,A3(绿萝)体内的Chl 含量变化率达40.33%,变化率最大,表明其在F1 浓度甲醛和苯复合污染胁迫下的抗性最弱;A1(常春藤)体内的Chl含量变化率仅为9.44%,变化率最小,表明在F1 浓度甲醛和苯复合污染胁迫下,A1(常春藤)在8 种室内悬垂植物中的抗污染能力最强。
通过分析实验得出的不同实验植物体内的Chl变化率,当甲醛和苯复合污染的浓度为F1 时,综合评价8 种实验植物对甲醛和苯复合污染的抗性能力为:A2(吊竹梅)、A4(金边吊兰)和A3(绿萝)的抗性能力最弱,A6(全绿吊兰)、A7(银边吊兰)、A8(银心吊兰)抗性能力次之,A1(常春藤)和A5(金心吊兰)的抗性能力最强。

表5 F1 浓度下植物Chl 含量变化率方差分析表
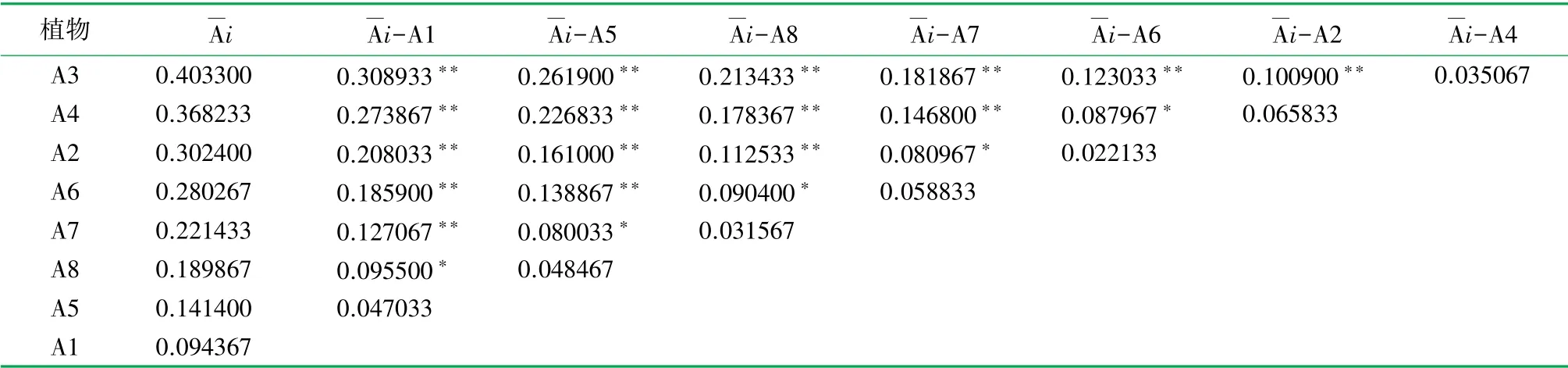
表6 F1 浓度下植物Chl 含量变化率多重比较表
2.2 F2 浓度下Chl 含量变化结果与分析
F2 浓度甲醛和苯复合污染胁迫下,对不同种类的实验植物进行Chl 含量变化率的单因素方差分析,分析结果见表7。
通过分析表7 数据可知,当甲醛和苯复合污染的浓度为F2 浓度时,植物种类对植物体内Chl 含量变化率的影响差异达极显著水平,对其进行多重比较,结果见表8。

表7 F2 浓度下植物Chl 含量变化率方差分析表

表8 F2 浓度下Chl 含量变化率多重比较表
通过分析表8 数据可知,在甲醛和苯复合胁迫污染的浓度为F2 时,8 种实验植物中,A3(绿萝)的Chl 含量变化率除与A4、A2 差异不显著以外,与其他植物之间差异皆达极显著水平;A2(吊竹梅)的Chl 含量变化率除与A4 差异不显著以外,与A1、A5、A7、A8、A6 之间的差异皆达极显著水平;A4(金边吊兰)的Chl 含量变化率与A1、A5、A7、A8 的差异达极显著水平,与A6 有显著差异;A6(全绿吊兰)的Chl 含量变化率与A8 之间差异不显著,与A5、A7的差异达显著水平,与A1 之间的差异达极显著水平;A8(银心吊兰)的Chl 含量变化率与A1 之间的差异达极显著水平,与A5、A7 差异不显著;A7(银边吊兰)的Chl 含量变化率与A1 的差异达极显著水平,与A5 差异不显著;A5(金心吊兰)的Chl 含量变化率与A1 的差异达显著水平。
受F2 浓度甲醛和苯复合污染胁迫后,8 种实验植物体内的Chl 含量较空白实验对照组均有所降低。 其中,A3(绿萝)体内的Chl 含量变化率达48.25%,变化率最大,抗性能力最弱;A1(常春藤)体内的Chl 含量变化率仅为14.90%,变化率最小,表明在F2 浓度下,A1(常春藤)在8 种室内悬垂植物中的抗性能力最强。
通过分析实验得出的不同实验植物体内的Chl变化率,当甲醛和苯复合污染的浓度为F2 时,综合评价8 种实验植物对甲醛和苯复合污染的抗性能力为:A4(金边吊兰)、A2(吊竹梅)和A3(绿萝)抗性能力最弱,A6(全绿吊兰)、A7(银边吊兰)、A8(银心吊兰)抗性能力次之,A5(金心吊兰)和A1(常春藤)的抗性能力最强。
2.3 F3 浓度下Chl 含量变化结果与分析
F3 浓度甲醛和苯复合污染胁迫下,对不同种类的实验植物进行Chl 含量变化率的单因素方差分析,分析结果见表9。

表9 F3 浓度下植物Chl 含量变化率方差分析表
通过分析表9 数据可知,当甲醛和苯复合污染的浓度为F3 浓度时,植物种类对植物体内Chl 含量变化率的影响差异达极显著水平,对不同实验植物Chl 含量变化率进行多重比较,结果见表10。

表10 F3 浓度复合污染下植物Chl 含量变化率多重比较表
通过分析表10 数据可知,在甲醛和苯复合胁迫污染的浓度为F3 时,8 种实验植物中,A2(吊竹梅)的Chl 含量变化率除与A4 无显著差异,与A3 差异显著外,与其他植物之间的差异皆达极显著水平;A4(金边吊兰)的Chl 含量变化率与A1、A5、A8 之间的差异达极显著水平,与A7、A6、A3 的差异显著;A3(绿萝)的Chl 含量变化率与A1、A5 之间的差异达极显著水平,与A8 差异显著,与A7、A6 无显著差异;A6(全绿吊兰)的Chl 含量变化率与A1、A5 的之间差异达极显著水平,与A8 差异达显著水平,与A7差异不显著;A7(银边吊兰)的Chl 含量变化率与A1、A5 差异极显著,与A8 差异达显著水平;A8(银心吊兰)的Chl 含量变化率与A1 差异达极显著水平,与A5 差异不显著;A5(金心吊兰)的Chl 含量变化率与A1 差异达极显著水平。
受F3 浓度甲醛和苯复合污染胁迫后,8 种实验植物体内的叶绿素含量较空白实验对照组均有所降低。 A1(常春藤) 体内的Chl 含量变化率仅为25.91%,变化率最小,表明在F3 浓度下,A1(常春藤)在8 种室内悬垂植物中的抗污染能力最强;A2(吊竹梅)的Chl 含量变化率达67.21%,变化率最大,表明其对F3 浓度的甲醛和苯复合污染的抗性最弱。
通过分析实验得出的不同实验植物体内的Chl含量变化率,当甲醛和苯复合污染的浓度为F3 时,综合评价8 种实验植物对甲醛和苯复合污染的抗性能力为:A2(吊竹梅)、A4(金边吊兰)和A3(绿萝)抗性能力最弱,A7(银边吊兰)、A6(全绿吊兰)、A8(银心吊兰)抗性能力次之,A1(常春藤)和A5(金心吊兰)的抗性能力最强。
3 结论
通过上述研究可知:
(1) 植物种类和复合污染的浓度以及两种因子间的协同作用对室内悬垂植物体内Chl 含量变化的影响差异皆达极显著水平;甲醛和苯复合污染的浓度对植物体内Chl 含量的影响比植物种类更为显著。
(2) 8 种室内悬垂植物在3 种甲醛和苯复合污染的浓度梯度下,体内Chl 含量均有不同程度下降。在F1 浓度甲醛和苯复合污染胁迫下:A3(绿萝)体内的Chl 含量变化40.33%,变化率最大,抗污染能力最弱;A4(金边吊兰)变化率次之,A1(常春藤)体内Chl 含量变化9.44%,变化率最小,抗性能力最强;在F2 浓度甲醛和苯复合污染胁迫下,A3(绿萝)体内的Chl 含量变化48.25%,变化率最大,抗污染能力最弱;A2(吊竹梅)变化率次之,A1(常春藤)体内Chl 含量变化14.90%,变化率最小,抗性能力最强;在F3 浓度甲醛和苯复合污染胁迫下,A2(吊竹梅)体内的Chl 含量变化67.21%,变化率最大,抗污染能力最弱;A4(金边吊兰)变化率次之,A1(常春藤)体内Chl 含量变化25.91%,变化率最小,抗性能力最强。
(3) 综合评定3 种甲醛和苯复合污染浓度胁迫下,8 种室内悬垂植物抗性能力最强的是A1(常春藤),A5(金心吊兰)次之,最弱的是A3(吊竹梅)。

