电针迷走神经对抑郁模型幼鼠海马自噬的影响*
周志强 程 明 刘学军 杨 超
抑郁症作为一种情绪障碍综合征,主要表现为情绪低落、思维迟缓、精神运动性抑制,其患病率、复发率和致残率都较高,给社会和个人带来很大的负担[1]。近20年来因儿童青少年抑郁症较成人抑郁症治疗更为困难,药物不良反应强,自杀率高,受到了越来越多的关注[2,3]。前期研究发现电针刺激迷走神经可明显改善抑郁症青少年患者的抑郁症状[4],但未对其机制进行深入研究。因此,本研究拟选择幼鼠利用慢性不可预知性应激建立抑郁模型,研究电针刺激迷走神经对幼鼠海马齿状回Beclin1、LC3Ⅰ、mToR的影响,探讨其具体机制。
1 对象与方法
1.1 对象 于2017年3~11月选取清洁级Sprague Dawley(SD)幼鼠32只,鼠龄4周,体质量80~100 g,实验室环境温度22~25 ℃,相对湿度50%~70%。实验前适应性喂养14 d,自由饮食进水,然后采用随机数字表法抽取8只作为对照组,余下24只幼鼠建立慢性不可预知性应激(CUS)抑郁模型,造模成功后随机分为CUS组、氟西汀组和电针组,每组8只。
1.2 方法
1.2.1 慢性不可预知性应激模型建立 CUS抑郁模型参照文献[5]制备,选用9种刺激如下:禁水17 h;禁食、禁水20 h;锯屑垫料(100 g)中加入200 ml水湿笼中21 h;45 ℃倾斜鼠笼17 h;持续光照17 h;电击(电压30 V)足底5 s;行为限制2 h;夹鼠尾1 min;4 ℃水温,水深10 cm(幼鼠的后足尖刚能触及桶底)游泳5 min。将应激刺激编号,随机使用,每只幼鼠每天给予一种刺激,共干预28 d。
1.2.2 主要试剂及仪器 盐酸氟西汀胶囊购自礼来苏州制药有限公司(J20130010),LC3Ⅰ多克隆抗体购自abcam公司(ab48394),mToR多克隆抗体购自abcam公司(ab2732),Beclin1多克隆抗体购自abcam公司(ab62557)。显微镜购自日本OLYMPUS(BX43)。
1.2.3 干预方法
1.2.3.1 药物干预 CUS造模成功后腹腔注射氟西汀10 mg/kg,每天1次,注射28 d。同时对照组和CUS组,给予腹腔注射生理盐水10 mg/kg,每天1次,注射28 d。
1.2.3.2 电针干预 1%戊巴比妥钠(0.1 ml)麻醉幼鼠后,在喉头与胸骨之间位置作一纵行切口,将胸骨甲状肌和骨舌骨肌分离后寻找颈动脉鞘。固定幼鼠颈皮和颈肌,使其颈皮和颈肌外翻,使用蚊式止血钳将迷走神经和颈总动脉分离3~4 cm,结扎迷走神经,并保留迷走神经,连接迷走神经远端与双铂电极。术后以5 V、2 ms和1 Hz强度的电能,持续刺激迷走神经远端20 min。以上刺激及治疗均持续28 d。
1.2.4 行为学检测 造模前、刺激前(29 d)、刺激后(57 d)进行。(1)体质量及摄食量:在造模前、刺激前、刺激后测定动物体质量;每日加食物20 g,次日称食物余量,在以上3个时间点8:00进行摄食量测定(20 g-食物余量)。(2)强迫游泳实验:将幼鼠放入高50 cm,直径20 cm 的圆柱形水缸中,水深40 cm左右,每次随机选择2只幼鼠观察。实验开始后1 min为适应时间,适应结束后记录5 min内幼鼠不动时间。
1.2.5 免疫组化 行为学测定后将所有幼鼠麻醉处死,用4%多聚甲醛经心脏灌注固定,取出幼鼠脑组织,4%多聚甲醛固定48 h后,乙醇梯度脱水,石蜡包埋后,在海马平面进行冠状位切片,厚度约5 μm。67 ℃烘片2 h,脱蜡,pH7.4 PBS冲洗3次×3 min,蒸馏水冲洗2次,PBS冲洗2次×3 min,加3%H2O2孵育10 min,PBS冲洗3次×3 min,4℃孵育兔抗鼠Beclin1、LC3Ⅰ、mToR(1∶100)过夜,PBS冲洗3次×5 min,加入二抗,室温孵育2 h,酶联反应,DAB显色,苏木素复染,0.1%HCl分化,切片进行梯度酒精脱水,中性树胶封固,干燥后进行观察。200倍显微镜下观察右侧海马齿状回组织染色情况,棕褐色或棕黄色染色代表抗原的定位。染色强度使用Image-Pro Plus 6.0软件分析,并计算每张切片的平均光密度。
1.2.6 统计学分析 采用SPSS 21.0软件处理实验数据。各组数据之间的比较使用单因素方差分析、LSD-t分析。数据以均数±标准差表示,以P<0.05做为差异有统计学意义的标准。
2 结果
2.1 四组幼鼠体质量、摄食量及不动时间比较 造模后刺激前,CUS组、氟西汀组和电针组的体质量、摄食量均低于对照组,不动时间长于对照组(P<0.01);刺激后,CUS组体质量、摄食量仍低于对照组,不动时间长于对照组(P<0.01);氟西汀组、电针组体质量、摄食量高于CUS组,不动时间短于CUS组(P<0.01)。见表1、表2。

表1 四组幼鼠体质量、摄食量结果比较

表2 四组幼鼠不动时间结果比较
2.2 各组幼鼠海马齿状回Beclin1、LC3Ⅰ、mToR表达 CUS组Beclin1、LC3Ⅰ染色可见海马齿状回胞质内大量棕色或者棕黄色颗粒,平均光密度高于对照组(P<0.01),但mToR染色强度小于对照组(P<0.01)。氟西汀组、电针组的幼鼠海马齿状回中Beclin1和LC3Ⅰ表达水平低于CUS组,mToR表达水平高于CUS组(P<0.01)。氟西汀组和电针组比较差异无统计学意义(P> 0.05)。见图1~3,表3。

表3 四组幼鼠Beclin1、LC3Ⅰ、mToR 蛋白表达情况比较

注:对照组:A1、A2;CUS组:B1、B2;氟西汀组:C1、C2;电针组:D1、D2;

注:对照组:A1、A2;CUS组:B1、B2;氟西汀组:C1、C2;电针组:D1、D2;黑色箭头表示细胞质中的阳性颗粒,方框表示放大的区域
3 讨论
研究表明,大多数抑郁症患者的首次抑郁发作是在青少年时期[5]。2013年的流调显示,我国约有14.81%的儿童检出青少年抑郁症状[6]。因此,抑郁症已成为青少年最常见的情绪障碍,亟需合理治疗与预防。然而,儿童青少年抑郁病因及发病机制不清,目前主要认为与5-HT缺乏、脑源性神经营养因子低水平表达、下丘脑-垂体-肾上腺轴(HPA轴)调控异常、免疫功能紊乱有关[7,8]。但仍有部分患者对抗抑郁药物并不敏感,治疗效果欠佳,并且药物不良反应多,所以仍需探索安全有效的治疗方法。
前期研究发现电针刺激迷走神经可能通过降低炎性因子表达水平缓解抑郁症状[4]。因伦理限制,该研究中并未设置单纯电针治疗组,而刺激迷走神经是通过何种通路降低炎症因子表达,仍需要动物实验验证。慢性不可预知性应激是最经典的抑郁模型[9],本研究中采用该模型造模后发现幼鼠体质量、摄食量低于对照组,不动时间长于对照组,说明幼鼠抑郁模型造模成功。电针刺激迷走神经后,幼鼠体质量、摄食量相比CUS组提升,不动时间则下降,且与阳性对照药物氟西汀比较差异无统计学意义,说明电针刺激迷走神经能改善抑郁症状。
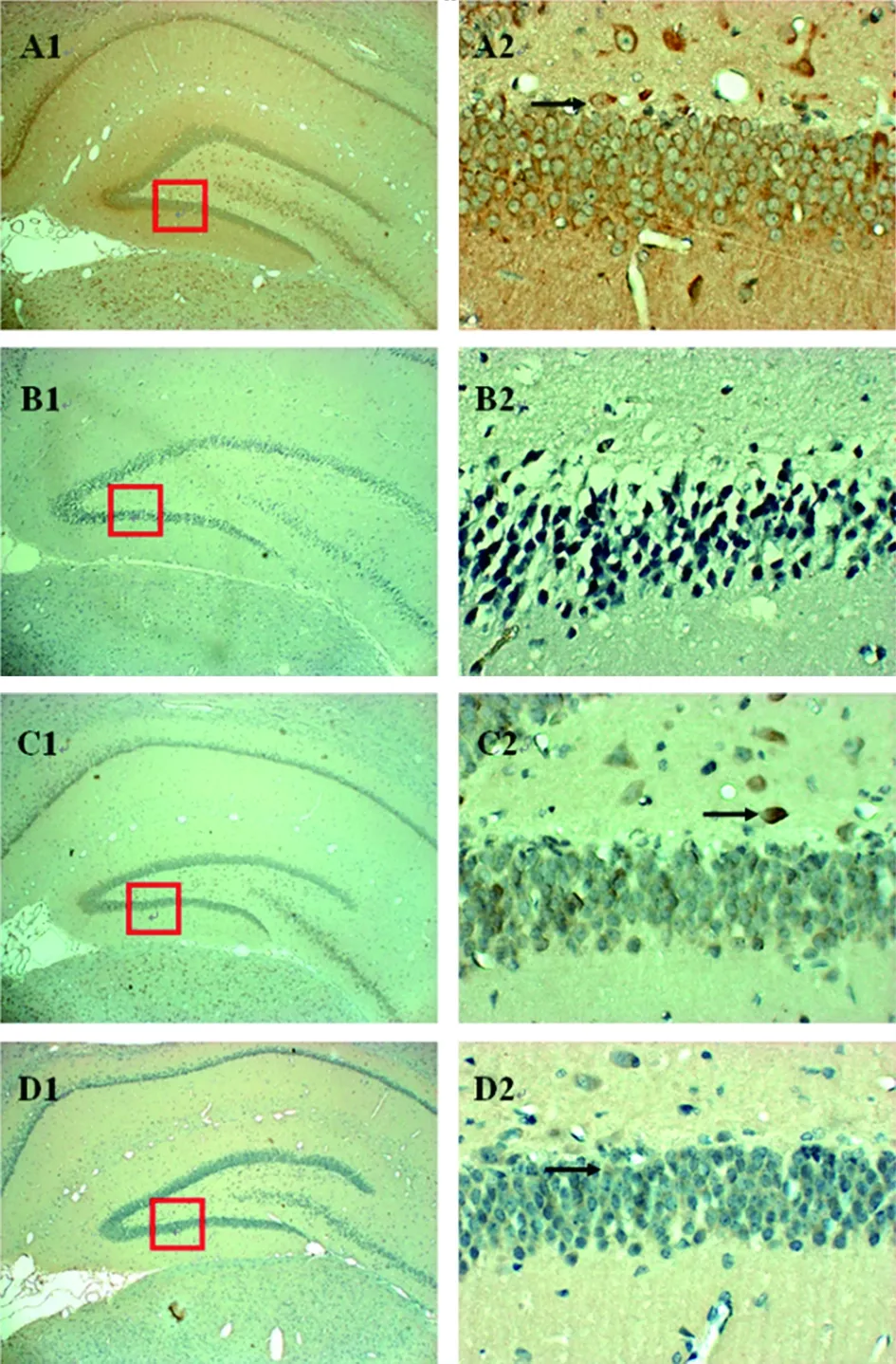
注:对照组:A1、A2;CUS组:B1、B2;氟西汀组:C1、C2;电针组:D1、D2;黑色箭头表示细胞质中的阳性颗粒,方框表示放大的区域
抑郁可促进海马神经元自噬小体的形成,神经元突触前蛋白的合成和功能障碍与自噬的激活相关[10]。哺乳动物雷帕霉素靶蛋白(Mammalian Traget of Rapamycin,mTOR)是一种磷脂酰肌醇-3激酶(Phos-phatidylinositol 3-Kinase,PI3K)相关激酶,主要在蛋白质翻译起始阶段发挥调控作用[11]。上游各种生物信号将PI3K活化后,磷酸化Akt,通过TSC1/TSC2-Rheb 激活mTOR。而mTOR 在体内通过磷酸化两种关键效应物S6K1和4EBP,激活下游通路,影响细胞的生长、凋亡和自噬等[12];Beclin-1通过与Ⅲ型P13K形成复合体,或者与bc l-2/bcl-xl解离诱导细胞自噬[13],从而与抑郁症发病相关[14]。本研究中对抑郁幼鼠海马齿状回Beclin1、LC3Ⅰ、mToR表达进行检测。结果发现,CUS组Beclin1、LC3Ⅰ表达高于对照组,但mToR表达少于对照组。研究证实自噬发生后,细胞内LC3含量以及LC3I向LC3II的转化增多,因此,通过检测细胞内LC3Ih和LC3II的含量变化可以判断细胞自噬是否被激活[15]。且Beclin1与LC3 是自噬的标记蛋白,Beclin1 是形成自噬体的必须分子,LC3 参与了自噬体膜的形成[16]。因此本研究结果说明抑郁幼鼠模型中发生了更多的细胞自噬。电针刺激后,Beclin1和LC3Ⅰ阳性表达降低,mToR表达升高,且与氟西汀比较差异无统计学意义,说明电针刺激迷走神经能抑制抑郁幼鼠模型海马区自噬。
本研究因经费限制未进行性分子生物学验证,且未进行LC3-II/I有关检测,有待进一步研究。

