木藤蓼不同提取部位抑制黄嘌呤氧化酶活性研究
马 倩 赵品成 卢永昌,4*
1.青海民族大学药学院,青海 西宁 8100071;2.青海省青藏高原植物资源化学研究重点实验室,青海 西宁 810007;3.青海省药物分析重点实验室,青海 西宁 810007;4.青海省现代藏药创制工程技术研究中心,青海 西宁 810007
木藤蓼(FallopiaaubertiiL.Henry Holub)为蓼科何首乌属半灌木,常以藤茎入药。藏药名“勒哲”,多生长于海拔900~2000 m的山坡灌丛,主要分布于我国西藏、青海、山西、河南、甘肃等地区。味甘、苦、涩,清热解表,藏医常用其治疗热性隆病、痹病、黄水病引起的关节肿痛[1]。
痛风是由于体内嘌呤代谢或尿酸排泄异常而引发的疾病,目前无法彻底治愈。国内高尿酸血病症患者已高达2亿人,其中痛风病患者已超9000万,且患者人数每年仍持续增长[2-3]。在我国,痛风已然成为仅次于糖尿病的第二大代谢类疾病。
研究显示,黄嘌呤氧化酶(XOD)可以持续氧化次黄嘌呤和黄嘌呤转变为尿酸,尿酸过高是痛风发病的一大诱因,临床上常通过抑制XOD的活性来降低血液中的尿酸水平,从而达到治疗痛风的目的。目前临床常用的XOD抑制剂主要有别嘌呤醇和非布司他[4-5]。但别嘌呤醇有一定的副作用,如肝肾损伤、发烧等,因此别嘌呤醇在临床上的应用受到了一定的限制;非布司他是一种非嘌呤类XOD抑制剂,相比于别嘌呤醇药效更强、更长,毒副作用更小,但实验表明其会加大心血管病的发病率[6]。
中药应用于痛风的治疗早有先例。相比化学药物而言,中药的毒副作用更小。中药材具有多成分协同作用的特点,文献曾报道过多种中药可以通过抑制XOD的活性来治疗痛风。结合藏医临床用药和文献报道,本实验研究藏药材木藤蓼及其不同部位提取物的降尿酸作用及抗痛风作用。用95%乙醇、乙酸乙酯、正丁醇、石油醚和水分别得到木藤蓼5个部位提取物的浸膏,通过研究其对XOD的抑制活性来研究不同部位提取物的抗痛风作用。
1 仪器与材料
1.1 仪器 低温冷却循环机(DLK-2007,宁波新芝生物科技股份有限公司);全自动多功能酶标仪(POLARstarOmega,中国香港伯齐科技有限公司);数控超声波清洗器(KH-300DE型,昆山禾创超声仪器有限公司);高速手提多功能粉碎机(温岭市林大机械有限公司);数显恒温水浴锅(金坛市杰瑞尔电器有限公司);智能型电热恒温鼓风干燥箱(上海琅玕实验设备有限公司);恒温水浴锅(金坛市杰瑞尔电器有限公司);旋转蒸发仪(EYELA-N1100,上海爱明仪器有限公司);电子分析天平(FA1204T,厦门雄发仪器仪表有限公司)。
1.2 试剂 黄嘌呤氧化酶(LOT:X05N6Y5557,上海源叶生物科技有限公司),黄嘌呤(LOT:N1903190023,上海源叶生物科技有限公司),别嘌醇(LOT:L18A6Y3,上海源叶生物科技有限公司),石油醚,乙醇,乙酸乙酯,正丁醇均为分析纯,水为超纯水。
1.3 药材 木藤蓼样品[7-8]于 2018年10月采自青海省西宁市,由中国科学院西北高原生物研究所卢学峰研究员鉴定为木藤蓼正品,原植物图如图1所示。

2 实验方法
2.1 溶液的配置 磷酸缓冲溶液:精密称取14.1 mg乙二胺四乙酸、3.47 g磷酸氢二钾,0.48 g磷酸二氢钾。加入200 mL超纯水超声促溶20 min至溶液呈澄清透明,测定该溶液pH=7.4,将其转移至250 mL容量瓶,定容至刻度线备用。
黄嘌呤溶液:精密称取黄嘌呤3.83 mg,放入25 mL的容量瓶中。加入300 μL 1 mol/L的氢氧化钠溶液超声至完全溶解,使用磷酸缓冲液定容至刻度线,继续超声20 min,得黄嘌呤溶液储备液。
黄嘌呤氧化酶(XOD)溶液:取1 mL90 U·mL-1黄嘌呤氧化酶溶液备用。临用前需用磷酸缓冲液稀释至浓度为0.08 U·mL-1。
别嘌呤醇储备液:准确称取别嘌呤醇68.055 mg,加入5 mL二甲基亚砜溶液,即可得到的别嘌醇储备液[9]。
氢氧化钠溶液:称取氢氧化钠2 g,加入适量超纯水溶解,转移至50 mL 容量瓶,定容至刻度线备用。
2.2 木藤蓼提取物不同部位样品的制备 木藤蓼乙醇提取物的制备:称量25 g木藤蓼药材粉末,加入95%乙醇400 mL,回流提取3次,每次提取60 min。合并3次醇提液,转移至旋转蒸发仪中旋干至无醇味,收集浸膏并称重。
木藤蓼石油醚提取物的制备:将上述得到的浸膏用热水溶解,加入适量石油醚进行萃取,多次萃取直至石油醚萃取液变为无色,合并萃取液,置旋转蒸发仪旋蒸,旋干至无石油醚味,收集浸膏并称重。
木藤蓼乙酸乙酯提取物的制备:在上述石油醚萃取后的水溶液中加入适量乙酸乙酯进行萃取,多次萃取直至乙酸乙酯萃取液变为无色,合并乙酸乙酯萃取液,用旋转蒸发仪旋蒸,旋至无乙酸乙酯味,收集浸膏并称重。
木藤蓼正丁醇提取物的制备:在上述乙酸乙酯萃取后的水溶液中加入适量正丁醇进行萃取,多次萃取直至正丁醇萃取液变为无色,合并正丁醇提取液,用旋转蒸发仪旋蒸,旋至无正丁醇味,收集浸膏并称重。
木藤蓼水提取物的制备:将上述正丁醇萃取后的水溶液用旋转蒸发仪旋干,收集浸膏并称重[10]。
2.3 XOD抑制活性筛选体系的优化 在96孔板中依次加入100 μL磷酸盐缓冲液和50 μL 0.08U·mL-1的黄嘌呤氧化酶溶液,37 ℃条件下孵育3 min,再加入50 μL不同浓度的黄嘌呤溶液(浓度依次为500 μmol/L、400 μmol/L、300 μmol/L、200 μmol/L、100 μmol/L、50 μmol/L、25 μmol/L、12.5 μmol/L)启动反应,每个浓度平行设置三个孔,设置波长为295 nm,在此波长处每隔 19 s 读数一次,记录吸光度,直到各浓度达到平台期,筛选出最佳浓度条件。
2.4 木藤蓼提取物XOD抑制活性筛选取 100 μL样品试液,放入96孔板中,加入50 μL 0.08 U·mL-1黄嘌呤氧化酶,37℃条件下孵育3 min,再加入50 μL浓度为100 μmol/L的黄嘌呤溶液启动反应,于295 nm处每隔19 s读数一次,记录吸光度值A。每组样品平行设置 3个复孔,取平均值。再测定样品试液自身的吸光度和无样品试液时酶与底物反应后的吸光度,按照下列公式[11]计算抑制率。

式中:A样空白:体系中提取物样品溶液的吸光度值,A阴性:体系中无样品溶液时酶与底物反应后的吸光度值,A样:样品溶液酶促反应后的吸光度值。
2.5 统计学分析 通过筛选后的结果,对木藤蓼提取物不同部位的体系浓度进行考察,使用Graphpad Prism5软件来计算IC50。
3 实验结果
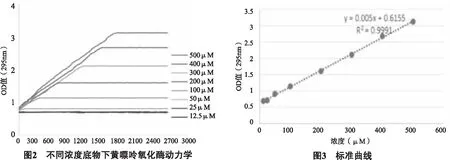
3.1 黄嘌呤氧化酶抑制活性筛选体系优化 酶的底物浓度会对酶抑制剂的活性造成影响,所以必须对底物浓度进行考察,筛选出最佳浓度条件。如图2所示,当酶浓度保持不变时,加入不同浓度的黄嘌呤溶液,反应值与黄嘌呤溶液的浓度成正比,但是当所有酶与底物完全反应后,即使底物浓度继续增加,其中间产物浓度依然保持不变。酶反应速率达到平台期。与酶动力学相符合。当底物的最终浓度是100 μmol/L时,OD值的信号检测窗为0.6~1.2,并且在5 min时达到平台期,此时系统误差最低,并能够确保有充足的操作时间,因而选择在此条件下做下一步的研究。并且得到线性回归方程:y=0.005x+0.6155(R=0.9995)如图3所示。
3.2 木藤蓼XOD抑制活性筛选 木藤蓼95%乙醇提取物、正丁醇提取物、石油醚提取物、水提取物以及乙酸乙酯提取物对XOD的抑制活性见表1。浓度为0.5 mg·mL-1的木藤蓼提取液中,95%乙醇提取液以及正丁醇提取液表现出了较强的XOD抑制活性,乙酸乙酯提取液、水提取液抑制作用次之,石油醚提取液对黄嘌呤氧化酶抑制活性最弱。
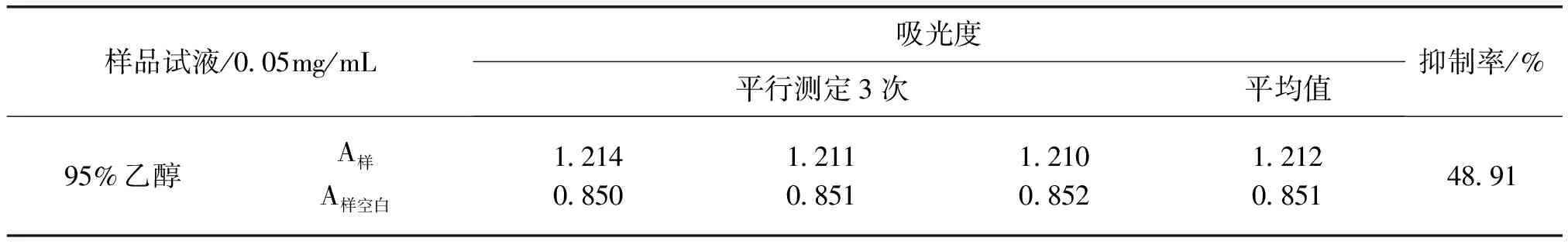
表1 木藤蓼不同溶剂提取物黄嘌呤氧化酶抑制活性结果
3.3 木藤蓼不同部位提取物的活性量效关系 根据筛选出来的结果,将木藤蓼各个部位提取物进行活性筛选,筛选结果见表2。不同部位提取物中,正丁醇部位提取物活性最强[12]。
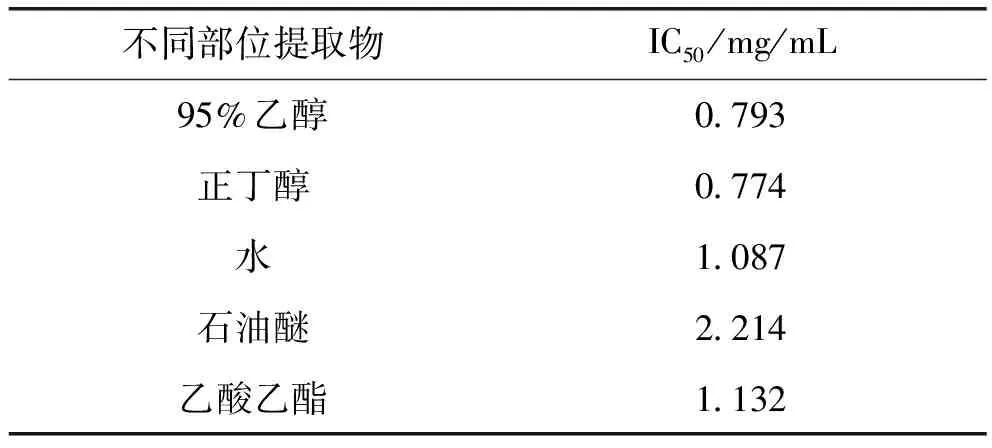
表2 木藤蓼不同部位提取物XOD抑制活性IC50
4 讨论
本次的实验采用体外抑制XOD活性筛选法,对木藤蓼不同部位提取物进行了活性筛选。由于本次实验是一个酶促实验,需要先进行XOD抑制活性筛选体系进行优化,选择合适的底物浓度。酶与底物浓度是否合适,会直接影响到筛选结果的准确性。在此实验中,样品加入后可与酶及底物发生酶促反应,而每次读数均会有微小差异,因此需要设置空白,扣除空白以保证实验结果的准确性。实验证实当黄嘌呤浓度达到100 μmol/L,反应时间为5 min时,OD数值将处于0.6~1.2之间,系统误差最低。
通过筛选后发现,浓度为0.5 mg/mL的木藤蓼95%乙醇部位提取物对XOD有明显的抑制作用,正丁醇部位提取物及水和乙酸乙酯部位的提取物抑制作用次之,石油醚提取物抑制作用最低。IC50越低,表明其对黄嘌呤氧化酶的抑制率越高,活性越强。通过对IC50的数据进行分析,正丁醇部位提取物相对于其他部位提取物显示出了更强的XOD抑制作用。
据国内外药理活性研究报道,芦丁、金丝桃苷具有抗类风湿性关节炎[13-16]的药理作用,多数黄酮类具有抑制黄嘌呤氧化酶的作用[17],文献显示木藤蓼中具有此类化合物[18],也有文献显示,木藤蓼的醇提物对于疼痛反应有明显的抑制作用,可以提高小鼠疼痛反应的阈值,并且可以将缓解由于二甲苯导致的小鼠耳廓肿胀[19],而乙醇和正丁醇部位提取出的物质多为黄酮类,木藤蓼对黄嘌呤氧化酶的抑制作用可能与此有关,但需进行更深层次的研究,其对黄嘌呤氧化酶发挥抑制作用的具体机制也需进一步深入探究。从实验室资金消耗以及木藤蓼资源消耗方面考虑,95%乙醇部位的提取物和正丁醇部位的提取物对XOD的抑制作用相差不大,IC50数值也较接近,若需大量应用时可以同时利用两个部位的提取物,一些情况下也可以选择优先使用水提物,避免资源的浪费。
5 结论
本次实验以紫外分光光度法为基础,测定时间短,数据处理方法简便,证明了木藤蓼不同部位提取物均对黄嘌呤氧化酶有抑制作用,可以同时测定多种药材不同部位提取物对黄嘌呤氧化酶的抑制作用,不仅为进一步开发和合理利用木藤蓼提供依据,也为其他研究提供新的思路。

