二氢姜黄素体外处理BRL-3A细胞对细胞凋亡通路的影响*
吴 刚,陈训军,张万里,李 芬
姜黄素是一种多酚类化合物,可从天南星科和姜科植物的根茎中分离得到,具有多种药理学活性,包括保护肝脏、降脂、抗氧化、抗炎和抗肿瘤作用等,还可以通过修复线粒体功能改善(nonalcoholic steatohepatitis,NASH)病变[1-3]。二氢姜黄素(dihydrocurcumin,DHC)是姜黄素代谢得到的产物之一。关于DHC的药理学活性研究还较少,可能具有改善NASH动物肝脏脂肪沉积和胰岛素抵抗作用,还可能有抗氧化和抗炎作用。 本研究观察了DHC对棕榈酸(palmitic acid,PA)体外诱导的正常大鼠肝细胞系BRL-3A细胞脂肪变的影响,了解其在改善线粒体介导的凋亡通路方面的作用。
1 材料与方法
1.1 细胞、药品、试剂与仪器 正常大鼠肝细胞系BRL-3A细胞购自武汉大学菌种保藏中心,由本实验室保存。DHC单体(上海源叶生物公司,纯度≥98%);PA和MTT(Sigma公司);DMEM高糖培养基(Gibco公司);胎牛血清(四季清生物公司);胰酶(吉诺生物公司);检测LDH试剂盒(南京建成生物公司);检测Caspase-3和Caspase-9试剂盒、RIPA裂解液、SDS上样缓冲液和化学发光液(碧云天生物公司);检测Annexin V-PI凋亡试剂盒(KeyGen公司);抗β-actin、抗Bcl-2和抗Bax(Santa生物公司);BCA试剂盒(Thermo公司);Cocktail(Roche生物公司)。XDS-1B倒置相差显微镜(佳源兴业科技有限公司);iMARKTM酶标仪(BIO-RAD公司);台式低温高速离心机(Eppendorf公司);-80℃超低温冰箱(海尔电器有限公司);超净工作台(安泰空气技术有限公司);HEAR Cell CO2培养箱(Heraeus公司);电泳仪、垂直电泳槽、电转仪(六一仪器厂);Imager2000凝胶成像分析仪(Alpha Innotech公司)。
1.2 细胞培养与分组处理 取BRL-3A细胞,接种于6孔板,培养于含有10%胎牛血清的DMEM高糖培养基,37℃、5%CO2培养。设对照组,用正常培养基培养;模型组,用0.25 mM PA培养24 h和DHC处理组,先用0.25 mM PA培养24 h,再换成含16、32和64 μM DHC的培养基培养24 h。
1.3 细胞存活率检测 将生长良好的细胞按每孔1×103个细胞接种于96孔板,待细胞贴壁后,加入0.25 mM PA培养24 h。然后,分别加入0、2、4、8、16、32、64和128 μM的DHC处理24 h。处理完成后,每孔加入5 mg/ml MTT 20 μl 和PBS 180μl,于37℃反应4 h,再每孔加入DMSO 150 μl,震荡6 min,检测570 nm处的吸光值。
1.4 细胞培养上清LDH含量检测 取细胞1×105个,接种于6孔板。如上处理,每孔吸取上清液20μl,按试剂说明书操作,检测490 nm处吸光值。收集孔中细胞并裂解,检测蛋白浓度,计算每mg蛋白中LDH 含量。
1.5 细胞凋亡检测 接种细胞1×105个于6孔板,同上处理后,消化并收集细胞。按Annexin V-PI凋亡试剂盒说明行染色和冲洗,使用流式细胞仪检测坏死、早期凋亡和晚期凋亡细胞数。
1.6 细胞线粒体膜电位检测 取细胞1×105个,接种于6孔板,处理完成后用PBS洗涤,每孔加入5 μg/ml 的荧光染料JC-1 1 ml,37℃反应20 min,分别检测激发波长525 nm/发射波长590 nm处和激发波长490 nm/发射波长530 nm处的荧光强度,其比值即为样本的线粒体膜电位。
1.7 细胞内Caspase-3和Caspase-9活性检测 取细胞1×105个,接种于6孔板,处理完成后消化并收集细胞,检测蛋白浓度,计算每mg蛋白中Caspase-3和Caspase-9的相对活性。
1.8 细胞Bcl-2和Bax蛋白表达检测 采用Western blotting法检测,取细胞1×105个,接种于6孔板,处理完成后消化并收集细胞,用含有Cocktail和PMSF的RIPA裂解液在冰上处理细胞30 min,将得到的液体在12000 g离心10 min,取上清,获得所需的蛋白液。按50 μg,分装,并100℃变性10 min。用SDS-PAGE胶分离蛋白,电转至PVDF膜上,封闭1 h,分别与特异性的一抗和二抗各孵育1 h,经化学发光液显色,用成像仪分析结果。

2 结果
2.1 各组细胞存活率比较 0.25 mM PA及2、4、8、16、32和64 μM的DHC处理BRL-3A细胞24 h对细胞存活率无显著影响,但128 μM的DHC处理细胞24 h能显著抑制细胞生长,细胞存活率约为模型组的78%(P<0.05)。因此,我们选择16、32和64 μM的DHC进行后续实验。
2.2 各组细胞上清液生化指标比较 与对照组比较,模型组LDH水平、胞内Caspase-3和Caspase-9活性显著升高(P<0.01),线粒体膜电位显著降低(P<0.01);与模型组比较,32μM DHC处理组和64μM DHC处理组LDH水平、胞内Caspase-3和Caspase-9活性明显降低(P<0.05),线粒体膜电位明显升高(P<0.05,表1)。
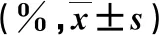
表1 DHC和PA处理的细胞上清液生化指标比较
2.3 各组细胞凋亡情况比较 与对照组比,模型组凋亡细胞率明显增加;与模型组比,PA处理组凋亡细胞率明显降低(图1)

图1 各组细胞凋亡率比较
2.4 各组细胞Bcl-2和Bax蛋白表达量比较 与对照组比,模型组Bcl-2蛋白相对表达量降低(P<0.05),Bax蛋白相对表达量升高(P<0.05);与模型组比,32μM DHC处理组和64μM DHC处理组Bcl-2蛋白相对表达量升高(P<0.05),Bax蛋白相对表达量降低(P<0.05,表2和图2)。
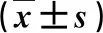
表2 各组细胞Bcl-2和Bax蛋白相对表达量比较
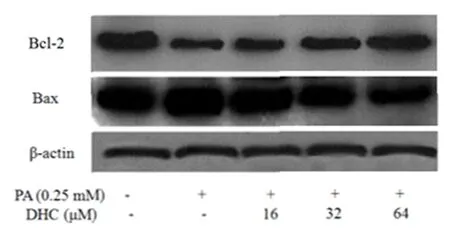
图2 各组BRL-3A细胞Bcl-2和Bax蛋白表达量比较
3 讨论
关于NASH的流行病学研究表明,NASH患者的发病率逐年在增加,在未来十年可能成为肝移植的主要原因。因此,关于NASH的防治研究已成为研究的热点。细胞凋亡与有丝分裂的过程在正常情况下处于平衡状态,维持机体细胞的平衡。但在NASH模型中凋亡占主导地位,凋亡过度会进一步导致肝损伤和氧化应激紊乱等。因此,能否改善肝细胞的凋亡对于NASH的治疗具有重要意义。用脂肪酸刺激肝细胞建立NASH的体外模型较为成熟,为研究药物对NASH的作用机制奠定了良好的基础。
在PA诱导的BRL-3A细胞,我们首先观察到DHC对PA引起细胞LDH的释放有缓解作用。LDH一般存在于细胞质中,当细胞膜受损的时候会被释放到培养上清,因此培养上清LDH越多,代表细胞膜受损越严重[11]。我们的结果显示DHC可以减少细胞LDH的释放,说明DHC可以改善PA引起的细胞膜的损伤。然后,我们用流式细胞仪检测了凋亡细胞情况,结果发现DHC可以减少由PA引起的细胞早期凋亡、晚期凋亡和坏死数量。通过这部分的研究结果,我们推测DHC可以改善脂肪变情况下的细胞凋亡。
在细胞凋亡的过程中,线粒体介导的通路是非常重要的机制之一。线粒体凋亡途径的激活主要与过多的ROS以及氧化损伤相关,它们会破坏线粒体膜的通透性,妨碍线粒体呼吸链的功能,形成凋亡复合物,活化凋亡效应蛋白,加剧肝细胞的凋亡,导致肝损伤。而NASH与线粒体功能紊乱也关系十分密切。因此,我们推测DHC是否可以通过改善NASH模型线粒体介导的凋亡通路来减少细胞凋亡。
为了验证我们的猜想,我们首先检测了细胞线粒体膜电位的改变,结果显示PA会显著降低细胞线粒体的膜电位,DHC可以恢复线粒体的膜电位。线粒体的膜电位被消除,是线粒体介导的凋亡通路被激活的标志,它会导致线粒体内外膜之间的一些通道开放,引发后续凋亡事件的发生[14, 15]。这部分结果说明PA确实会激活线粒体的凋亡通路,而DHC可以抑制该通路。
Bcl-2是一种抗凋亡蛋白,通过保持线粒体膜的完整性来对抗凋亡[16]。Bax是促凋亡蛋白,可以形成Bax孔道,破坏线粒体外膜的通透性,使凋亡因子释放出来[17]。Caspase-3和Caspase-9是线粒体介导的凋亡途径中的效应蛋白分子,它们一旦发生活化,会引起细胞DNA的断裂、细胞核膜的裂解、核内染色质凝聚等,导致细胞凋亡[18, 19]。我们检测了PA和DHC对这两个酶活性的影响,结果发现PA会显著性地增加这两个效应酶的活性,促进细胞凋亡的过程,而DHC可以降低这两个酶的活性,抑制细胞凋亡。

