胺碘酮对人胚肺成纤维细胞增殖及氧化应激的影响
阮宏亘 陈敏菲 周小明 侯若南 王志翊(通讯作者)
(1 长沙医学院临床学院 湖南 长沙 410000)
(2 温州医科大学附属第二医院全科医学科 浙江 温州 325000)
胺碘酮是Ⅲ类抗心律失常药,临床上主要用于治疗室性和室上性心律失常。然而,胺碘酮导致的肺毒性及肺纤维化是其最严重的不良反应,且病死率高[1]。肺纤维化的典型病理学过程为肺泡上皮损伤,炎性细胞聚集,成纤维细胞增殖、活化,细胞外基质过度沉积,最终导致肺组织结构异常[2]。研究表明,成纤维细胞灶的增加是肺纤维化进展和预后不良的重要因素[3],而成纤维细胞的增殖被认为可能与氧化--抗氧化平衡失调有关[4]。目前有关胺碘酮致成纤维细胞氧化应激损伤研究尚未见文献报道,本研究通过不同浓度胺碘酮作用于人胚肺成纤维细胞(human embryonic lung fibroblast,HELF),观察其对HELF 增殖与氧化应激水平的影响,为今后从氧化应激角度寻找胺碘酮诱导的肺纤维化治疗靶点奠定实验基础。
1.资料与方法
1.1 一般资料
1.1.1 主要试剂 盐酸胺碘酮注射剂(杭州 Sanofi-Aventis),胎牛血清、DMEM 培养基(Gibco 公司),细胞计数CCK8 试剂盒(日本同仁),活性氧(ROS)检测试剂盒(碧云天生物技术研究所),超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(南京建成生物公司),HELF 细胞来源于中国科学院昆明细胞库。
1.1.2 主要仪器 酶标仪(美国Thermo scientific 公司)、HEPA CO2恒温培养箱(美国Thermo scientific 公司)、1300 SERIES A2 生物安全柜(美国Thermo scientific 公司)。
1.2 方法
1.2.1 HELF细胞培养与分组 HELF细胞从液氮取出复苏后,置于含10%FBS 和1%青链霉素混合液的DMEM 培养基,37℃、5%CO2的饱和湿度下体外培养。实验分为对照组与胺碘酮组,对照组:单纯细胞培养;胺碘酮组:在对照组基础上分别加入终浓度为(1µg/ml、3µg/ml、6µg/ml)的胺碘酮溶液。以上各组细胞体外培养24h 后,分别观察细胞形态、细胞增殖以及细胞内ROS、MDA 和SOD 水平的改变。
1.2.2 各组HELF 细胞增殖检测 各组HELFs 细胞经0.25%胰酶消化后,加入含血清培养基终止消化,离心,弃上清,再加入无血清的DMEM 培养液,反复吹打细胞,配成细胞悬液。将HELF 细胞以1×104/孔接种于96 孔板,每组设6 个复孔,37℃、5%CO2饱和湿度下培养24h 后,吸去培养液,PBS 液洗涤1次,各孔加入无血清DMEM 100μl 和CCK8 试剂10μl,继续培养3 ~4h,分别于450nm 处测定其OD 值。
1.2.3 各组HELF 细胞ROS 含量检测 采用胰蛋白酶消化HELF 细胞,PBS 液清洗2 次,双氯荧光素(DCFH-DA)作为ROS捕捉剂,以终浓度为10μmol/L 的DCFH-DA 孵育细胞20min,孵育结束后用无血清DMEM 培养液反复洗涤细胞3 次,设置荧光酶标仪激发波长488nm、发射波长525nm 处检测各组细胞内的荧光强度,荧光强度大小可反映细胞内ROS 水平高低。
1.2.4 各组HELF 细胞SOD 和MDA 水平测定 通过胰酶消化收集各组HELF 细胞,用超声波裂解HELF 细胞,经4000rpm 离心15 min,取上清液,BCA 法测定其蛋白浓度。SOD 活性测定采用黄嘌呤氧化酶法,MDA 含量测定采用硫代巴比妥酸缩合法,具体实验步骤参考试剂盒说明书操作。
1.3 统计学方法
数据采用SPSS18.0统计学软件分析处理,计数资料采用率(%)表示,行χ2检验,计量资料用均数±标准差(±s)表示,行t检验,P<0.05 为差异有统计学意义。
2.结果
2.1 胺碘酮对各组HELF 细胞形态的影响
使用倒置显微镜于低倍镜下观察,对照组细胞呈较宽大的纺锤形,与对照组比较,不同浓度胺碘酮组细胞均明显变细变长,细胞胞体变小,细胞数量增多。随着胺碘酮浓度的增加,HELFs细胞形态改变及单个视野细胞数量增加越明显,见图。

图 倒置显微镜观察细胞形态学变化(ⅹ200)A.对照组;B.胺碘酮组(1µg/ml);C.胺碘酮组(3µg/ml);D.胺碘酮组(6µg/ml)。
2.2 不同浓度胺碘酮对HELF 细胞的增殖作用
CCK8 法测得3 个不同浓度胺碘酮组(低浓度到高浓度)OD值分别为(1.11±0.10,1.28±0.03 和1.48±0.06),均较对照组(0.77±0.10)明显升高,差异有统计学意义(P<0.05);随着胺碘酮浓度增加,各组细胞增殖逐渐增加,差异有统计学意义(P<0.05),见表1。
表1 各组HELF 细胞的增值活性比较(±s)
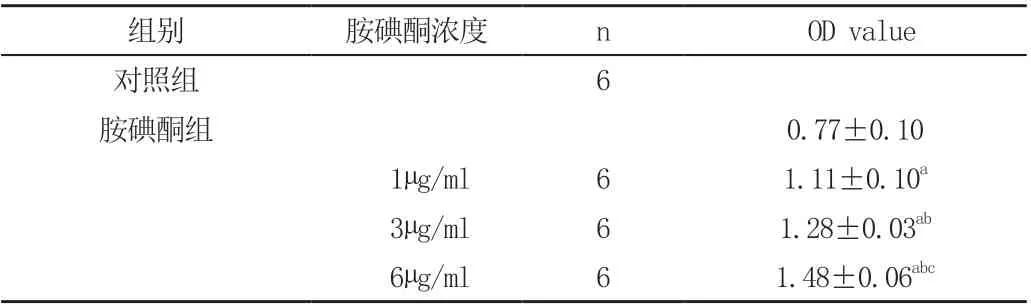
表1 各组HELF 细胞的增值活性比较(±s)
注:与对照组比较,aP <0.05;与胺碘酮组(1µg/ml)比较,bP <0.05;与胺碘酮组(3µg/ml)比较,cP <0.05
组别 胺碘酮浓度 n OD value对照组 6胺碘酮组 0.77±0.10 1µg/ml 6 1.11±0.10a 3µg/ml 6 1.28±0.03ab 6µg/ml 6 1.48±0.06abc
2.3 不同浓度胺碘酮对HELF 细胞的ROS 水平影响
低浓度胺碘酮组(1µg/ml)ROS 荧光强度(4160±175)较对照组(3887±346)有升高趋势,但差异无统计学意义(P>0.05),中、高浓度胺碘酮组(3、6µg/ml)HELF 细胞内ROS 荧光强度分别为(5365±411、6675±246)均较对照组增加,差异有统计学意义(P<0.05);胺碘酮组随着胺碘酮浓度的增加,各组HELF 细胞ROS荧光强度逐渐增强,差异有统计学意义(P<0.05),见表2。
表2 各组HELF 细胞的ROS 水平比较(±s)

表2 各组HELF 细胞的ROS 水平比较(±s)
注:与对照组比较,aP <0.05;与胺碘酮组(1µg/ml)比较,bP <0.05;与胺碘酮组(3µg/ml)比较,cP <0.05
组别 胺碘酮浓度 n ROS对照组 6胺碘酮组 3887±346 1µg/ml 6 4160±175a 3µg/ml 6 5365±411ab 6µg/ml 6 6675±246abc
2.4 不同浓度胺碘酮对细胞MDA 和SOD 活性影响
胺碘酮组(低浓度到高浓度)HELF 细胞MDA 含量分别为(2.05±0.19,2.51±0.17,3.47±0.14)nmol/mg,较对照组(1.33±0.19)nmol/mg 明显升高,差异有统计学意义(P<0.05);胺碘酮组(低浓度到高浓度)HELF 细胞SOD 活力分别为(21.27±0.97,18.05±1.06,13.53±0.98)U/mg,较对照组(24.27±0.83)U/mg 降低,差异有统计学意义(P<0.05);随着胺碘酮浓度的增加,各组HELF 细胞MDA 含量逐渐升高,SOD 活力逐渐下降,差异均有统计学意义(P<0.05),见表3。
表3 各组HELF 细胞的MDA 含量和SOD 活性比较(±s)

表3 各组HELF 细胞的MDA 含量和SOD 活性比较(±s)
注:与对照组比较,aP <0.05;与胺碘酮组(1µg/ml)比较,bP <0.05;与胺碘酮组(3µg/ml)比较,cP <0.05
组别 胺碘酮浓度 n MDA(nmol/mg) SOD(U/mg)对照组 6胺碘酮组 6 1.33±0.19 24.27±0.83 1µg/ml 6 2.05±0.19a 21.27±0.97a 3µg/ml 6 2.51±0.17ab 18.05±1.06ab 6µg/ml 6 3.47±0.14abc 13.53±0.98abc
3.讨论
胺碘酮是临床上用于预防和治疗心律失常的常见药物之一,由于其具有潜在的致命性的肺毒性[5](弥漫性肺纤维化、慢性间质性肺炎和急性呼吸窘迫症等),近年来引起国内外学者广泛的关注。胺碘酮导致肺纤维化的发病机制可能与各种类型的细胞共同作用(肺泡Ⅱ型上皮细胞,炎性细胞,内皮细胞和成纤维细胞),线粒体功能障碍,免疫介导的机制,血管紧张素系统等有关[6]。在本研究中,我们发现胺碘酮诱导HELF 细胞的增值,破坏了HELF 细胞的氧化-抗氧化系统的平衡(ROS,MDA 升高,SOD下降),造成了细胞氧化应激损伤。
肺纤维化是以纤维病灶为基础性的病理改变,主要由大量的细胞外基质和增殖转化的成纤维细胞组成,其中成纤维细胞在肺纤维化过程中起着重要作用。肺成纤维细胞常见为梭形和扁平星形等[7],形态可根据细胞功能变化而改变。本研究中,在胺碘酮诱导下,HELF 细胞增值活跃,细胞明显变细变长,胞体变小,数量增多,并且与胺碘酮的浓度正相关,这说明胺碘酮可促进肺成纤维细胞的增殖,并随着浓度的增加,增殖越活跃。这与临床的发现是一致的,在临床上,胺碘酮的治疗时间和每日的剂量与胺碘酮导致的肺毒性有一定的联系[8]。
近年来大量的临床观察和实验发现氧化应激是肺纤维化形成及发展的重要病理机制之一[9-11]。早在1988 年Cantin AM 等[12]提出了间质性肺炎中存在氧化应激反应。研究发现,ROS 是引起肺损伤的主要原因,并能影响肺组织修复[13]。正常情况下,ROS引发的组织损伤可被内源性抗氧化物质所抑制。然而,当过量的氧化物产生,引起氧化一抗氧化系统失衡时,使得抗氧化物不足以应对,组织就会发生不可逆性损伤[14]。MAD 又称丙二醛,是自由基攻击生物膜时,不饱和脂肪酸发生脂质过氧化反应的产物,可反映机体内脂质过氧化的程度。SOD 是机体内清除氧自由基的主要酶类,在肺组织中有极强的抗氧化力,具有抗氧化、抗炎等作用[15],SOD 活性的大小能反应其抗氧化能力。本研究发现,胺碘酮诱导HELF 细胞产生ROS、增加MDA 含量,降低SOD 活性,且呈现剂量相关性,这表明胺碘酮可能破坏了机体氧化应激平衡,造成了细胞氧化应激损伤,从而促进肺纤维化的进程。
综上所述,胺碘酮诱导HELF 细胞产生氧化应激反应,促进细胞增值,呈现剂量相关性。研究结果提示维持氧化-抗氧化系统的平衡,阻断肺成纤维细胞异常增殖,可能成为治疗肺纤维化的一个靶点。

