姜黄素类似物A13的抗炎机制及其在SMIR术后持续性疼痛中的作用研究
俞聪聪 孔敏 吴凌智 吕扬歌
[摘要] 目的 針对本课题组活性好的姜黄素类似物A13,深入研究其抗炎机制及镇痛作用。 方法 建立大鼠SMIR术后持续性疼痛动物模型,进行行为学测定,测定术前及术后1、3、7、12、22、32 d机械性缩足反射阈值(MWT)和热缩足潜伏期(TWL)。提取原代腹腔巨噬细胞采用细胞NF-κB p65核转移试剂盒进行细胞免疫荧光实验,观察脂多糖(LPS)诱导下A13作用后NF-κB P65核转移情况。 结果 SMIR模型组术后1、3、7、12、22 d MWT均显著低于术前,差异有统计学意义(P<0.05),术后12 d(7.2±0.4)下降最为明显(P<0.05),术后32 d(13.6±0.7)接近于术前水平。与SMIR模型组比较,SMIR+A13给药组术后1、3、7、12、22 d抑制MWT下降,MWT均显著高于SMIR模型组同等时间点,差异有统计学意义(P<0.05),更接近于空白对照组。与Control组比较,SMIR+A13给药组术后3、7 d两天显著低于Control组同等时间点,差异有统计学意义(P<0.05)。三组大鼠的TWL均无明显改变,无显著性差异(P>0.05)。A13能够抑制LPS诱导下从细胞质到细胞核的p65核转移。 结论 姜黄素类似物A13在SMIR术后持续性疼痛中对机械性痛觉具有明显镇痛作用,但对热痛觉无明显作用,其通过抑制NF-κB通路达到抗炎效果。
[关键词] 脂多糖;姜黄素类似物;机械性缩足反射阈值;热缩足潜伏期
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2020)19-0025-04
Curcumin analogue A13 anti-inflammatory mechanism and its role in persistent pain after SMIR
YU Congcong1KONG Min2WU Lingzhi1LV Yang'ge1
1.Department of Pharmacy, Affiliated Hospital of Jiaxing College, Jiaxing First Hospital in Zhejiang Province, Jiaxing 314001, China;2.Department of Anesthesiology, Affiliated Hospital of Jiaxing College, Jiaxing First Hospital in Zhejiang Province, Jiaxing 314001, China
[Abstract] Objective To investigate the anti-inflammatory mechanism and analgesic effect of curcumin analog A13 with good activity. Methods An animal model of persistent pain after SMIR operation was established in rats, and behavioral measurements were performed to determine the mechanical withdrawal threshold (MWT) and thermal withdrawal latency (TWL) before and after 1 d, 3 d, 7 d, 12 d, 22 d, and 32 d of treatment. The primary peritoneal macrophages were extracted. The cell NF-κB p65 nuclear transfer kit was used to perform cellular immunofluorescence experiments. The nuclear transfer of NF-κB P65 after lipopolysaccharide(LPS)-induced A13 was observed. Results In the SMIR model group, the MWT at 1, 3, 7, 12, and 22 days after operation was significantly lower than that before operation, and the difference was statistically significant (P<0.05). The MWT (7.2±0.4) was decreased most obviously at the 12th day after operation(P<0.05), and the MWT(13.6±0.7) of the 32nd day was close to the preoperative level. Compared with the SMIR model group, the SMIR+A13 administration group inhibited the decline of MWT at 1, 3, 7, 12 and 22 days after operation. The MWT in the SMIR+A13 administration group was significantly higher than that of the SMIR model group at the same time point, and the difference was statistically significant(P<0.05), which was closer to the blank control group. Compared with the control group, the MWT of the SMIR+A13 administration group was significantly lower than that in the control group at the same time point on the 3rd and 7th days after the operation, and the difference was statistically significant(P<0.05). There was no significant change in TWL of the three groups, and the results were not significantly different (P>0.05). A13 can inhibit p65 nuclear transfer from cytoplasm to nucleus induced by LPS. Conclusion Curcumin analogue A13 has obvious analgesic effect on mechanical pain in persistent pain after SMIR operation, but has no obvious effect on thermal pain, which can achieve anti-inflammatory effect by inhibiting NF-κB pathway.
[Key words] Lipopolysaccharide; Curcumin analogue; Mechanical withdrawal threshold; Thermal withdrawal latency
炎症是一种由生物或化学因素如烧伤、感染、毒素、苯酚等刺激诱导的复杂生物反应[1]。是多种疾病具有的病症,诸多病症均会伴有炎症的发生。术后持续性疼痛不仅是一种伤害性感受,常还伴有炎性疼痛、神经病理性疼痛及内脏疼痛等,对患者造成极大的痛苦,严重影响康复和生活质量[2-4]。研究表明,姜黄素在体内和体外均有抗炎、止痛效果,但其药动学特征极大限制了其临床应用。以姜黄素为原料改造修饰其结构,合成姜黄素单羰基类似物A13,经活性筛选发现其有较强的抗炎药理作用[5]。本文主要研究A13的抗炎机制及其在大鼠皮肤/肌肉切口牵拉(Skin/muscle incision and retraction,SMIR)术后持续性疼痛中的镇痛作用。现报道如下。
1 资料与方法
1.1 一般资料
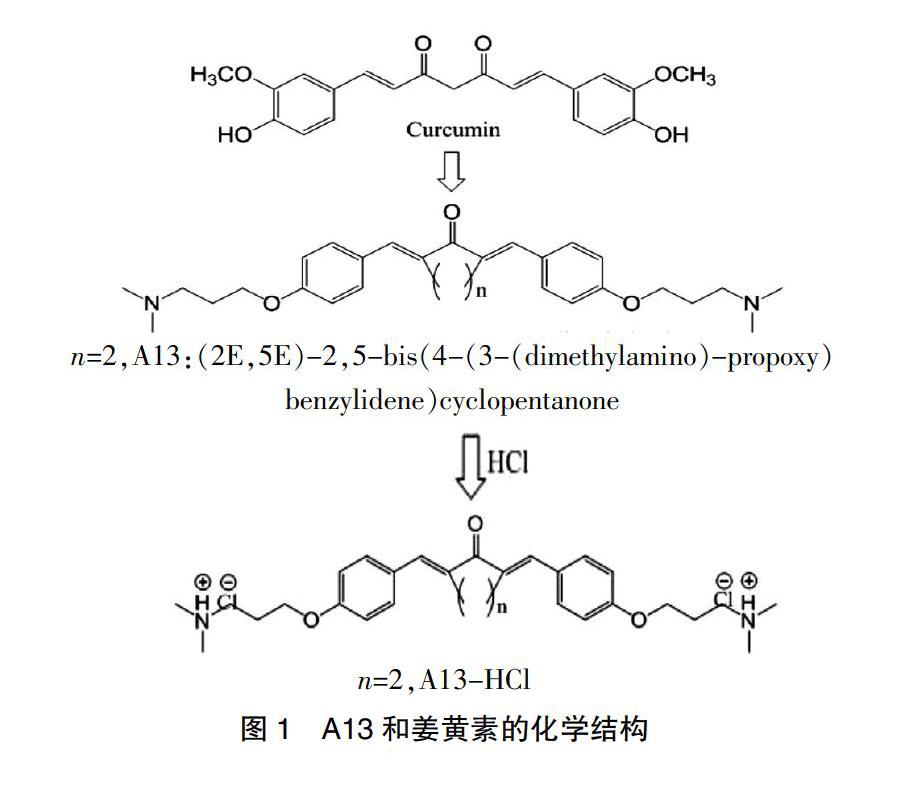
雄性Sprague Dawley大鼠,体重200~230 g,由南京市青龙山动物繁殖场购买,动物合格证号:SCXK(苏)2017-0001。随机分为空白对照(control)组、SMIR模型组、SMIR模型+A13鞘内给药组,每组12只。SMIR模型组大鼠按Flatters法实施SMIR,SMIR模型+A13鞘内给药组在造模前先鞘内注射A13(10 mg/kg),术后每日鞘内注射A13(10 mg/kg)一次,空白对照组不做任何处理。本研究经我院伦理委员会审核。脂多糖(Lipopolysaccharide,LPS)(Sigma-aldrich,USA)、细胞核转录因子NF-κB(Nuclear transcription factor-κB,NF-κB)p65核转移试剂盒(上海碧云天生物技术公司)、熒光正置显微镜(80i,日本尼康)、von Frey纤毛刺激仪(North Coast Medical)、辐射热痛敏刺激仪(中国浙江大学光学系研制)。A13分别与HCl 1:2制成盐酸水溶液(A13-HCl的形式)用于一系列动物实验中。A13溶于水中,pH调至7.26,经0.22 μm微孔滤膜过滤后再使用。A13及其氯化物的结构见图1。
1.2 方法
1.2.1 动物造模 大鼠采用戊巴比妥钠(40 mg/kg,腹腔)麻醉,大腿中段隐静脉靠里边切开1.5~2 cm长度,在浅表肌肉上切开7~10 mm长度,放显微牵开器的条件是可以看到内收肌群肌腱筋膜。在牵开器尖头放到浅表肌肉下方之后,拉开肌肉可以看到内收肌群筋膜,此时,继续拉开肌肉,在持续拉开的1 h内,对切开处注意湿度和温度,时间满1 h,待模型建立后,作术后处理,缝合伤口。按惯例适当进行术后抗菌药物治疗防止伤口感染。
1.2.2 检测方法 ①行为学检测。行为学检测上,分别运用von Frey纤维细丝法检测机械性缩足反射阈值(MWT),足底测痛仪足底痛觉实验(Hargreaves法)检测热缩足潜伏期(TWL),前者针对机械性痛觉,后者针对热痛觉,本研究检测特定的7个时间点分别为术前(未造模)、术后(造模)1、3、7、12、22、32 d。②MWT值检测。大鼠适应环境后安静状态下用von Frey纤维细丝刺激,在一金属筛网上方放置一个有机玻璃箱,等大鼠在箱内适应且安静时,连续刺激其术侧后腿足下方,刺激位置位于中间,时间维持不大于4 s,若看到有抬腿或舔舐足部任一种现象,记作阳性结果。每次检测均重复5次,有≥3次的就记作阳性结果。通过计算5次结果中记作阳性结果的百分数可以得出最大折力阳性结果百分数(用A表示),若不到3次阳性结果的,可以得出阳性结果的最少折力的阳性结果百分数(用B表示)、最大折力(用C表示)、最小折力(用D表示),计算C-[(C-D)/(A-B)] ×(A-50%)得出MWT值。③TWL值检测。大鼠先在有机玻璃箱中适应环境后安静状态下用热痛刺激仪刺激,对足下方进行照射,一直照至出现抬腿现象,得出TWL。每次检测均重复5次,去掉最大和最小值,取平均数。
1.2.3 NF-κB p65核转移 提取原代腹腔巨噬细胞用灭菌水或A13(10 μM)预处理2 h,LPS(0.5 μg/mL)处理1 h后,采用细胞核转录因子NF-κB p65核转移试剂盒进行细胞免疫荧光实验,将细胞培养皿置于荧光显微镜下观察各组情况。最后将红色荧光图和蓝色荧光图叠加起来,观察p65核转移情况。
1.3观察指标
观察并比较三组大鼠(Control组、SMIR模型组、SMIR+A13给药组)SMIR造模前后行为学变化,包括造模前后不同时间MWT和TWL的变化;比较三组细胞(Control组、LPS组、LPS+A13组)p65核转移情况。
1.4 统计学方法
采用SPSS19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组内比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SMIR造模结果
SMIR造模成功,无神经破坏情况,且SMIR造模后大鼠无伤口化脓感染或其他不适现象。
2.2 三组大鼠SMIR造模前后行为学变化比较
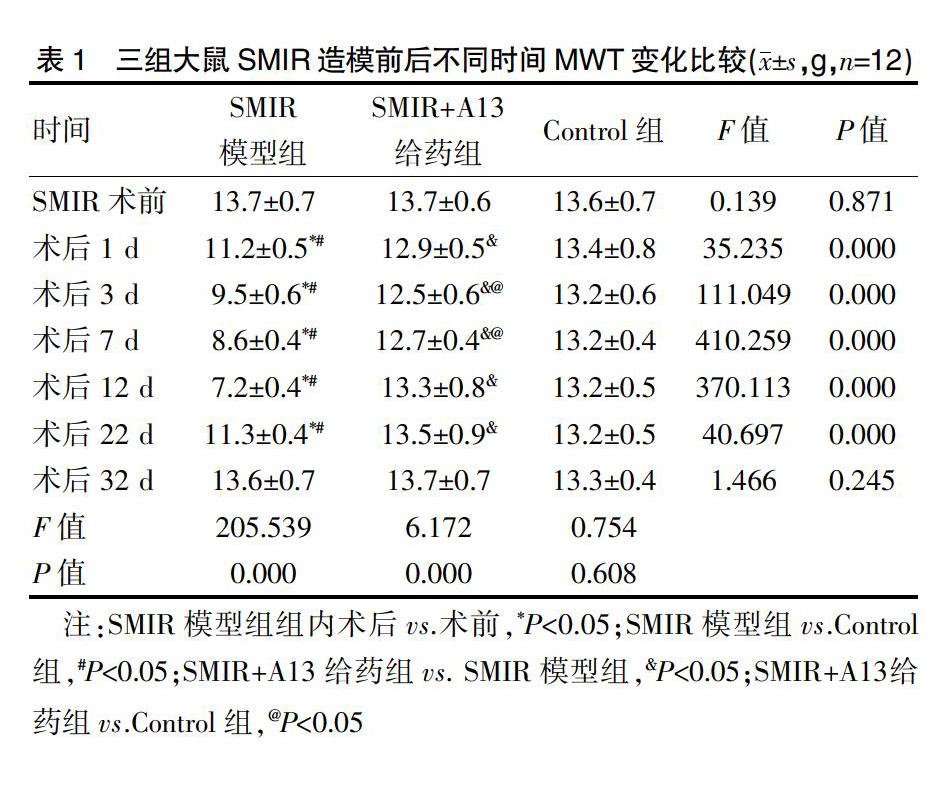
2.2.1 三组大鼠SMIR造模前后不同时间MWT变化比较 SMIR模型组术后第1天即出现明显MWT下降,术后1、3、7、12、22 d均显著低于术前,差异有统计学意义(t=12.520、14.228、19.027、21.960、11.090,P<0.05),其中,术后12 d(7.2±0.4)下降最为明显(t=21.960,P<0.05),术后32 d(13.6±0.7)接近于术前水平,无显著差异(t=0.336,P=0.743),见表1、封三图1。
SMIR模型组术后1、3、7、12、22 d均显著低于Control组同等时间点,差异有统计学意义(t=7.553、13.539、24.828、29.297、9.862,P<0.05)。术前和术后32 d与Control组同等时间,无显著差异(t=0.292、1.259,P=0.773、0.221),见表1、封三图1。
与SMIR模型组比较,SMIR+A13给药组术后1、3、7、12、22 d均显著高于SMIR模型组同等时间点,差异有统计学意义(t=7.326、11.466、23.497、22.385、7.510,P<0.05),更接近于空白对照组。术前和术后32 d与SMIR模型组同等时间,无显著差异(t=0.219、0.468,P=0.829、0.645),见表1、封三图1。
与Control组比较,SMIR+A13给药组术后3 d、7 d两天显著低于Control组同等时间点,差异有统计学意义(t=2.587、2.776,P<0.05)。其他时间点与Control组相比MWT无显著差异(t=0.547、1.736、0.349、0.792、1.766,P=0.590、0.097、0.731、0.437、0.091),见表1、封三图1。
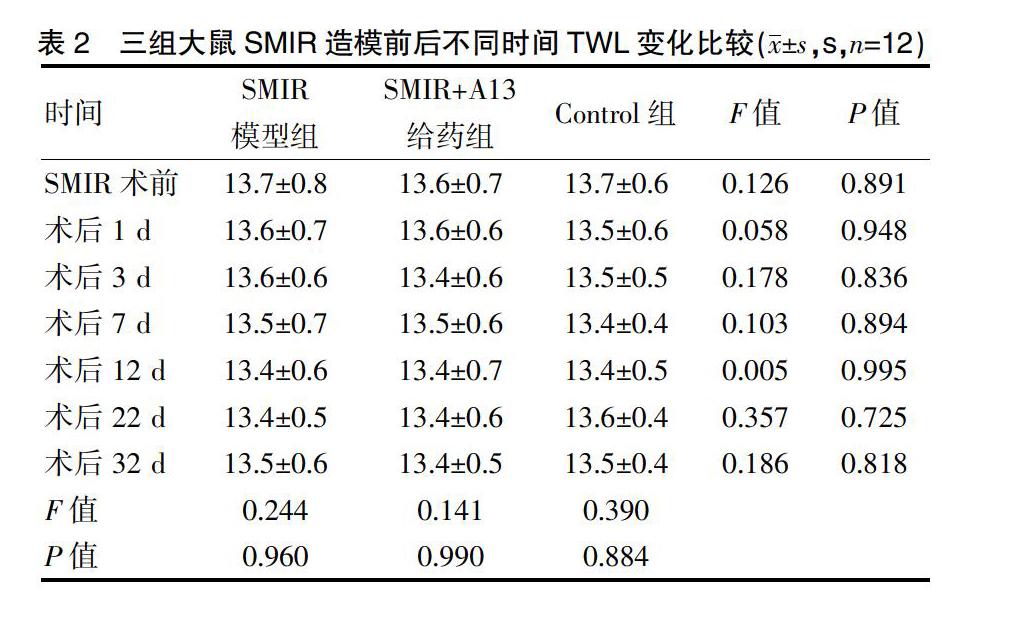
2.2.2 三组大鼠SMIR造模前后不同时间TWL变化比较 各组大鼠手术侧足对热刺激反应的结果显示,SMIR造模前后不同时间,空白对照(Control)组、SMIR+A13给药组和SMIR模型组各组的TWL均无明显改变,三组结果无显著性差异(P>0.05),见表2、封三图2。
2.3 三组p65核转移情况比较
脂多糖(LPS)可增强NF-κB p65核转移(蓝色核内的红色部分),NF-κB的染色为红色荧光,细胞核的荧光染料(4',6-diamidino-2-phenylindole)(DAPI)染色為蓝色荧光。LPS组红色部分集中于核内,且颜色鲜亮,而A13预处理的细胞,LPS诱导后核转移降低,可看出红色部分核外偏多,核内几乎看不到红色,且颜色也较LPS组淡,表明A13在10 μM剂量时抑制了从细胞质到细胞核的p65核转移。见封三图3。
3 讨论
非甾体类药物一直以来都被用作消炎、解热、镇痛的药物。然而其往往会对患者导致严重的副作用[6]。因此,开发一类独特的消炎止痛药在目前来说很有必要。
姜黄素是一种对组织损伤、炎症、增生等具有显著调节作用的物质[7-10]。尽管姜黄素对多种疾病均有调节作用,但其最大的局限性在于新陈代谢快、生物利用度低[11-13]。众多手段包括合成结构相似的姜黄素衍生物等,努力朝着提高其生物利用度方向发展[14]。
A13是我们自行设计并合成的新型抗炎化合物,之前的研究已发现A13能有效抑制各种炎症介质水平[15]。本研究通过NF-κB p65核转移实验,得出A13通过抑制NF-κB信号通路来达到抗炎效果。A13这种化合物被认为是一种很有前途和希望的抗炎止痛化合物。
术后疼痛是临床上一种常见的急性疼痛状态,困扰了诸多患者,给患者带来了痛苦,一直以来术后疼痛是一个研究难点。SMIR造模方式已得到公认,能真切模拟临床手术中持续拉开这个动作,且造模的同时不以破坏其他神经为代价,为研究术后镇痛优选模型,故本研究采用SMIR模型开展研究。
本研究发现SMIR模型组术后1 d即出现明显MWT下降,术后1、3、7、12、22 d均显著低于术前及空白对照(Control)组同等时间点,差异有统计学意义(P<0.05),造模成功,SMIR术后大鼠产生了明显的疼痛,且术后1 d即明显下降,痛感敏感度较高。A13给药组能够明显减少SMIR造模后MWT的变化,A13给药组术后1、3、7、12、22 d均显著高于SMIR模型组同等时间点,差异有统计学意义(P<0.05),术后1 d SMIR模型组MWT明显下降,而A13给药组MWT下降不明显,基本接近空白对照组,在术后12 d模型组下降最明显时,A13给药组仍接近空白对照组,A13减少了MWT下降,故本研究得出A13对SMIR术后有较明显的镇痛作用,与SMIR模型组相比,A13缓解了大鼠SMIR术后产生的疼痛,使其痛感的敏感度下降。
A13给药组是否对SMIR术后所有疼痛均有明显作用呢?事实上A13并非作用于所有疼痛,本研究另一个行为学研究了SMIR术后TWL的变化:三组大鼠SMIR造模前后不同时间TWL均无明显改变,三组结果无显著性差异(P>0.05),MWT针对机械性痛觉,TWL针对热痛觉,说明A13对SMIR术后的机械性痛觉有明显镇痛作用,但对热痛无明显作用。
针对有明显作用的机械性痛觉,A13是否可以达到完全镇痛效果,使给药组大鼠在SMIR术后MWT与Control组无统计学差异呢?本研究发现SMIR+A13给药组术后3、7 d两天显著低于Control组同等时间点,差异有统计学意义(P<0.05),且在术后3、7 d两天显著高于SMIR模型组同等时间点,差异有统计学意义(P<0.05),说明A13虽然有明显镇痛作用,但尚未达到完全镇痛,术后3、7 d两天与Control组比较有显著性差异,A13可能只作用于疼痛机制中的某一条或几条信号通路,并未作用于所有的信号通路[16-17],故其镇痛作用虽强,但尚未达到完全与Control组无差异。
有研究发现NF-κB与病理性疼痛密切相关,多种病理性疼痛模型中均存在NF-κB的激活[18]。本研究发现A13通过抑制NF-κB信号通路来达到抗炎效果,故继续研究A13镇痛方面的作用,结果提示A13有明显的机械镇痛效果,A13机械镇痛作用与NF-κB信号通路也是相关的。
据报道姜黄素镇痛的作用机制各不相同,其可作用于各种疼痛[19,20]。不过至今尚未达成共识,故将来会在现研究结果基础上,深入研究姜黄素类似物A13的镇痛机制,找出其直接作用的靶点,以实现其在临床上安全使用。
[参考文献]
[1] Liu K,Chen H,You QS,et al. Curcumin attenuates myocardial ischemia-reperfusion injury[J]. Oncotarget,2017, 8(67):112051-112059.
[2] 王霆钧,邱扬凌,蔡嘉莉,等. 姜黄素衍生物FM0807对佐剂性类风湿性关节炎模型大鼠疗效观察[J].中国现代医生,2016, 54(11):20-22.
[3] 张卫平,王珏,冉冉. 姜黄素逆转非小细胞肺癌TKI靶向药物耐药机制的研究[J]. 中国现代医生,2017,55(25):37-41.
[4] 陈灏,詹建伟,王利民,等. 姜黄素干预耐吉非替尼肺腺癌细胞上皮间质转化的影响及相关机制的研究[J]. 中国现代医生,2016,54(32):1-4.
[5] Liang G,Zhou H,Wang Y,et al. Inhibition of LPS-induced production of inflammatory factors in the macrophages by mono-carbonyl analogues of curcumin[J].Journal of Cellular and Molecular Medicine,2009,13(9B):3370-3379.
[6] Ceyhan D,Kocman AE,Yildirim E,et al. Comparison of the effects of curcumin, tramadol and surgical treatments on neuropathic pain induced by chronic constriction injury in rat[J]. Turk Neurosurg,2018,28(2):288-295.
[7] Zhang Q,Polyakov NE,Chistyachenko YS,et al. Preparation of curcumin self-micelle solid dispersion with enhanced bioavailability and cytotoxic activity by mechan-ochemistry[J]. Drug Deliv,2018,25(1):198-209.
[8] Zheng QT,Yang ZH,Yu LY,et al. Synthesis and anti-oxidant activity of curcumin analogs[J]. J Asian Nat Prod Res,2017,19(5):489-503.
[9] 李偉锋,蒋建兰. 姜黄素药理作用的研究现状[J]. 中国临床药理学杂志,2017,10(33):957-960.
[10] Xiao L,Ding M,Fernandez A,et al. Curcumin alleviates lumbar radiculopathy by reducing neuroinflammation,oxidative stress and nociceptive factors[J]. Eur Cell Ater,2017,33:279-293.
[11] 刘佳,黄宇虹,王保和,等. 姜黄素类化合物体内代谢途径及其代谢产物的研究进展[J]. 现代药物与临床,2015,30(12):1553-1557.
[12] Jamwal R. Bioavailable curcumin formulations:A review of pharmacokinetic studies in healthy volunteers[J]. J Integr Med,2018,16:367-374.
[13] 李旭炯,刘安,陈云霞,等. 姜黄素对肝肺综合征大鼠的保护作用[J]. 中国临床药理学与治疗学,2017,22(7):738-742.
[14] 黄敏芳,刘端勇,徐荣,等. 姜黄素药理作用之回顾与解析[J]. 江西中医药,2015,46(5):60-63.
[15] Zhao C,Yang J,Wang Y,et al. Synthesis of mono-carbonyl analogues of curcumin and their effects on inhibition of cytokine release in LPS-stimulated RAW 264.7 macrophages[J]. Bioorganic&Medicinal Chemistry,2010, 18(7):2388-2393.
[16] Correll D. Chronic postoperative pain:Recent findings in understanding and management[J]. F1000Res,2017,6:1054.
[17] 胡兴国,宋立娟,张励才. 脊髓组蛋白乙酰化在大鼠持续性术后痛中的作用[J]. 中华麻醉学杂志,2018,38(1):48-51.
[18] 马龙飞,张小蓓,孟纯阳. 核因子-κB p65在神经病理性疼痛大鼠脊髓中的表达定位[J]. 解剖学研究,2019, 41(1):12-15.
[19] 高枫,尤浩军. 姜黄素对大鼠痛阈和脊髓组织TLR4表达的影响[J]. 基因组学与应用生物学,2017,36(8):3341-3345.
[20] Ryan WJ,Heckler CE,Guido JJ,et al. Oral curcumin for radiation dermatitis:A URCC NCORP study of 686 breast cancer patients[J]. Support Care Cancer,2018,26(5):1543-1552.
(收稿日期:2020-03-31)

