N2对肺癌A549细胞的体外抗肿瘤活性及其机制研究
怀自友,黄银久,吴 迪,胡少聪,范梦园,陈培培
(蚌埠医学院 1.生命科学学院;2.第一附属医院肿瘤放疗科,安徽 蚌埠 233000)
肺癌是最常见的恶性肿瘤之一,其中非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是癌症相关死亡的主要原因[1-2]。相关数据显示,NSCLC的5年生存率约为31%~42%[3]。目前NSCLC的治疗手段还是手术结合放化疗为主,传统的化疗药物大多属于非特异性药物,在杀伤肿瘤细胞的同时,对正常细胞损伤也较大,有很多毒副作用,效果也不理想,同时容易产生耐药。因此,研发出高效、安全、易获得的化疗药物是治疗NSCLC的必要手段[4]。表皮生长因子受体(epithelial growth factor receptor,EGFR)的异常表达与肿瘤的发生密切相关,研究表明,NSCLC患者中,EGFR突变率为36.5%[5]。从姜科植物中提取的多酚类物质姜黄素具有抗菌,抗肿瘤作用,因其能抑制EGFR表达而被广泛关注[6]。1,4-戊二烯-3-酮类化合物作为姜黄素的衍生物具有同样的抗菌抗癌活性,我们将同样具有抗癌活性的喹喔啉基团引入1,4-戊二烯-3-酮,合成一系列化合物,经初步筛选,N2(结构式见图1)表现出很好的抗癌活性。为了进一步研究N2对肿瘤的抑制作用,我们以A549细胞作为研究对象,利用CCK-8法检测细胞增殖,形态学观察细胞毒性,DAPI染色观察细胞核变化,罗丹明123测线粒体跨膜电位,流式细胞术检测细胞凋亡与周期等技术方法,测试N2对肿瘤细胞的抑制,并初步探讨其机制,为抗肿瘤药物开发提供研究方向。

图1 N2化学结构式
1 材料和方法
1.1 材料与试剂人非小细胞肺癌A549细胞在蚌埠医学院生命科学学院复苏;N2由贵州大学精细化工研究中心薛伟教授课题组合成;DMEM高糖培养基(Hyclone);胎牛血清(VACCA);胰酶,PBS,青-链霉素混合液,二甲基亚砜(DMSO),Triton X-100(biosharp);cck-8,DAPI,4%多聚甲醛,罗丹明123,细胞凋亡试剂盒,细胞周期试剂盒(碧云天)。
1.2 方法
1.2.1 细胞培养与药物配制 A549细胞用含1%青-链霉素混合液,10%胎牛血清的DMEM高糖培养基在37℃、5%CO2培养箱中培养,2d换一次液,3~4d传代一次。N2和吉非替尼用DMSO溶解成20mM、10mM、5mM、2mM、1mM、0.5mM、0.2mM、0.1mM的储存液,加药前用完全培养基稀释1000倍成工作液。
1.2.2 CCK-8法检测IC50 取对数生长期细胞,接种于96孔板,细胞密度在2.0×104个/mL左右。板四周每孔各加200μL的无菌水封边,确保实验中饱和湿度,最后一列为空白对照组,加相同体积的完全培养基。培养箱培养24h后,取20mM、10mM、5mM、2mM、1mM、0.5mM、0.2mM、0.1mM的N2 0.3μL加入到300μL完全培养基中,混匀备用。96孔板细胞去上清,每孔加入100μL混匀备用的带药培养基,每组3个复孔,作用浓度分别为20μM、10μM、5μM、2μM、1μM、0.5μM、0.2μM、0.1μM。DMSO 和吉非替尼分别作为阴性对照和阳性对照做相同处理,空白对照组加100μL的完全培养基,继续培养。加药后24h、48h、72h,在倒置显微镜下观察药物作用效果并拍照。72h后,每孔加入10μL的CCK-8溶液,上下左右晃动使CCK-8充分混匀。37℃继续培养3h后,用酶标仪测定OD450,计算每孔的抑制率。利用GraphPad prism分别计算N2和吉非替尼在24h、48h、72h的IC50值。
抑制率(%)=(1-(处理组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值))×100%
1.2.3 形态学观察 上述在96孔板中培养的细胞,分别在加药后的24h、48h、72h拍照,对比观察加药组与阴性对照组及阳性对照组的细胞在形态学上的差异。
1.2.4 4′,6-二脒基-2-苯基吲哚(DAPI)染色 对数生长期细胞接种于24孔细胞培养板,每孔约3.0×104个细胞,培养箱培养24h后,用培养基将N2和吉非替尼稀释1000倍至20μM、10μM、5μM、1μM,去除原培养液,加入新的带药培养基,DMSO用培养基稀释1000倍作为阴性对照组。48h后,去上清,每孔1mL PBS洗两次后加入0.3mL 4%多聚甲醛固定10min,去除多聚甲醛,PBS洗两次,每孔加入0.3mL 0.2% Triton X-100,37℃孵育10min,去除T riton X-100,PBS洗两次,每孔加入30μL DAPI,37℃染色10min,去除DAPI,PBS洗两次,每孔加入0.3mL PBS,倒置荧光显微镜拍照。
1.2.5 Annexin V-FITC/PI双染测细胞凋亡 对数生长期细胞接种于6孔板,每孔约2.0×105个细胞。培养箱培养24h,细胞完全贴壁后,培养基将N2储存液稀释1000倍至20μM、10μM、5μM、1μM,去除原培养液,加入新的带药培养基,20μM的吉非替尼作为阳性对照,DMSO作为阴性对照做相同处理。作用48h后,参照碧云天细胞凋亡试剂盒(C1063)操作步骤处理细胞,BD FACSVerse检测各组凋亡情况。
1.2.6 罗丹明123法检测线粒体跨膜电位(△Ψm) 细胞种板与药物处理同1.2.5 Annexin V-FITC/PI双染测细胞凋亡。药物作用48h后,0.25%胰酶(不含EDTA)消化细胞1~2min,离心收集细胞,用1mL PBS轻轻重悬细胞沉淀,离心收集细胞,加1mL罗丹明123工作液重悬细胞,避光孵育30min,离心收集细胞,PBS重悬后转入流式管,BD FACSVerse上机检测。
1.2.7 碘化丙啶(PI)染色检测细胞周期 细胞种板与药物处理同1.2.5 Annexin V-FITC/PI双染测细胞凋亡。药物作用48h后,参照碧云天细胞周期与细胞凋亡检测试剂盒(C1052)操作步骤处理细胞,BD FACSVerse检测各组细胞周期变化。
1.3 统计学分析利用spss statistics 17.0单因素分析,采用“均值±标准差”,以P<0.05表示数据间有显著性差异。
2 结果
2.1 cck-8检测结果通过检测各组在450nm波长下测定吸光度并利用SPSS分析均值发现随着药物浓度增大和作用时间延长,抑制率不断升高,与DMSO组相比N2 在0.2μM以上浓度的抑制率均有显著统计学差异(P<0.05)。且在20μM相同浓度下,N2对A549细胞的抑制作用要高于阳性对照吉西他滨(见表1)。 GraphPad prism计算N2和吉非替尼在24h、48h、72h的IC50值显示,N2在48h、72h的IC50为6.61μM、5.68μM,低于吉非替尼的11.93μM、7.18μM,表现出更高的抑制作用(见表2、图2)。

表1 不同浓度梯度N2、吉非替尼对A549细胞作用不同时间的体外抑制率

表2 N2和吉非替尼作用A549细胞24h、48h、72h的IC50(μM)

图2 N2和吉非替尼作用A549细胞24h、48h、72h的IC50(μM)
2.2 形态学通过观察细胞形态变化发现N2作用A549细胞后,随着药物浓度增大和作用时间延长,抑制作用明显增加。与阴性对照DMSO组相比,N2作用72h,2μM以上组细胞数目明显减少细胞形态变化不大,与阳性对照组作用相似,说明N2通过正常的生理途径抑制了细胞的增殖而非通过细胞毒性直接杀死肿瘤细胞(见图3)。
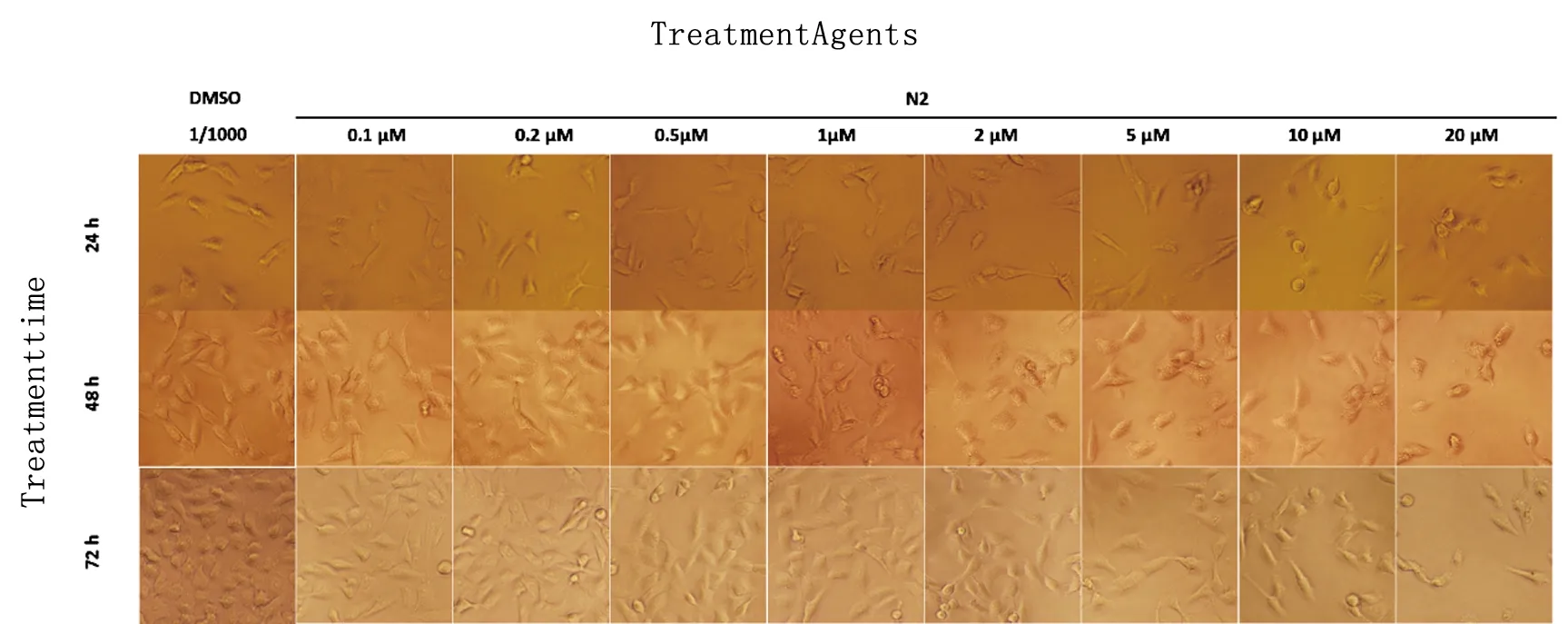

图3 N2对A549细胞形态的影响
2.3 DAPI染色观察细胞凋亡情况凋亡细胞的细胞核皱缩,染色质凝集,细胞变成数个大小不等的由胞膜包裹的凋亡小体,4,6-二脒基-2-苯基吲哚(DAPI)是一种能与DNA强力结合的荧光染料,通过DAPI染细胞核,倒置荧光显微镜观察发现,与DMSO组相比,加药组随着浓度增大,细胞数目明显减少,细胞核皱缩,变小,变亮,与吉非替尼组作用相似。提示N2 诱导了A549细胞发生凋亡(见图4)。

图4 DAPI染色细胞核变化
2.4 Annexin V-FITC/PI双染检测细胞凋亡情况早期凋亡的细胞出现磷酯酰丝氨酸外翻,通过FITC标记的Annexin V能特异的结合到外翻的磷酯酰丝氨酸上而发出绿色荧光,晚期凋亡的细胞由于细胞膜完整性丧失,碘化丙啶能够透过细胞膜与细胞核的DNA结合而发出红色荧光。通过流式细胞仪检测荧光信号发现,与DMSO组相比,随着药物浓度增加,细胞早期凋亡和晚期凋亡逐渐上升,且由早期凋亡走向晚期凋亡,N2-20μM组效果显著,早凋和晚凋比例分别为19.8%和21.8%,明显优于吉非替尼-20μM组1.11%和1.77%(图5)。

图5 细胞凋亡变化
2.5 线粒体跨膜电位(△Ψm)变化早期凋亡细胞会出现线粒体跨膜电位的降低或丧失,通过罗丹明123染色可以检测线粒体跨膜电位的变化。流式细胞仪检测发现,与DMSO组相比,加药组线粒体跨膜电位向左偏移,△Ψm下降,且随着药物浓度加大△Ψm下降程度增加,说明随着药物浓度增加细胞凋亡率升高(见图6)。

图6 线粒体跨膜电位变化
2.6 细胞周期变化碘化丙啶(PI)是一种双链DNA的荧光染料。碘化丙啶和双链DNA结合后可以产生荧光,并且荧光强度与DNA的含量成正比,处于不同期的细胞由于DNA含量不同,所以荧光强度不同。通过流式细胞仪检测荧光强度发现,DMSO组G1和S期细胞比例为18.54%、49.98%,药物处理组随着浓度增大,G1期细胞比例增加S期细胞比例降低,N2-20μM组G1和S期细胞比例分别为50.52%、26.47%,出现了明显的G1期阻止,通过抑制细胞周期从G1期走向S期,从而抑制肿瘤细胞增殖,见图7。

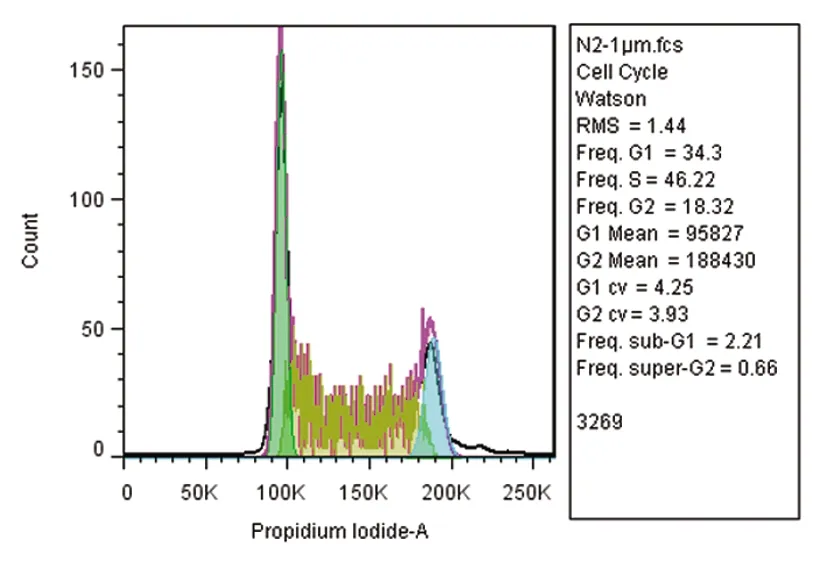



图7 细胞周期变化
3 讨论
肺癌是目前癌症相关致死的主要原因,非小细胞肺癌约占所有肺癌病例的80%[7-8]。目前治疗肺癌的化疗药物主要包括广谱抗癌药如紫杉醇、长春瑞滨,顺铂等,吉非替尼、厄洛替尼、埃克替尼是针对表皮生长因子受体酪氨酸激酶(EGFR-TK)为靶点的新一代靶点抗癌药。姜黄素作为一种新型的EGFR抑制剂,为抗肿瘤药物开发提供了方向。我们合成了姜黄素衍生物N2,并通过体外抗肿瘤实验发现,N2作用于非小细胞肺癌A549细胞,相比DMSO组,细胞增殖缓慢,细胞核皱缩变小,线粒体跨膜电位降低,凋亡率明显升高,细胞周期出现明显的G1期阻滞。猜测N2可能通过抑制G1期必须蛋白的合成从而阻断细胞周期,打破线粒体膜电位平衡,使线粒体跨膜电位降低,ATP合成受阻,进而诱导细胞凋亡。

