Diminazene对慢性脑低灌注大鼠脑内炎症反应影响及机制研究
陆俊玲,薛晓,段瑞,张颖冬
血管性认知障碍(VCI)是指所有血管因素导致的涵盖从轻度认知功能损害到痴呆,涉及至少一个认知域受损的临床综合征[1-2]。研究显示,VCI病理生理机制较为复杂,目前临床上尚缺乏有效的干预药物[3]。慢性脑低灌注(CCH)通常由高血压、糖尿病和动脉粥样硬化等慢性血管和代谢疾病引起,可引发神经炎症,导致神经退行性病变、认知功能障碍等,是VCI重要发病机制假说之一[4]。研究证实,CCH大鼠模型可模拟VCI的病理过程[5],同时炎症反应参与该过程[6]。肾素-血管紧张素系统(RAS)为体内重要的体液调节系统,主要调控血压和维持体内水电解质平衡[7]。近年研究证实,脑内存在独立的RAS,且对脑血管、认知功能有重要作用[8]。有证据表明,RAS系统旁路ACE2-Ang-(1-7)-MasR轴可延缓VCI病理学进程,降低炎症反应[9]。然而,由于Ang-(1-7)为一多肽,在体内易降解,且难以通过血-脑屏障[10],故难以实际应用于临床。三氮脒(DIZE)为常见的抗锥虫药,可有效对抗包括布鲁氏菌和链球菌在内的某些病原菌,又名贝尼尔(Berenil)或血虫清。研究证实,持续使用DIZE可预防脑动脉血栓、肺动脉高压、青光眼[11-12]。此外,研究发现DIZE为ACE2的激活剂,可激活RAS系统的ACE2-Ang-(1-7)-MasR轴导致八肽Ang Ⅱ裂解生成Ang-(1-7)[13]。本研究通过建立CCH大鼠模型[14],探讨DIZE对RAS旁路的激活作用及对慢性脑低灌注伴随的炎症反应的治疗作用,为临床治疗VCI提供新思路。
1 材料与方法
1.1 实验动物及分组 SPF级雄性SD大鼠32只,8周龄,体质量250~300 g,由南京医科大学附属南京医院实验动物中心提供[许可证号为SCXK(苏)2016-0005、SCXK(苏)2016-0006]。室温(23±2)℃、相对湿度50%~60%,12 h昼-12 h夜循环照明环境饲养,自由摄食、饮水。采用随机数字表法将大鼠分为假手术组、CCH组、CCH+低剂量DIZE组(低剂量DIZE组)及CCH+高剂量DIZE组(高剂量DIZE组),每组8只。
1.2 方法
1.2.1 动物模型制备及给药方法 采用永久结扎双侧颈总动脉法制作CCH大鼠模型。大鼠术前12 h禁食不禁水,腹腔注射10%水合氯醛(0.3 ml/100 g)进行麻醉,取仰卧位,固定四肢及头部后备皮并消毒,于颈部行正中切口,分离双侧颈总动脉和迷走神经。完成上述操作后对假手术组大鼠进行逐层缝合;CCH组、低剂量DIZE组、高剂量DIZE组的大鼠用4号手术线于远心端永久结扎双侧颈总动脉后逐层缝合。术后对所有大鼠腹腔注射青霉素(8万单位/只)预防感染,待大鼠苏醒后,放回笼具饲养。
建模1周后低剂量DIZE组[2 mg/(kg·d)]及高剂量DIZE组[10 mg/(kg·d)]腹腔注射DIZE(Sigma公司),持续8周。给药8周后每组取8只,腹腔注射10%水合氯醛(0.3 ml/100 g)对大鼠进行麻醉,使用0.9% NaCl溶液对大鼠进行心脏灌注,断头取脑,取皮质部分检测ACE2活性、炎症因子、Ang-(1-7)、Mas受体mRNA水平。
1.2.2 ACE2活性的检测 通过比色试剂盒检测ACE2活性的变化。取大鼠脑皮质部分,放入离心管中,超声匀浆,4 ℃离心机13 000 r/min离心10 min后,取上清液。使用BCA蛋白检测试剂盒在黑色的96孔板上行ACE2酶活性检测,将ACE2裂解缓冲液、样本蛋白和ACE2特异性荧光底物混匀后在酶标仪上测荧光强度。激发荧光波长330 nm,散射波长390 nm,反应温度37 ℃连续检测4 h[15]。
1.2.3 脑内炎症因子水平的检测 ELISA检测大鼠脑组织IL-1β、IL-12、IL-6、TNF-α的变化。取大鼠皮质部分,经裂解、匀浆、离心后取部分清液后于-80 ℃冰箱保存直至下一次使用。采用ELISA法参照试剂盒说明利用酶标仪检测血清IL-1β、IL-12、IL-6、TNF-α(Invitrogen公司)水平,以空位孔为对照,450 nm波长依序测各孔的吸光度(OD值)。以标准品的浓度为横坐标,测量对应的A450为纵坐标,通过曲线连接不同浓度标准品对应的坐标点绘制光滑曲线;将待测样本吸光度测量值代入标准曲线,计算得到待测样本浓度[16-18]。
1.2.4 Ang-(1-7)水平的检测 ELISA法检测大鼠脑组织Ang-(1-7)的变化。取上一步骤中保存于-80 ℃的上清液,采用ELISA法参照试剂盒说明利用酶标仪检测Ang-(1-7)(RD公司),水平以空位孔调零,450 nm波长依序各孔的吸光度(OD值)。以标准品的浓度为横坐标,测量对应的A450为纵坐标,通过曲线连接不同浓度标准品对应的坐标点绘制光滑曲线。将待测样本吸光度测量值代入标准曲线,计算得到待测样本浓度[16-18]。
1.2.5 Mas受体(MasR)mRNA水平的检测 采用PCR检测MasR的变化。取大鼠脑皮质部分,捣碎后加入1 ml Ttizol溶液,匀浆;加入氯仿0.2 ml,剧烈整荡15 s,4 ℃离心机12 000 r/min离心15 min,弃上清液,加入75%乙醇洗沉淀,晾干。取4 μl总RNA行逆转录(美国ABI公司),取2 μl逆转录产物进行qRT-PCR(美国ABI公司,SYBR Green Mix)。扩增程序步骤:90 ℃预变性30 s,95 ℃进行40循环3 s,60 ℃进行30 s延伸[13]。MasR引物序列:上游GCT TGC CGA GTT TTG CTG AA,下游TGA GGG CTC CCT TCT GAC TT;以β-actin作为内参,引物序列:上游GTG CTA TGT TGC TCT AGA CTT CG,下游ATG CCA CAG GAT TCC ATA CC。

2 结 果
2.1 DIZE对脑内ACE2-Ang-(1-7)-MasR轴的影响
2.1.1 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组ACE2活性的比较 见表1。与假手术组比较,CCH组ACE2水平明显降低(64.0%)(P<0.05)。低剂量DIZE组ACE2表达为CCH组的5.0倍(P<0.05),高剂量DIZE组为CCH组的6.7倍(P<0.05)。高剂量DIZE组ACE2水平显著高于低剂量DIZE组(P<0.05)。
2.1.2 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组Ang-(1-7)水平的比较 见表1。与假手术组比较,CCH组脑内Ang-(1-7)水平显著降低(75.5%)(P<0.05)。低剂量DIZE组Ang-(1-7)水平为CCH组的8.0倍(P<0.05),高剂量DIZE组为CCH组的11.4倍(P<0.05)。高剂量DIZE组Ang-(1-7)水平显著高于低剂量DIZE组(P<0.05)。
2.1.3 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组MasR mRNA表达的比较 见表1。与假手术组比较,CCH组MasR mRNA显著降低(49.5%)(P<0.05)。低剂量DIZE组MasR mRNA水平为CCH组的2.9倍(P<0.05),高剂量DIZE组为CCH组的4.8倍(P<0.05)。高剂量DIZE组MasR mRNA表达显著高于低剂量DIZE组(P<0.05)。
2.2 DIZE对脑内炎症因子的影响
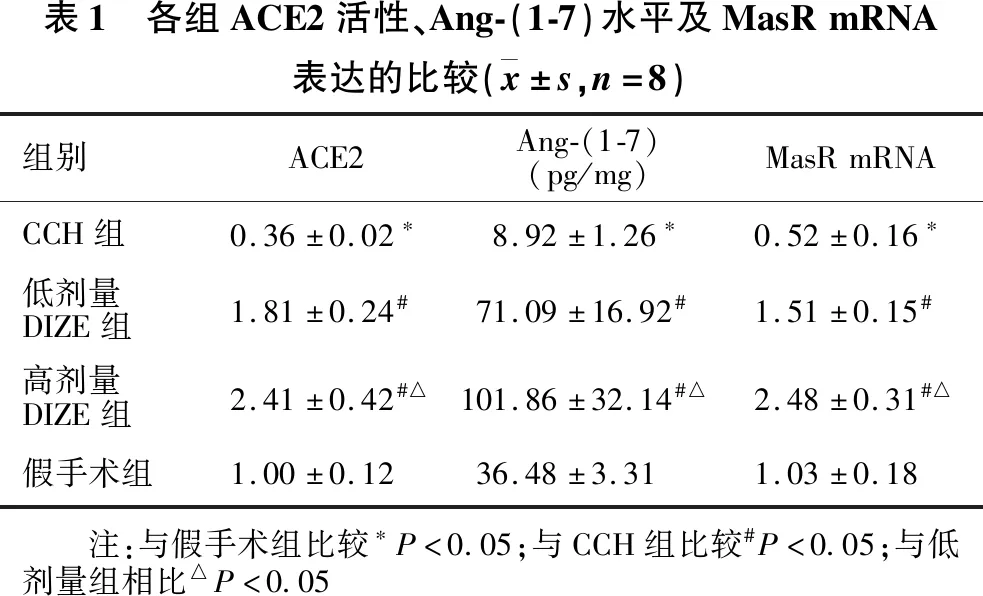
表1 各组ACE2活性、Ang-(1-7)水平及MasRmRNA表达的比较(x±s,n=8)组别ACE2Ang-(1-7)(pg/mg)MasRmRNACCH组0.36±0.02∗8.92±1.26∗0.52±0.16∗低剂量DIZE组1.81±0.24#71.09±16.92#1.51±0.15#高剂量DIZE组2.41±0.42#△101.86±32.14#△2.48±0.31#△假手术组1.00±0.1236.48±3.311.03±0.18 注:与假手术组比较∗P<0.05;与CCH组比较#P<0.05;与低剂量组相比△P<0.05
2.2.1 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组IL-1β水平的比较 见表2。与假手术组比较,CCH组IL-1β水平为假手术组5.2倍(P<0.05)。高剂量DIZE组IL-1β水平较CCH组明显降低(66.7%)(P<0.05)。高剂量DIZE组IL-1β水平显著低于低剂量DIZE组(P<0.05)。低剂量DIZE组与CCH组IL-1β水平差异无统计学意义(P>0.05)。
2.2.2 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组IL-12水平的比较 见表2。与假手术组比较,CCH 组IL-12水平为假手术组4.2倍(P<0.05)。低剂量DIZE组IL-12水平较CCH组降低(25.9%)(P<0.05),高剂量DIZE组IL-12水平较CCH组明显降低(32.8%)(P<0.05)。高剂量DIZE组与低剂量DIZE组IL-12水平差异无统计学意义(P>0.05)。
2.2.3 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组IL-6水平的比较 见表2。与假手术组比较,CCH组IL-6水平为假手术组6.4倍(P<0.05)。低剂量DIZE组IL-6水平较CCH组降低(37.2%)(P<0.05),高剂量DIZE组IL-6水平较CCH组明显降低(70.5%)(P<0.05)。高剂量DIZE组IL-12水平显著低于低剂量DIZE组(P<0.05)。
2.2.4 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组TNF-α水平的比较 见表2。与假手术组比较,CCH组TNF-α水平为假手术组2.8倍(P<0.05)。低剂量DIZE组TNF-α水平较CCH组明显降低(31.1%)(P<0.05),高剂量DIZE组TNF-α水平较CCH组明显降低(61.4%)(P<0.05)。高剂量DIZE组TNF-α水平显著低于低剂量DIZE组(P<0.05)。
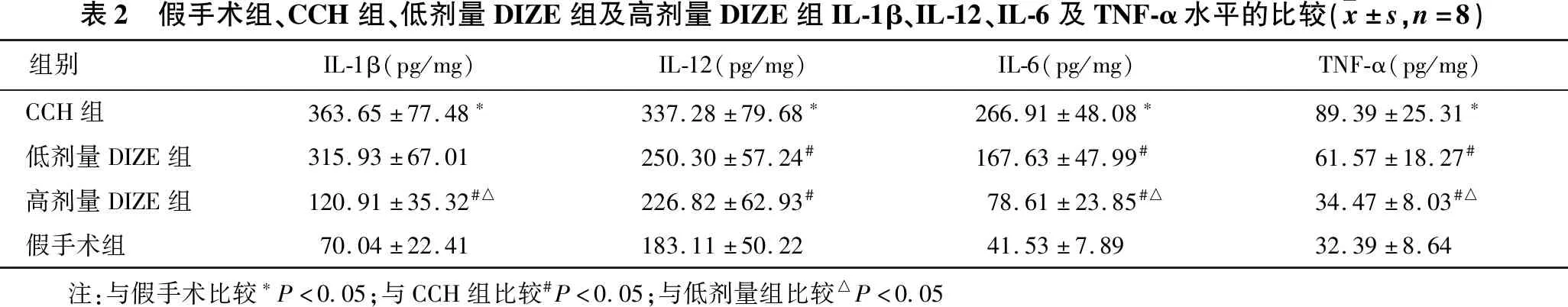
表2 假手术组、CCH组、低剂量DIZE组及高剂量DIZE组IL-1β、IL-12、IL-6及TNF-α水平的比较(x±s,n=8)组别IL-1β(pg/mg)IL-12(pg/mg)IL-6(pg/mg)TNF-α(pg/mg)CCH组363.65±77.48∗337.28±79.68∗266.91±48.08∗89.39±25.31∗低剂量DIZE组315.93±67.01250.30±57.24#167.63±47.99#61.57±18.27#高剂量DIZE组120.91±35.32#△226.82±62.93#78.61±23.85#△34.47±8.03#△假手术组70.04±22.41183.11±50.2241.53±7.8932.39±8.64 注:与假手术比较∗P<0.05;与CCH组比较#P<0.05;与低剂量组比较△P<0.05
3 讨 论
我国人口老龄化程度日益加重,脑血管病和痴呆患病率呈上升趋势,因此防治VCI具有重要临床意义。研究显示,VCI病理生理机制较为复杂,目前尚无有效干预药物[3]。本课题组通过建立CCH大鼠模型发现,大鼠的大脑中ACE2和Ang-(1-7)水平明显降低,炎症因子显著增多。Xie等[19]研究发现,CCH中炎症因子增多可能与ACE2-Ang-(1-7)-MasR轴失调导致的抑制炎症能力下降有关。故本课题组推测通过激活ACE2,调控其下游,增强MasR mRNA表达,可以增强该轴抗炎能力。
DIZE被认为是ACE2内源性激动剂,可通过舒张血管、抗炎和激活ACE2等途径保护心脏、神经系统及缓解疼痛等[20-22]。近年来,越来越多的研究证实DIZE也有脑部保护功能[23-24]。Regenhardt等[23]发现,持续7 d向脑梗死模型大鼠脑室内注入DIZE(5 mg/h),可降低大鼠血压及大脑梗死面积,同时MasR拮抗剂A779可阻断该脑保护作用。Bennion等[24]通过研究证实,腹腔注射DIZE可减少脑梗死大鼠模型的梗死体积并改善神经功能缺损,这种作用也可被A779减弱。本研究通过对大鼠腹腔注射高低两种剂量的DIZE发现,与假手术组相比,CCH组脑组织内炎症因子IL-1β、IL-12、IL-6、TNF-α明显升高;ACE2、MasR mRNA、Ang-(1-7)明显降低,证实了慢性脑低灌注发生后可抑制ACE2-Ang-(1-7)-MasR轴,且导致炎症反应加剧。与CCH组相比,注射低剂量DIZE及高剂量DIZE能够使脑内ACE2、MasR mRNA、Ang-(1-7)升高,炎症因子IL-6、IL-12、TNF-α降低,且除IL-12外均呈剂量依赖性;仅高剂量DIZE能够使炎症因子IL-1β降低。因此猜测DIZE通过激动ACE2活性,促进AngⅡ转变为Ang-(1-7),从而激活MasR介导的抑炎信号通路[25]。与国内外研究比较,本研究首次发现DIZE能够抑制慢性脑低灌注大鼠脑内炎症反应,但尚存在部分不足,如未在实验前后进行水迷宫实验评估大鼠认知功能变化,未检测MDA反应大鼠脑部脂质氧化程度等。在后续实验中,本研究将通过检测大鼠认知功能、建立细胞凋亡模型等,完善结论。
综上所述,DIZE作为ACE2激动剂能够激活ACE2-Ang-(1-7)-MasR轴抑制CCH模型大鼠脑内的炎症反应。该结论为临床中完善VCI患者治疗方式提供了新的思路。

