Alzheimer’s病患者血清miR-182表达水平的变化及临床意义
孟洁,徐宇浩,何悦,钱胜男,于明
Alzheimer’s病(AD)是一种中老年人常见的慢性获得性智能障碍综合征。随着人口老龄化,AD发病率逐年递增[1]。然而针对AD的诊断策略研究进展甚缓,仍缺乏快捷且行之有效的辅助诊断指标。近年来,miRNA在AD中的作用受到广泛关注,其在辅助诊断和预后评估领域均取得一定成果,为寻找新型AD血清学诊断指标奠定了良好的临床基础[2-4]。miR-182是位于人7号染色体(7q32.2)的神经系统特定的miRNA,参与细胞的分化和增殖等过程,在多个神经系统疾病中发挥功效,尤其在海马区含量丰富[5-7]。最新研究证实,miR-182与海马神经元细胞凋亡密切相关[8]。在海马结构和功能变化与AD发生发展的相关性被广泛印证的基础上,miR-182与AD的关系亦引发了高度关注,但其在AD患者外周血中的表达尚不明确。本文首次以AD患者外周血清miR-182水平为观察指标,初步探讨了其对AD的临床诊断价值和可能的作用途径,以期为AD的临床诊断提供良好的实验室指标。
1 对象与方法
1.1 对象 (1)AD组:选取2017年10月到2019年7月江苏大学附属医院神经内科门诊就诊和住院的AD患者40例,均为初诊,未进行过AD药物治疗。纳入标准:①符合美国国立神经病及相关疾病学会(NINCDS/ADRDA)制定的“很可能的AD痴呆”诊断标准[9];②MMSE 0~25分;③头颅CT可见脑萎缩、脑室扩大,MRI提示双侧颞叶、海马萎缩。排除标准:①与认知功能障碍发生、发展密切相关的脑血管病或广泛的白质病变;②其他类型的痴呆,如路易体痴呆、额颞叶痴呆等;③帕金森病、亨廷顿舞蹈病、脑积水、长期服用抗癫痫药物、脑囊虫等引起的认知功能障碍;④过敏体质和/或过敏性疾病;⑤进行性原发性失语者;⑥神志不清,不能配合者;⑦其他原发严重疾病及心、肝、肾、造血系统严重疾病患者;⑧有其他不适宜入选的情况。男性22例,女性18例;平均年龄(70.12±9.75)岁。平均受教育(9.45±4.06)年。(2)健康对照组:系同期40名健康志愿者。纳入标准:①年龄与AD组匹配;②精神、认知功能正常,日常生活自理;③神经系统检测未见异常。排除标准:①直系亲属中有AD患者;②头颅CT/MRI有异常表现者;③肝肾功能、甲状腺功能异常者;④梅毒、HIV、肿瘤标志物阳性者;⑤有其他严重基础疾病者。男性20例,女性20例;平均年龄(67.77±4.92)岁。平均受教育(8.95±2.56)年。两组受试者性别、年龄、受教育年限经统计学比较差异无统计学意义。本研究经江苏大学附属医院伦理学委员会审查批准,所有受试者签署自愿参与知情同意书。
1.2 方法
1.2.1 治疗方法 AD组患者入组后统一由同一个医师指导用药,均给予盐酸美金刚治疗,具体治疗方案:初始剂量为5 mg,每日早晨口服,第2周每日10 mg(每次5 mg,每日2次),第3周每日15 mg(早晨10 mg,晚上5 mg),第4周开始每日20 mg(每次10 mg,每日2次)。4周为1个疗程,连续治疗4个疗程。
1.2.2 血清miR-182的提取和表达水平的测定 AD组于治疗前及治疗4个月后,健康对照组患者于入组后采用促凝管静脉穿刺法采集空腹5 ml静脉血。血样室温环境静置30 min左右,4 ℃冷藏2 h,3 000g离心10 min。将血清转移到新的试管中,4 ℃ 12 000g离心10 min,上清液转移到新的EP试管中,-80 ℃保存备用。使用TRIzol法提取血清总RNA,紫外分光光度计测定RNA的浓度及纯度。按照HiFiScript gDNA Removal cDNA Synthesis Kit试剂盒反转录成相应的cDNA,以U6为内参,按照UltraSYBR Mixture PCR反应体系根据miR-182上游引物(5′-GCG CGT GGT TCT AGA CTT GC-3′)和下游引物(5′-ATC CAG TGC AGG GTC CGA GG-3′)进行扩增。PCR反应条件:95 ℃ 10 min,然后95 ℃ 10 s→58 ℃ 30 s→72 ℃ 32 s进行40个循环,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s。采用2-ΔΔCT法分析miR-182表达数值相对水平情况。
1.2.3 量表评价 AD组于治疗前及治疗4个月后,由经过正规培训、操作熟练的神经科医师对其进行MMSE和蒙特利尔认知评估量表(MoCA)评分,总分均为30分,详细记录各分项分值。评分越低,认知功能越差。
1.2.4 血清脑源性神经营养因子(BDNF)水平的测定 AD组于治疗前采用促凝管静脉穿刺法采集空腹5 ml静脉血,采用ELISA法测定血清BDNF含量。严格按照ELISA试剂盒说明书要求操作。
1.2.5 统计学方法 采用SPSS 25.0及Prism 6.0进行数据处理。计数资料采用率表示,采用χ2检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示。组间比较采用Mann-WhineyU检验,治疗前后比较采用Wilcoxon符号秩检验。血清miR-182表达水平与MMSE、MoCA和BDNF评分的相关性分析采用Pearson相关分析。ROC曲线用于评估miR-182诊断价值的特异性和灵敏度。双侧检验,P<0.05时为差异具有统计学意义。
2 结 果
2.1 健康对照组和AD组治疗前血清miR-182表达水平的比较 见图1。AD组患者治疗前血清miR-182的表达水平为1.903(1.381,2.660),健康对照组为0.149(0.075,0.27)。两组血清miR-182的表达水平差异具有统计学意义(z=-7.612,P<0.01)。

图1 AD组和健康对照组血清miR-182表达水平的比较
2.2 AD组治疗前后血清miR-182表达水平的比较 见图2。美金刚治疗4个月后,AD组患者血清miR-182表达水平为1.125(0.612,1.528),较治疗前显著降低(z=-4.302,P<0.05)。
2.3 治疗前后AD组MMSE和MoCA评分的比较 见图3、图4。AD组治疗后MMSE评分[15(11,18)分]及MoCA评分[13(10,17)分]显著高于治疗前[11(8,15)分,11(8,14)分](z=-2.382,z=-2.401;均P<0.05)。
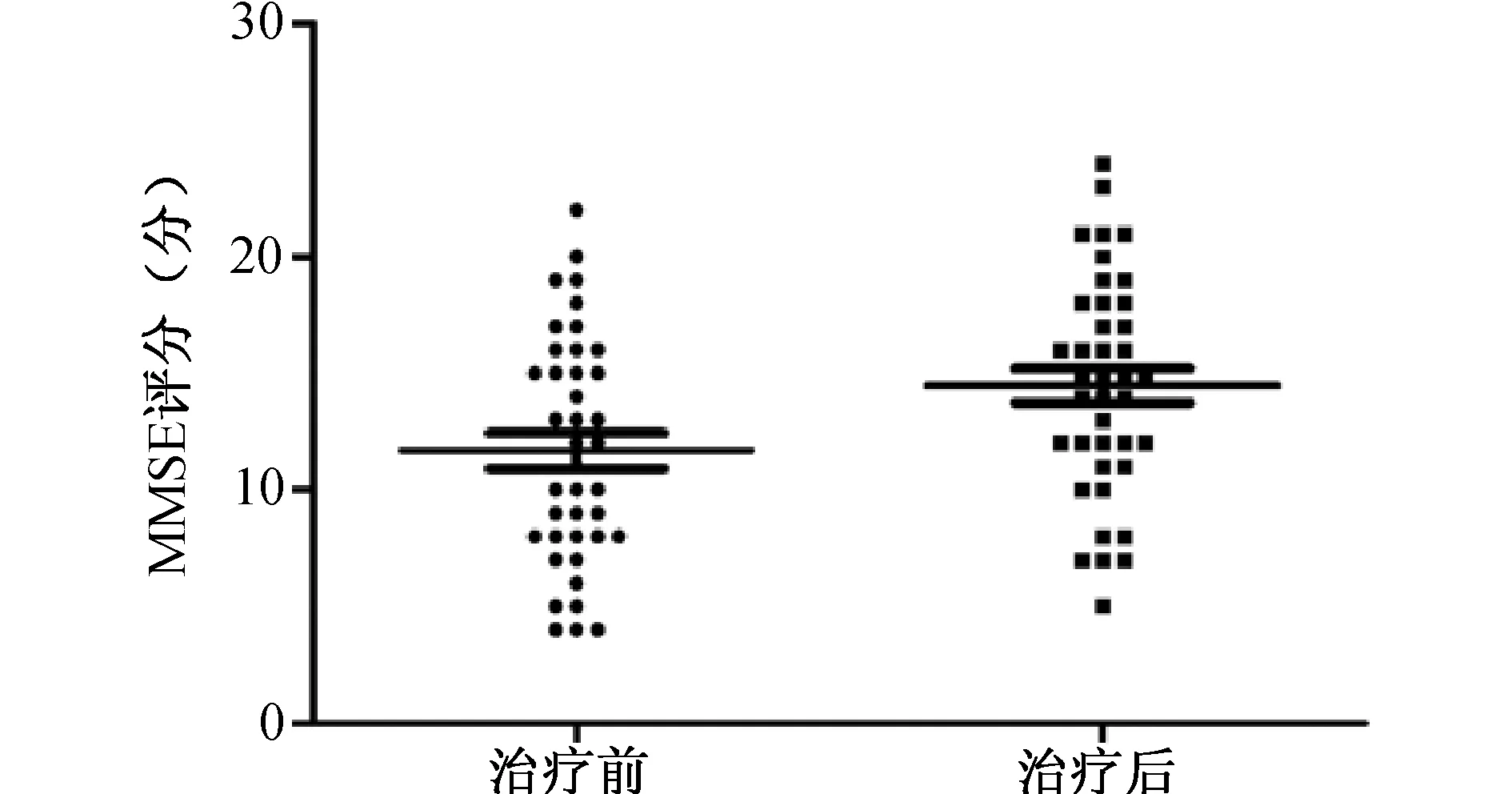
图3 美金刚治疗前后AD组MMSE评分的比较
2.4 血清miR-182表达水平与MMSE和MoCA评分的相关性分析 见图5、图6。AD组血清miR-182表达水平和MMSE评分散点图显示,随着MMSE和MoCA评分分值的升高,血清miR-182表达水平呈现下降趋势。相关性分析结果显示,血清miR-182表达水平与MMSE和MoCA量表评分呈负相关(r=-0.546,r=-0.581;均P<0.01)。
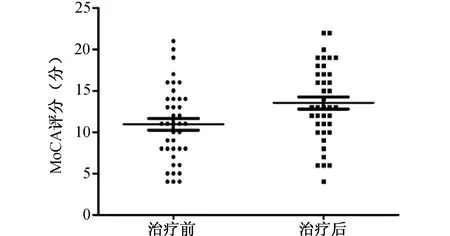
图4 美金刚治疗前后AD组MoCA评分的比较

图5 血清miR-182表达水平与MMSE评分相关性分析

图6 血清miR-182表达水平与MoCA评分相关性分析
2.5 血清miR-182对AD诊断价值的ROC分析 见图7。根据上述结果,采用ROC曲线评估血清miR-182表达水平在AD诊断中的应用效能。结果显示,血清miR-182曲线下面积分别为0.904(95%CI:0.846~0.963,P<0.01),灵敏度为89.1%,特异度为80.0%。

图7 血清miR-182对AD诊断价值的ROC分析
2.6 血清miR-182表达水平与BDNF的相关性分析 见图8。AD组患者血清BDNF的表达水平为14.510(7.60,17.68)相关性分析结果显示,初诊AD患者血清miR-182表达水平与BDNF量呈现负相关(r=-0.762,P<0.01)。

图8 血清miR-182表达水平与BDNF水平相关性分析
3 讨 论
AD是一种缓慢进行性皮质高级功能全面障碍的状态,其高患病率和高致残率给社会和家庭带来了巨大的经济和护理负担[1]。目前,AD确诊仍依赖于尸检或活检等组织病理学分析,因此提高AD的诊断效率并对其进行早期干预需要进一步寻求具有高度特异性和敏感性的生物学标志物。大量研究证实,miRNA在神经系统的分化与发育、突触可塑性的形成、学习记忆能力的维持等方面发挥着重要作用,且在AD的病变过程中存在着特异性变化[10-11]。miRNA不仅存在于体内各组织中,亦可在血清、CSF等体液中被检测到,并在细胞内外环境中均表现出了高度稳定性[12-13]。目前已证实,miR-182在神经系统疾病中发挥着重要作用,并在癫痫、脑梗死患者体内呈差异性表达[14-15]。董晗[14]研究发现,下调大鼠海马神经元细胞miR-182表达可以显著抑制细胞凋亡。尽管目前miR-182与AD的关系研究甚少,但其作为生物学标志物在AD诊断中的潜在临床应用价值值得进一步研究。
本研究结果显示,首诊AD患者血清miR-182表达较健康对照组明显升高,差异有统计学意义(P<0.01),提示miR-182与AD的发生发展密切相关。随后对AD患者的随访结果显示,美金刚治疗4个月后血清miR-182水平随着AD患者MMSE和MoCA量表评分升高呈现下降趋势。盐酸美金刚可通过与N-甲基-D-天门冬氨酸(NMDA)受体非竞争性结合,抑制高氨基酸引起的神经损伤,从而改善患者的记忆认知功能[16]。杜明洋等[17]通过观察快速衰老小鼠海马BDNF表达变化发现,美金刚能够增加海马BDNF的表达,从而改善小鼠的学习记忆能力。BDNF有神经元保护作用,可以抑制细胞凋亡[18]。大量研究证实,AD患者早期海马内BDNF mRNA表达较正常人明显减少,且AD患者血液和CSF中BDNF水平与疾病的严重程度呈负相关[19-20],由此目前学者们普遍认为BDNF与AD发病密切相关。本研究进一步探讨了miR-182与BDNF的关系发现,miR-182与BDNF存在高度负相关。同时,Li等[8]研究发现,miR-182可通过下调BDNF的表达促进海马区神经细胞凋亡。因此,笔者推测BDNF或可在AD中作为miR-182靶基因参与海马细胞凋亡,这需今后在动物、细胞学实验中进一步证实。
此外,本研究通过相关性分析发现,血清miR-182水平与MMSE、MoCA评分呈负相关,且相关系数r分别为-0.546、-0.581。考虑到患者出现明显脑功能障碍前体内可能已发生了病理学改变,同时本研究纳入的样本量相对较少,因此两者相关性呈中等水平。但miR-182的异常表达及表达水平对评估AD患者认知功能损伤程度仍具有重要的提示作用,亦可作为AD患者治疗效果评估的参考指标。
本研究在此基础上进一步探讨了miR-182在AD中的诊断价值,并据此构建了AD诊断的ROC曲线。曲线下面积为0.904,显示其具有良好的应用价值,且灵敏性(89.1%)和特异性高(80.0%),可作为AD诊断的良好血清学指标。
综上所述,通过测定AD患者血清中miR-182水平能够为AD患者提供新的诊断依据,还可作为AD患者认知功能障碍严重程度和治疗效果评估的参考指标。但本研究存在一定的局限性,今后将扩大样本量,分析不同阶段的AD患者体内miR-182水平变化,或从细胞和动物层面深入探讨miR-182在神经退行性疾病中调控作用背后的分子机制,以进一步验证miR-182作为AD生物学标志物的价值,并为更好地临床管理AD提供新的诊断策略和病情评估参考指标。

