[4-(2-氯-4a,10a-二氢吩噻嗪-10-基)-丁基]-三苯基-磷鎓抑制骨肉瘤细胞的机制研究*
李文静,王 睿,方雯珺,张书文,吴 喆,孙燕玲,阮 英,高 涛,宁志丰**,刘复兴**
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院临床医学院;3.湖北科技学院基础医学院;4.湖北科技学院核化生学院)
据报道10-20岁患者约占骨肉瘤病人的60%,并且骨肉瘤是该年龄段青少年死亡的第二大主导原因[1]。骨肉瘤不仅复发率高,而且具有较高的侵袭和全身转移性,近10年诊断的骨肉瘤患者中约有10%~20%发生远处转移,其中90%死亡原因是肺转移。骨肉瘤较高的转移和复发通常会导致预后不良,五年总生存率仅为20%~30%[2-3],这促使研究人员寻找新的疗法。
二十世纪初人们发现用于治疗精神病的吩噻嗪类药物有良好的抗肿瘤作用[4]。随后进一步的研究发现其抗肿瘤机制主要为通过抑制DNA依赖性蛋白激酶来诱导细胞凋亡、抑制血管生成,还可通过抑制外排泵来增加肿瘤细胞对其他化疗药物的敏感性[5]。近年来发现其中的三氟拉嗪和甲硫哒嗪还可以抑制癌干细胞[6-7]。但由于这类药物对肿瘤的选择性不高所以还不能单独用于临床治疗肿瘤。三苯基膦(TPP)是一种可穿过线粒体膜的亲脂性阳离子,因化学结构中含有3个苯基,使得该分子具有很强的脂溶性;同时,结构中磷原子上的正电荷可以离域到3个苯环上,形成离域正电荷,促使TPP 穿过脂质双分子层[8]。本实验通过使用TPP来修饰2-氯吩噻嗪以期可以增加其对骨肉瘤的毒性。
1 材料与方法
1.1 实验材料
2-氯吩噻嗪和氯丙嗪购自湖北鸿鑫瑞宇精细化工有限公司。三苯基膦(TPP)、1,4-二溴丁烷、碘甲烷和二氯亚砜购自Macklin公司。人骨肉瘤细胞U2OS购自美国典型培养物典藏中心(ATCC),胎牛血清和MTT购自Gibco公司。所有抗体均购自ABclonal公司。Dulbecco的改良Eagle's培养基(DMEM)和RPMI培养基购自HyClone公司。其它试剂均为市售分析纯。
1.2 实验方法
1.2.1 化合物合成
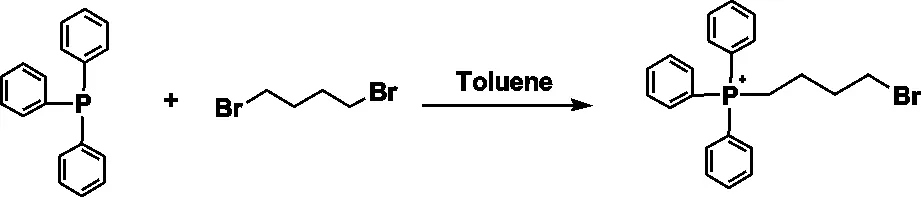
步骤一:取1,4-二溴丁烷溶于甲苯并置于100℃油浴中,待温度升至100℃后向其中缓慢滴加溶于无水甲苯的三苯基膦溶液,边加边搅拌,待滴加完毕反应24h终止反应,过滤并用甲苯洗两次,干燥得白色固体;其中,三苯基膦与1,4-二溴丁烷的物质的量比值为1∶1,1,4-二溴丁烷和三苯基膦在甲苯中的初始浓度均为0.1~0.2mM,反应式如下:
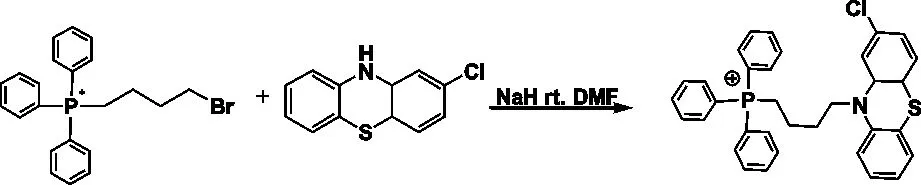
步骤二:以物质的量比值为1∶1分别称取步骤一所得白色固体和2-氯吩噻嗪于无水的DMF中,并加入氢化钠密闭遮光,在氮气保护下室温搅拌反应24h,反应终止后旋转蒸发仪除去溶剂,过硅胶柱纯化,即得吩噻嗪类衍生物[4-(2-氯-4a,10a-二氢吩噻嗪-10-基)-丁基]-三苯基-磷鎓即化合物a;其中,氢化钠的摩尔量是2-氯吩噻嗪的5倍,2-氯吩噻嗪在无水DMF中的初始浓度为0.1~0.2mM,反应式如下:
1.2.2 细胞培养
我们使用添加有10% FBS、100U/ml 青霉素和100μg/mL链霉素的DMEM高糖培养基在含有5%CO2的37℃恒温恒湿细胞培养箱中培养骨肉瘤U2OS细胞,待细胞密度达85%左右时予以传代。
1.2.3 MTT检测细胞活力
用MTT法测定细胞活力。将对数生长期的U2OS细胞(7~10×103细胞/孔)接种在96孔板中过夜,然后基于预实验设计给药浓度包含IC50前后至少两个点(5-氟尿嘧啶浓度(阳性对照)0、2.5、5、7.5、10、12.5μM;化合物a:0、2.5、5、7.5、10、12.5μM。给药后阳性对照组给药24h,化合物a给药12、24、36h。向每个孔中加入MTT(0.5mg/mL)。在细胞培养箱中孵育4h后,除去上清液,向各孔中加入150μL DMSO作为溶剂。使用Multiskan Ascent微孔板光度计(EnSpire 2300 Multilabel Reader;PerkinElmer,Inc.,Waltham,MA,USA)在490nm处测量吸光度。不给药组(对照组)被认为具有100%的活力(由于平板克隆实验为7d参照MTT实验结果调小给药浓度为:0,0.5,1,2μM,其它实验参照MTT实验选用给药浓度为0,2.5,5μM给药时间为24h)。
1.2.4 平板克隆形成实验
将对数生长期U2OS细胞(1000个细胞/孔)接种到六孔板中过夜,然后与不同浓度的化合物a一起孵育(由于平板克隆实验为7d参照MTT实验结果调小给药浓度为:0,0.5,1,2μM)。在细胞培养箱中培养7~10d。最后将6孔板中的细胞浸入PBS中洗涤2次,在室温下在甲醇中固定15min,并用吉姆萨染液染色15min。在显微镜下计数含有超过50个细胞的克隆数。然后根据下式计算克隆形成率:克隆形成率(%)=阳性克隆数/接种细胞数×100%。
1.2.5 Transwell迁移侵袭实验
取处于对数生长期的U2OS细胞,将其密度调节至2.5×106/mL。后将0.5~1×105个细胞接种到不含血清的200μL DMEM高糖培养的Transwell上室中。将含有20%血清的500μL DMEM高糖培养物加入Transwell下室中。设定下室化合物a的浓度为0、2.5和5μM在细胞培养箱中培养24h后,擦洗上室的内表面,后将其在预冷的甲醇中固定20min,接着用0.1%结晶紫染色15min。最后计数迁移至小室下表面的细胞。侵袭试验则要在Transwell小室内表面涂布3.9μg/mL基质胶(BD),其他步骤与迁移试验相同。培养24h后,计数侵入小室下表面的细胞。
1.2.6 凋亡和自噬实验
取处于对数生长期的U2OS细胞,将其密度调节至1~1.5×105/mL后将100μL细胞悬液接种到96孔板中过夜后给药,给药浓度为0、2.5和5μM。24h后使用自坏死和凋亡检验试剂盒和噬试剂盒测量凋亡和自噬,并用荧光显微镜观察结果。
1.3 统计学方法
使用SPSS 16.0软件(SPSS,Inc.,Chicago,IL,USA)进行统计学分析,并使用GraphPad Prism 6.0软件(GraphPad Software,Inc.,La Jolla,CA,USA)做图。结果表示为(平均值±标准差),所有实验重复3次。使用单因素方差分析进行数据分析,并使用最小显著差异事后检验来确定统计学意义。P<0.05表示差异具有统计学意义。
2 结 果
2.1 化合物a的表征
化合物a纯度≥98%其结构表征如下:
1H NMR (400 MHz,CDCl3) :δ 7.71-7.66 (m,5H),7.54-7.42 (m,8H),7.44-7.11 (ddd,J=8.4,5.2,2.2 Hz,3H),7.19-7.00 (m,1H),6.96-6.78 (d,5H),3.82 (t,J = 6.6 Hz,2H),2.28 (m,2H),1.93 (dd,2H),1.77 (dt,2H)(图1,封二)。13C NMR (101 MHz,CDCl3): δ 146.43,144.38,133.32,133.24,132.34,131.74,131.71,130.79,130.70,128.73,128.61,127.99,127.60,127.49,125.11,123.88,123.03,122.38,115.89,115.86,46.77,29.63,28.91,27.79,27.66,19.24,19.20(图2,封二)。
2.2 MTT实验结果
MTT实验结果可知化合物a的IC50为(6.04±0.83)μM;5-氟尿嘧啶在12.5 μM对细胞的抑制率只有0.11%。由此可知化合物a对骨肉瘤的抑制效果远远优于5-氟尿嘧啶。而且随着化合物a的给药浓度增加抑制作用也随之增加;同一给药浓度随着给药时间增加抑制作用也增加。由此可见化合物a可以浓度和时间依赖的抑制骨肉瘤细胞的增殖(图3)。
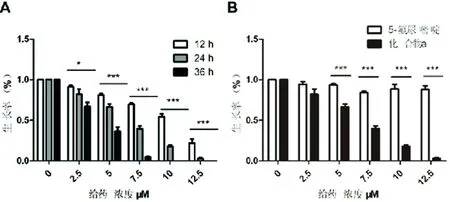
A.随着时间的延长为化合物a对肿瘤细胞的作用增加;B.化合物a对比阳性对照5-氟尿嘧啶给药24 h对肿瘤细胞的抑制作用。*P<0.05,**P<0.01 and ***P<0.001
2.3 平板克隆形成实验结果和Transwell迁移和侵袭结果
化合物a接下来的平板克隆形成实验和Transwell迁移侵袭实验结果显示化合物a可以剂量依赖性抑制骨肉瘤细胞U2OS平板克隆形成实验(图4,封二)、Transwell小室迁移和侵袭实验(图5,封二)。
2.4 凋亡和自噬实验
凋亡与自噬实验结果(图6,封二)表明化合物a可以通过诱导凋亡而不是自噬促使骨肉瘤U2OS细胞死亡。
3 讨 论
抗肿瘤药物的发现和开发过程极具挑战性。造成抗肿瘤药物研发困难的原因有很多,其中之一是因为对肿瘤发病机制的了解还不够全面,从而缺乏只针对肿瘤细胞靶向药物。目前发现的常见肿瘤表型异常包括形态变化、基因表达改变、代谢改变而最常见的代谢改变就是线粒体中糖代谢的改变[9],线粒体是细胞能量工厂参与细胞代谢及能量产生,以及维持钙和氧化还原的体内平衡[10-12]。正常细胞通过氧化磷酸化从葡萄糖中产生大部分ATP。线粒体通过消耗线粒体内膜上产生的质子而把电子泵送到呼吸链进一步产生ATP。另一方面,癌细胞通过糖酵解产生大部分ATP,并且其氧化磷酸化减少,导致线粒体内膜的消耗较少,其内外膜的质子梯度升高。质子梯度的积累可能是各种癌细胞中观察到的线粒体膜电位升高(ΔΨm)原因之一[9,13]。
正常细胞和恶性细胞之间可检测到的ΔΨm的差异至少为60mV。亲脂性离域阳离子基团(DLCs)是由负离子电位驱动的可在线粒体中累积的化合物家族。一些具有较高的ΔΨm恶性细胞对DLC敏感,DLC可选择性地积聚在其线粒体中[14-15]。该类分子具有疏水结构和离域正电荷基团,这些分子特征使DLC更容易跨越脂质膜。而线粒体中负的跨膜电势使这些DLC更容易在线粒体中积累。然而,尽管在体外DLC能有效地预防线粒体损伤,但DLC具有的主要缺点就是电荷累积到基质中会导致线粒体膜去极化引起细胞毒性[16]。DLC家族的成员结构多样化,而不同的结构又使这些亲脂性离域阳离子基团具有不同的线粒体靶向能力。三苯基膦(TPP)是DLC家族的成员,属于无毒化学部分,其功能在于活细胞中的线粒体靶向信号(MTS)。所以在这项研究中,我们选择TPP作为化学线粒体靶向信号之一,由于本实验对氯丙嗪的抗肿瘤作用亦有涉及,基于氯丙嗪的结构,我们选择TPP作为氯丙嗪改造的线粒体靶向信号。
近年来有报道抗精神病药物吩噻嗪类具有抗肿瘤作用,但由于其具有广泛的药理学作用导致其靶向性不强并由此引发一系列与治疗作用无关的副作用。而未能用于临床来治疗肿瘤。为了增加药物的靶向性本研究用二氯吩噻嗪与线粒体靶向基团相接,最后用细胞实验验证了改造后的药物具有良好的抗肿瘤活性。通常,吩噻嗪的衍生物的骨架特征是具有硫氮杂蒽母核的三环与10位的氮连接的烷基侧链构成的一类化合物。最先发现的吩噻嗪类化合物是亚甲基蓝,随后有人通过加热二苯胺和硫合成吩噻嗪骨架。目前其骨架合成方法又进行了进一步改进。以氯丙嗪为先导化合物,对吩噻嗪类药物进行结构改造。结构改造的部位多数集中在三环上的取代基、10位N上的取代基及三环的生物电子等排体等三方面,并在结构改造中总结出吩噻嗪类药物的构效关系。①苯环上取代基的影响—吩噻嗪苯环上取代基的位置和性质与抗精神病的活性和强度都有密切关系。1、3和4位有取代基时活性均会降低,只有2位引入吸电子基团才可增强活性。当2位的氯被吸电子作用更强的三氟甲基取代时,抗精神病活性增强。苯环2位被硫取代,可以降低锥体外系副作用。②吩噻嗪10位氮原子的取代基对活性的影响—侧链末端的取代基为含氮的碱性基团,对取代基进行结构改造,对活性的影响很大。碱性基团常为叔胺,可为脂肪叔胺基,如二甲氨基,也可为氮杂环,常用哌啶基和哌嗪基,以哌嗪取代的侧链作用最强。③吩噻嗪10位氮原子到侧链氮原子的距离对活性的影响—当10位氮原子与侧链碱性氨基之间相隔3个直链碳原子时作用最强,碳链的延长或缩短,或出现分支,都将导致抗精神病作用的减弱或消失[17]。
本文只证明吩噻嗪与线粒体靶向阳离子改造产物有抗肿瘤效果,并且其抗肿瘤效果与阳离子基团有关。但实验条件有限未能证明改造后的药物能靶向线粒体也未做动物实验,但通过许多基础实验如MTT实验、平板克隆形成实验、Transwell迁移和侵袭实验证明化合物a确实有较好的抑制骨肉瘤作用,通过进一步的凋亡和自噬实验发现化合物a是通过诱导凋亡而不是自噬来发挥其药效。由于吩噻嗪具有广泛的生物活性,在癌症研究中也具有重要作用。其可以通过几种机制发挥抗肿瘤活性,其中最重要的是诱导细胞凋亡的过程,如抑制DNA修复机制和信号转导途径[18],但它们的直接DNA损伤和膜不稳定作用也很突出[19]。并且吩噻嗪可以抑制肿瘤的多药耐药性增加肿瘤对化疗药物的敏感性[20],也有相关实验证明吩噻嗪具有抗肿瘤的血管生成[21]。但由于吩噻嗪有广泛药理作用,因此,其副作用也随之增多,所以为了增加其对肿瘤的靶向性减少对正常细胞的毒性,对吩噻嗪结构修饰和改造具有可行性。

