2-溴棕榈酸鞘内给药对乳腺癌骨转移大鼠疼痛的作用及机制*
王煜嘉,张 凤,王柏军,谢 敏
(湖北科技学院药学院,咸宁 湖北 437100)
骨癌痛(bone cancer pain,BCP)是肿瘤发生骨转移时最常见症状之一,是一种包括炎症性疼痛、神经病理性疼痛及肿瘤特异性机制的特殊病理性疼痛[1]。BCP的主要临床表现为持续进行性背景痛、爆发痛及痛觉过敏[2]。研究发现[3-4],线粒体分裂异常是骨癌痛发生和维持的重要因素,线粒体分裂-融合动态平衡的维持在线粒体功能调节中发挥重要作用,并且参与突触可塑性调控、神经递质释放、介导神经元之间信息传递以及胶质细胞激活和炎性介质释放。线粒体分裂由动力相关蛋白1(dynamin-related protein 1,Drp1)介导。正常生理状态下,Drp1大量分散在细胞溶质中,只有小部分集中于线粒体;病理状态下,Drp1转移至线粒体膜偶联GTP水解促进线粒体膜收缩启动分裂[5]。Drp1表达及磷酸化(p-Drp1)上调导致线粒体分裂异常进而引起线粒体片段化及功能不全,从而对细胞功能和活性造成负面影响[6]。2-溴棕榈酸(2-BP)是一种不可逆的蛋白棕榈酰化抑制剂,它能阻断棕榈酸盐与蛋白质的结合,影响蛋白质在膜结构上的定位从而影响其功能[7]。本研究探讨了2-BP鞘内给药对乳腺癌骨转移大鼠疼痛的作用,并探讨其可能的机制,从而为镇痛药物的开发提供理论依据。
1 材料与方法
1.1 实验动物与细胞
本实验中使用的Sprague-Dawley(SD)大鼠购于湖北省实验动物中心,160~200g,6~8周龄。
大鼠乳腺癌MRMT-1细胞购自广州吉妮欧生物科技有限公司。
1.2 主要试剂
二甲基亚砜(DMSO)、2-BP、蛋白酶抑制剂cocktail均购自美国Sigma公司,加强型RIPA lysis buffer、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒、HRP标记山羊抗兔IgG(H+L,A0208)均购自上海碧云天生物技术有限公司,RPMI1640培养基、胰蛋白酶、100×青霉素+链霉素混合液P/S均购自美国HyClone公司,胎牛血清购自美国Gibco公司,anti-Drp1(A0127)、anti-rabbit-β-actin(A1978)均购自中国ABclonal公司,rabbit anti-pSer47-Drp1(PA5-17391)购自美国Thermo Fisher公司。
1.3 模型建立及分组处理
将SD大鼠(18只)适应性喂养1周,随机分为假手术组、模型组和2-BP组(6只/组)。模型组和2-BP组均建立乳腺癌骨转移疼痛模型,方法如下[8]:将大鼠乳腺癌MRMT-1细胞置于含10% FBS、1% L-谷氨酰胺、2% 青霉素和链霉素的RPMI1640培养基中进行培养,收集细胞并重悬于HBSS缓冲液。模型组和2-BP组采用戊巴比妥钠(50 mg/kg)腹腔麻醉,剃毛消毒;胫骨上半部分开口,用微量注射器将10 μL MRMT-1细胞悬液(含3×105个细胞)注射到左侧胫骨髓腔内,骨蜡封口。假手术组注射相同体积HBSS缓冲液。将2-BP溶解在DMSO中,使用前用生理盐水按体积比1∶1进行稀释,调整浓度为20mmol/L。建模12d后,2-BP组剃除注射部位毛发并进行皮肤表面消毒,用无菌微量注射器于L5和L6脊椎棘突间隙垂直进针,当出现空洞感时证明注射器已进入蛛网膜下腔,将注射器由垂直缓慢倾斜至45°;根据体质量单次注射2-BP 1.0 mg/kg,注射完毕后缓慢取出微量注射器,轻轻按住注射部位1~2 min。模型组与假手术组注射相同体积DMSO+生理盐水(体积比1∶1)。
1.4 检测方法
1.4.1 50%缩足阈值(PWT)检测
各组给药后0、1、3、6和24h,将大鼠置于5mm×5mm金属丝网地板上,让其安静30min后用von Frey纤维(Stoelting,Wood Dale,IL,USA,范围从0.4g至26.0g)对后足部中间进行机械刺激。采用up-down法确定50% PWT值。简而言之,校准后的单纤维丝垂直应用于足底表面,直到纤维丝弯曲即可,每相邻的两次刺激之间间隔2min。平静状态下动物在受到刺激后出现舔足或者抬足等行为视为阳性反应,反之则为阴性反应。当出现阳性反应时,需用相邻较低一级力度的Von Frey纤维进行刺激;当出现阴性反应时,需用相邻较高一级力度的Von Frey纤维进行刺激。在出现与前一次测试反应不一致的测试结果时开始计数(连同反应出现变化前的一次测试在内),记录6次数据后结束检测。50%PWT(g)=(10[Xf+Kδ])/10000,Xf为本次行为学测试中使用的最后一个Von Frey纤维的阶数,K为痛觉阈矫正系数(可查表获得),δ为相邻不同纤维刺激之间的差异,即0.224[9]。
1.4.2 检测脊髓组织Drp1、p-Drp1表达
各组给药后24h,给予过量麻醉(戊巴比妥钠50mg/kg)处死,用眼科剪从中间分离脊柱,暴露脊髓,用解剖剪剥离脊膜,得到完整的脊髓,分离腰段脊髓。加入含有酶抑制剂的RIPA裂解液匀浆组织,4℃条件下10000r/min离心15min;取上清,加入三分之一体积的4×上样缓冲液,沸水浴加热10min,BCA蛋白分析试剂盒检测上清中的蛋白质浓度。SDS-PAGE分离蛋白质样品,电转移到PVDF膜,5%脱脂奶粉在室温下封闭1h,TBST洗膜5min×3次。4℃条件下分别加入Drp1、p-Drp1一抗(稀释比例均为1∶1000),β-actin一抗(稀释比例为1∶5000),孵育过夜。加入二抗,室温孵育1h。TBST缓冲液洗膜3次,Universal HoodⅡ凝胶成像系统扫描观察,ImageJ软件分析条带灰度值。以β-actin为内参,以目的蛋白与内参蛋白条带灰度值的比值计算Drp1、p-Drp1蛋白相对表达量,并计算p-Drp1/Drp1。
1.4.3 采用ELISA法检测脊髓组织TNF-α表达
取各组大鼠腰段脊髓组织,使用含有蛋白酶抑制剂混合物的PBS缓冲液(pH值为7.4)进行匀浆,将不同浓度标准品、样品各100μL加入孔中,37℃条件下反应90min。弃液后按每孔100μL依次加入抗TNF-α抗体工作液,37℃条件下反应60min。洗涤后每孔加入100μL ABC工作液,37℃条件下反应30min。洗涤后每孔加入90μL TMB显色液,37℃条件下反应25~30min,每孔100μL依次加入TMB终止液。使用酶标仪检测450nm波长处的OD值。
1.5 统计学方法
2 结 果
2.1 2-BP鞘内给药降低BCP大鼠机械痛敏感性
与假手术组比较,模型组给药(溶剂)后0、1、3和6h的50% PWT均降低,2-BP组给药后0、1、3和6h的50% PWT均降低,其中0和1h具有统计学差异(P<0.05)。与模型组比较,2-BP组给药(2-BP)后1、3和6h的50% PWT均升高,且具有统计学差异(P<0.05)。见表1。
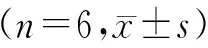
表1 各组给药后50% PWT比较
2.2 2-BP鞘内给药减弱Drp1-GTPase活性
与假手术组比较,模型组脊髓组织Drp1表达上调、p-Drp1表达下调(P<0.05);2-BP组脊髓组织Drp1表达低于模型组,但高于假手术组、p-Drp1表达高于模型组,但低于假手术组(P<0.05),见表2,图1。
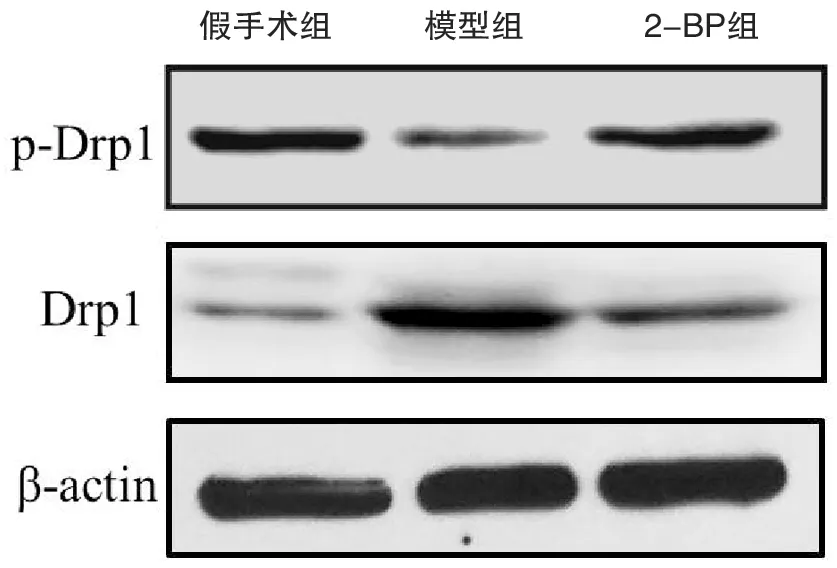
图1 免疫印迹分析各组脊髓组织中Drp1和p-Drp1蛋白表达水平
2.3 2-BP鞘内给药抑制脊髓炎症
采用ELISA法检测脊髓组织TNF-α表达发现,与假手术组相比,模型组脊髓组织中TNF-α表达上调,2-BP组TNF-α表达低于模型组,但高于假手术组,差异均有统计学意义(P均<0.05)。见表2。
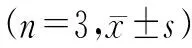
表2 各组脊髓组织Drp1、p-Drp1、TNF-α表达比较
3 讨 论
本研究以骨癌痛大鼠模型为研究载体,探究2-BP对动物痛觉行为的影响以及相关机制。2-BP参与多种痛觉的调控,在神经病理学疼痛大鼠模型中,鞘内注射2-BP可显著缓解神经损伤诱导的机械性痛觉过敏[10];在慢性背根神经节压迫(CCD)大鼠模型中,2-BP鞘内注射可显著减缓动物的热痛觉过敏和机械性痛觉过敏,同时下调NR2B棕榈酰化[11]。在本研究中,通过对骨癌痛大鼠给药(2-BP)前后的痛觉行为分析表明,鞘内注射可显著改善动物的痛觉行为表现。本研究结果不仅在新的痛觉模型中证明了2-BP具有镇痛作用,同时也为2-BP在痛觉调节中的作用提供了新的研究基础。
线粒体生物学功能正常与否与动物的痛觉行为密切相关,主要体现在线粒体相关蛋白的表达调控。线粒体分裂相关蛋白Drp1在痛觉模型中被证明表达量上调,如慢性收缩损伤模型(CCI)[12];抑制或下调Drp1的表达可显著降低化疗药物诱导的神经病理性疼痛模型动物的痛觉行为[13]。Drp1的棕榈酰化在调节线粒体生物活性中起关键作用[14]。Drp1的S-棕榈酰化可以被棕榈酰酰基转移酶(PAT)ZDHHC13调控,在ZDHHC13缺陷小鼠中,Drp1中S-棕榈酰化状态较低,线粒体动力学紊乱[15]。该结果提示,S-棕榈酰化和线粒体融合/分裂动力学之间具有相关性。2-BP通过抑制DHHC PATs发挥棕榈酰化抑制剂的作用而调节。本研究显示,骨癌痛模型动物脊髓组织中Drp1的总蛋白和p-Drp1水平均表达异常,2-BP处理后部分恢复了Drp1的表达和p-Drp1。通过总结上述结果表明,2-BP可能通过调节特定线粒体蛋白的棕榈酰化而影响线粒体功能,进而改善疼痛诱导动物的疼痛行为。
本研究发现,TNF-α在骨癌痛模型动物中表达上调,而2-BP处理后TNF-α含量下调。另有研究显示[10],在神经病理学疼痛大鼠模型中,TNF-α介导了特定蛋白的棕榈酰化修饰,从而在痛觉调控中发挥作用。据此推测,本研究中,骨癌痛动物Drp1的表达和修饰异常可能与TNF-α的异常调节相关,但是,二者之间具体的作用关系还有待进一步研究。
综上所述,2-BP鞘内给药可减缓乳腺癌骨转移大鼠的疼痛行为,其机制可能与激活脊髓线粒体Drp1活性及抑制炎症反应有关。

