熟用“一二三”法基本突破电化学问题

摘 要:电化学是高中化学知識的重要组成部分,也是高考的重要考点。电化学主要涉及到电学知识,氧化还原反应知识,这些知识都比较抽象和复杂。如何根据学生现有知识水平和认知特点帮助学生建立行之有效的解题模型,变抽象为具体、化繁为简、努力提高学生电化学解题综合水平是实际教学中各高中化学教师一直在努力探索的问题。熟用“一二三”法基本突破电化学问题是其中探索总结之一。
关键词:“一二三”法;基本突破;电化学问题
电化学是研究化学能与电能相互转化的装置、过程、效率的科学。它在电池、电解、电镀等工业领域发挥着重要作用,是与人类生产生活密切相关的知识,但电化学知识综合性强、抽象,故此中学生学习电化学知识时感觉难度相当大。如何根据学生现有知识水平和认知特点帮助学生建立行之有效的解题模型,变抽象为具体、化繁为简、努力提高学生电化学解题综合水平是实际教学中各高中化学教师一直在探索的问题。本人在长期的教学实践中总结出“一二三”法为学生基本突破电化学问题提供行之有效的方法。
一、“一二三”法基本内容与思维模型
1、“一二三”法基本内容
2、思维建模
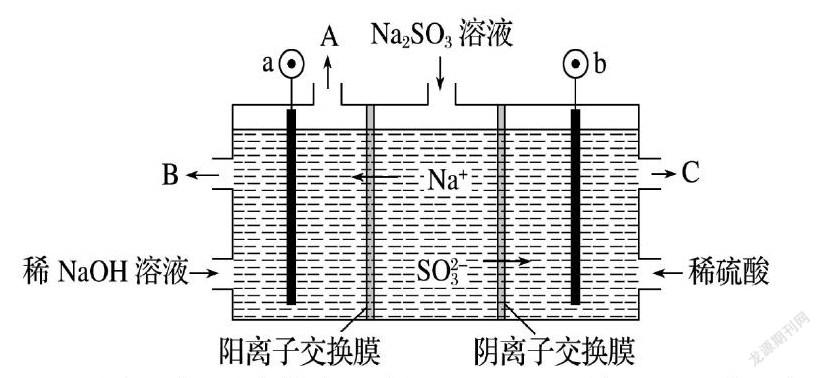
例.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
(1)图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
(2)SO放电的电极反应式为________________________。
思维模型:建立电子及阴离子移动闭合回路根据阴离子或电子移动方向在闭合回路中找出电子或阴离子移动方向找出电源正负极及电池阴阳极找出电解质中得失电子的阳离子和阴离子及它们对应的产物离子根据氧化还原反应原理及介质酸碱性或中性写出正确的电极反应。
上题答案:(1)负(2)SO-2e-+H2O=SO42-+2H+
二、运用“一二三”法突破高考真题
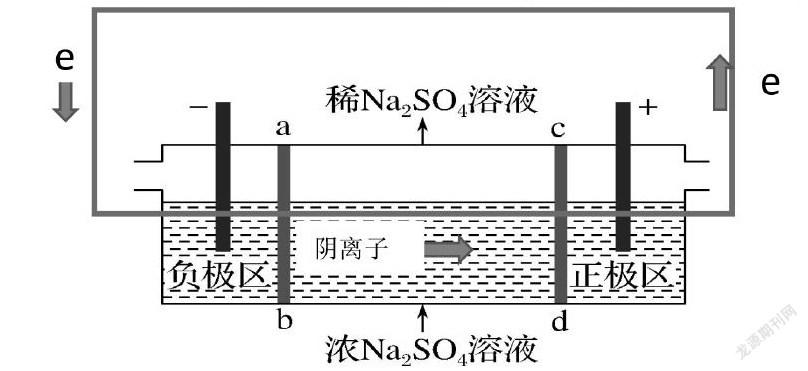
题1.(2016·全国卷Ⅰ,11)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是( )
A.通电后中间隔室的SO离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
根据“一二三”法解题思维模型解题:由题意建立如上图电子及阴离子移动方向环形图再逐一分析选项。A选项SO离子向正极迁移正确,根据电荷守恒原理正极区增加了阴离子必然会增加阳离子H+,pH减少。A错误。B选项根据阴阳离子移动方向知:Na+向负极迁移产生NaOH,SO离子向正极迁移H2SO4,故B选项正确。C选项根据电子及阴离子移动方向环形图知:电子流入负极区(得电子),故C选项错误。D选项根据转移电子守恒,电路中通过1mol电子的电量,产生0.25mol的O2,故D错误。
结束语:学好高中电化学知识,除要有扎实的理论知识外,在实际解题过程中更要始终贯穿氧化还原反应思想,两条(内外)电路导电原理思想,准确把握电解质溶液的酸碱性、非水体系中的熔盐问题。牢记“一二三”方法模型,就可以化抽象为具体、化复杂为简单、化茫然为自信。一定能突破电化学问题。
参考文献
[1]荣政.人教版中学化学教材中“电化学”衔接性研究[D].贵州师范大学,2018.
[2]石春婷,李紫薇,张月梅,等.理性思维在中学化学的应用——以电化学教学为例[J].广州化工,2017,45(16):209-211.
作者简介:作者:莫新苗,男,1977,湖南长沙,大学本科,高中化学教学方法,单位:湖南省地质中学

