核桃低聚肽对辐射小鼠小肠损伤的保护作用
珠娜 刘睿 郝云涛 张亭
摘要:目的:探讨核桃低聚肽(walnut oligopeptides,WOPs)对辐射小鼠小腸损伤的保护作用。方法:将96只SPF级雌性BALB/c小鼠随机分为6组:空白对照组、模型对照组、乳清蛋白组(044g/kg)、3个WOPs组(022、044、088g/kg),再将每组随机分为2个亚组。连续饮水干预不同溶液第14天,除空白对照组外所有小鼠全身照射35Gy剂量60Coγ射线,分别在辐射后第3天和第14天采用ELISA法检测小鼠血清脂多糖(LPS)、二胺氧化酶(DAO)、D乳酸水平,对小鼠十二指肠、空肠和回肠进行HE染色,观察其损伤情况,并用ImageJ软件测量绒毛长度和隐窝深度。结果:辐射改变了小肠形态结构,显著降低了绒毛长度,增加了隐窝深度及血清LPS、DAO、D乳酸水平(P<005)。与模型对照组相比,预先补充或后期继续干预乳清蛋白和WOPs不同程度地改善了辐照小鼠小肠形态结构。辐射后第3天,与模型对照组相比,WOPs各剂量组小鼠小肠各肠段绒毛长度显著增高(P<005),隐窝深度、血清LPS水平、血清DAO水平及血清D乳酸水平显著降低(P<005)。辐射后继续干预乳清蛋白及WOPs至辐射后第14天,与模型对照组相比,WOPs中、高剂量组小鼠小肠各肠段绒毛长度显著增加(P<005),隐窝深度、血清LPS水平及血清DAO水平均显著降低(P<005),血清DAO水平则是WOPs低、中剂量组显著降低。辐射后第3天和第14天,乳清蛋白组的效果均不显著。结论:WOPs对辐射小鼠小肠损伤具有良好的保护作用。
关键词:核桃低聚肽;辐射防护;小肠损伤;D乳酸;二胺氧化酶
小肠黏膜屏障,即小肠上皮细胞(IEC)层具有保护无菌微环境免受物理、化学及生物损害的作用,而小肠上皮的完整性依赖于多能肠干细胞(ISCs)的持续和可诱导的更新。全身照射或放射治疗引起的辐射遗传毒性效应阻碍ISCs的持续更新,导致肠上皮损伤,细菌易位,肠道通透性增加,随后激活机体免疫反应及炎症反应[15],而过度的炎症反应进一步加重小肠黏膜损伤并形成恶性循环,最终导致营养吸收不良而严重影响生活质量[6],因此,在辐射防护中以肠道为靶点减轻辐射损伤作用具有重要的意义。核桃低聚肽(WOPs)是以核桃蛋白为原料,采用酶解技术提取的分子量小于1 000Da的生物活性肽,已有研究显示,WOPs具有抗氧化、抗肿瘤、抗疲劳、免疫调节、改善学习记忆等一系列生物活性[711]。本研究探讨了WOPs对辐射小鼠小肠损伤的保护作用。
1材料与方法
11主要试剂与仪器
WOPs(河南九鼎君健生物医药科技有限公司,分子量小于1 000D)、小鼠脂多糖(LPS)ELISA试剂盒(Andygene)、小鼠二胺氧化酶(DAO)ELISA试剂盒(Andygene)、小鼠D乳酸ELISA试剂盒(Andygene)、Eppendorf 高速冷冻离心机(德国艾本股份公司Eppendorf,德国)、NIKON E400正置荧光显微镜(尼康株式会社,日本)、HFY1A 沽源控制台、HFY601 固定式多路xγ剂量率仪、60Coγ射线辐射源(北京大学化学学院)。
12实验动物分组与处理
健康SPF级雌性BALB/c小鼠96只,6~8周龄,体重 18~22g。由北京大学医学部实验动物中心提供,实验动物生产许可证号:SCXK(京)20160010,实验动物使用许可证号:SYXK(京)20160041;将小鼠按体重随机分为6组,每组16只,分别为空白对照组、模型对照组、乳清蛋白组(044g/kg)和3个WOPs组(022、044、088g/kg),将每组再次随机分为2个亚组。饮水干预不同溶液第14天,除空白对照组外将所有小鼠分别置于单独的有机玻璃盒(3cm×3cm×11cm)中,一次性全身辐照35 Gy剂量的60Coγ射线,吸收剂量率为1Gy/min,辐射时间为35min。各组小鼠饲养于屏障级动物室,喂饲SPF级生长繁殖饲料,自由饮食和饮水。受试样品通过饮水摄入,对照组给予蒸馏水,其他各组小鼠分别给予相应浓度的乳清蛋白及WOPs水溶液,不同亚组干预时间不同,给予15~30d。
13指标与方法
131肠道通透性检测辐照后继续给予干预物,并于照射后第3天和第14天,小鼠颈椎脱臼处死,并摘眼球取血,分离血清,用ELISA法检测血清D乳酸水平。
132肠道屏障检测辐照后继续给予干预物,并于照射后第3天和第14天,小鼠颈椎脱臼处死,并摘眼球取血,分离血清,用ELISA法检测血清脂多糖(LPS)和二胺氧化酶(DAO)水平。
133小肠组织病理切片辐照后继续给予干预物,并于照射后第3天和第14天,每组取4只小鼠颈椎脱臼处死,分别取十二指肠、空肠、回肠固定于10%中性甲醛溶液中,24 h后进行脱水、石蜡包埋、每只小鼠的每个肠段选取4个横截面进行切片,HE染色,用光学显微镜进行肠道病理观察,并且每只老鼠需选取30个独立的绒毛和隐窝用ImageJ软件进行绒毛长度(绒毛连接处到绒毛顶端)和隐窝深度(绒毛连接处到肠腺基部)的测量,最后计算每只老鼠的平均绒毛长度和隐窝深度。
14统计分析
数据均以±s表示,并采用SPSS 130软件进行单因素方差分析,采用LSDt检验进行两两比较,P<005为差异有统计学意义。
2结果与分析
21WOPs对辐射小鼠小肠形态结构的影响
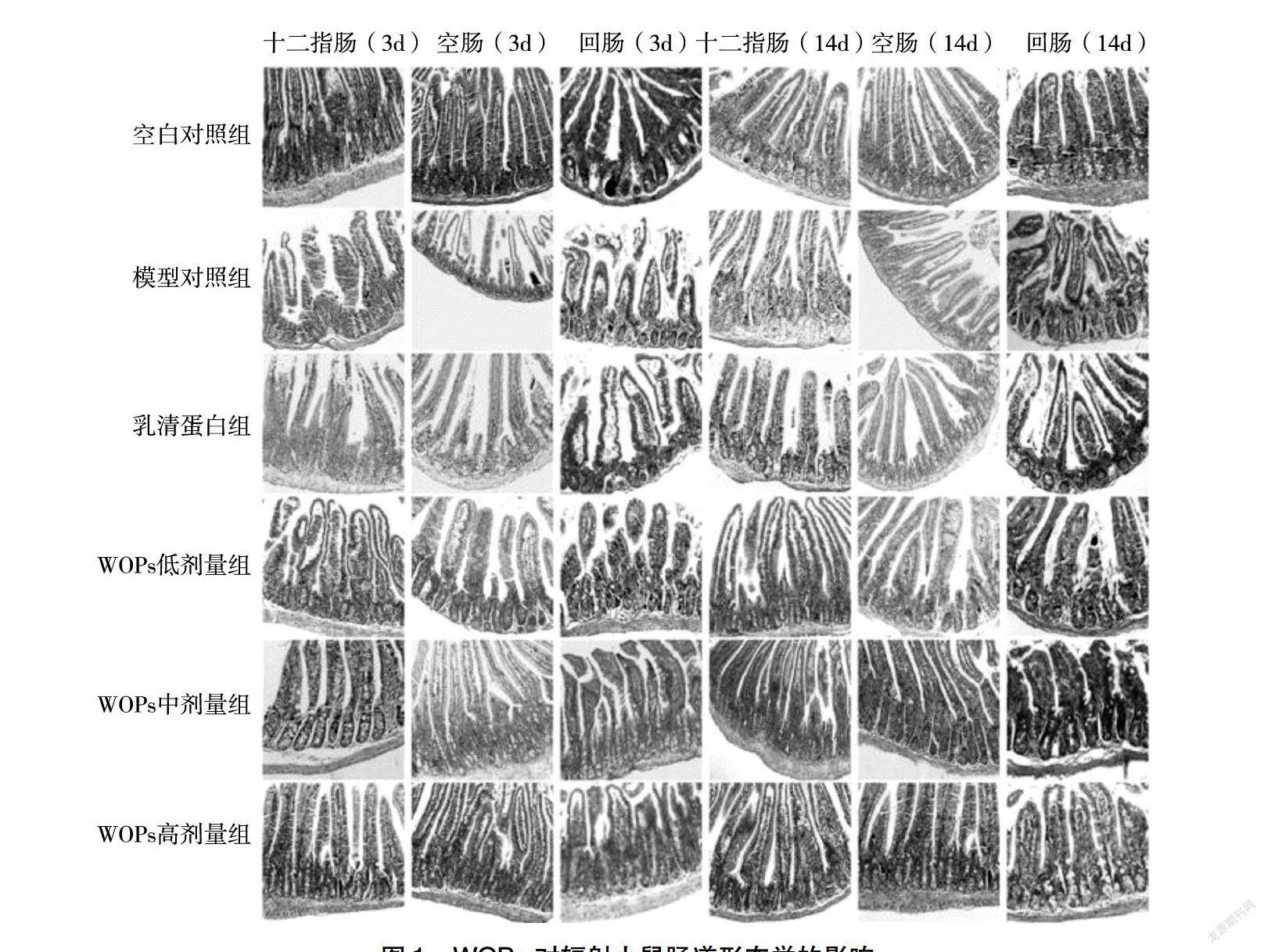
由图1可知,空白对照组小鼠小肠绒毛排列紧密、整齐、有规则、肠腺完整,内细胞数目较多,未见有炎症细胞浸润。辐射模型组绒毛排列稀疏、不规整、萎缩、断裂,见较少残存肠腺,内细胞变性坏死,可见有炎症细胞浸润。乳清蛋白和WOPs干预后不同程度地改善了小鼠的肠道形态结构,绒毛排列较紧密、整齐、规则,可见较多的再生肠腺,炎症细胞浸润较少。
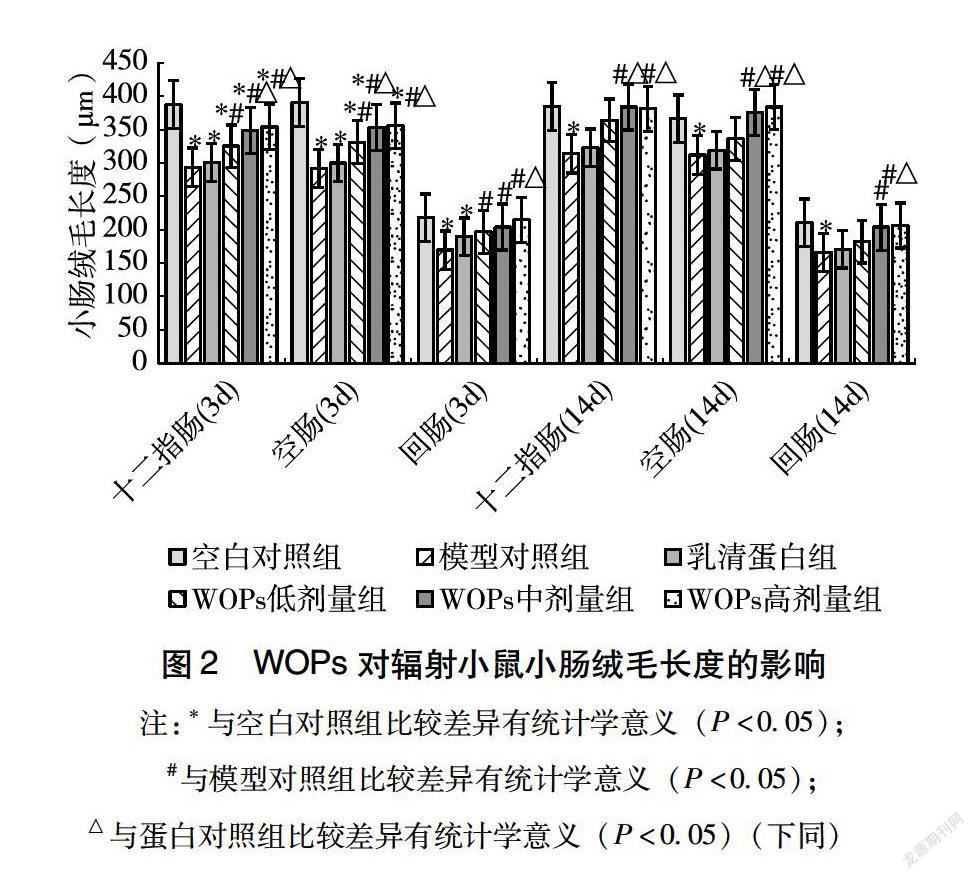
211WOPs对辐射小鼠小肠绒毛长度的影响辐射后第3天,与空白对照组相比,辐射显著降低了小鼠小腸各肠段绒毛长度,而WOPs各剂量组小鼠回肠绒毛长度无显著变化;与模型对照组相比,WOPs各剂量组小鼠小肠各肠段绒毛长度均显著增高;与乳清蛋白组相比,WOPs中、高剂量组小鼠十二指肠、空肠和WOPs高剂量组小鼠回肠绒毛长度显著增高。辐射后第14天,辐射模型组小鼠小肠各肠段绒毛长度仍显著低于空白对照组;与模型对照组相比,WOPs中、高剂量组小鼠小肠各肠段绒毛长度显著增高;与乳清蛋白组相比,WOPs中、高剂量组小鼠十二指肠、空肠和WOPs高剂量组小鼠回肠绒毛长度显著增高(图2)。
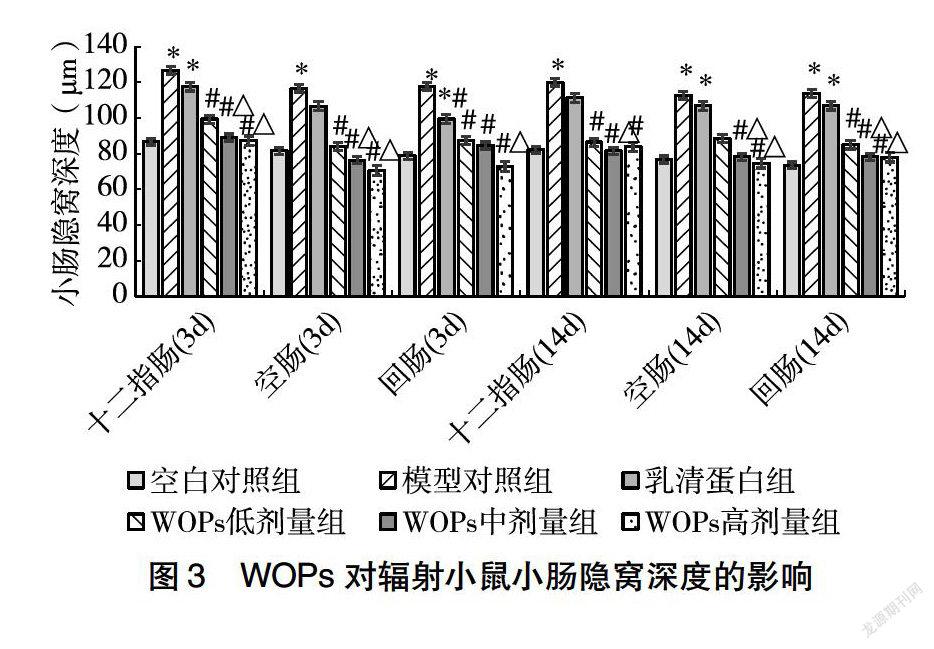
212WOPs对辐射小鼠小肠隐窝深度的影响辐射后第3天,与空白对照组相比,辐射显著增高了小鼠小肠各肠段隐窝深度,而WOPs各剂量组小鼠小肠各肠段隐窝深度均无显著变化;与模型对照组相比,WOPs各剂量组小鼠小肠各肠段隐窝深度及乳清蛋白组小鼠回肠隐窝深度显著降低;与乳清蛋白组相比,WOPs中、高剂量组小鼠十二指肠、空肠隐窝深度及WOPs高剂量组小鼠回肠隐窝深度显著降低。辐射后第14天,辐射模型组小鼠小肠各肠段隐窝深度及乳清蛋白组小鼠空肠、回肠隐窝深度显著高于空白对照组;与模型对照组相比,WOPs各剂量组小鼠十二指肠、回肠隐窝深度及WOPs中、高剂量组小鼠空肠隐窝深度显著降低;与乳清蛋白组相比,WOPs中剂量组小鼠十二指肠隐窝深度及WOPs中、高剂量组小鼠空肠和回肠隐窝深度显著降低(图3)。
22WOPs对辐射小鼠血清LPS含量的影响
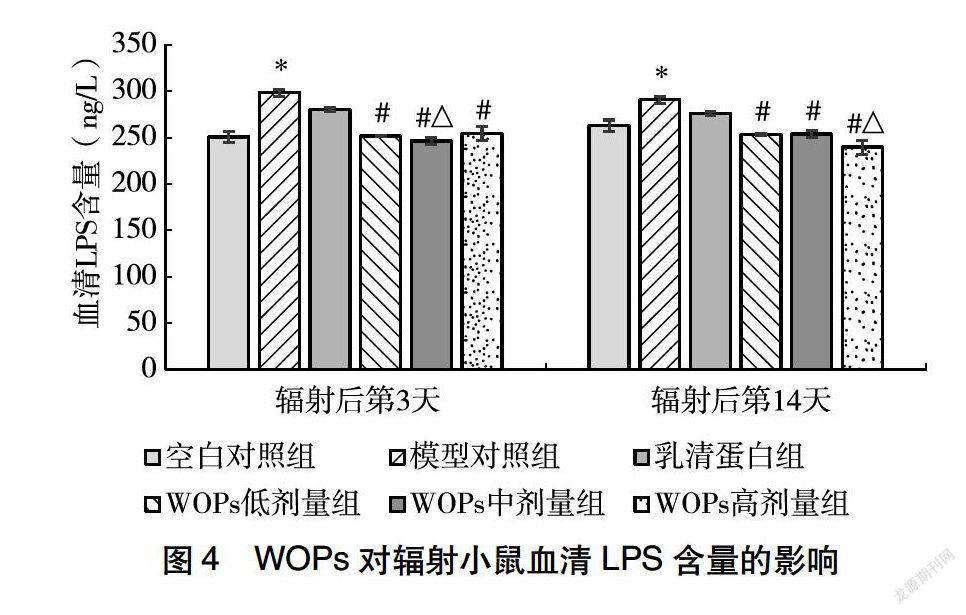
辐射后第3天,与空白对照组相比,辐射显著增高了小鼠血清LPS水平,而乳清蛋白组及WOPs干预组小鼠血清D乳酸水平与空白对照组相比均无显著差异;与模型对照组相比,WOPs各剂量组小鼠血清D乳酸水平均显著降低;与乳清蛋白组相比,WOPs中剂量组小鼠血清D乳酸水平显著降低。辐射后第14天,辐射模型组小鼠血清D乳酸水平显著高于空白对照组,乳清蛋白组及WOPs干预组小鼠血清D乳酸水平与空白对照组相比无显著差异;与模型对照组相比,WOPs各剂量组小鼠血清D乳酸水平均显著降低;与乳清蛋白组相比,WOPs高剂量组小鼠血清D乳酸水平显著降低(图4)。
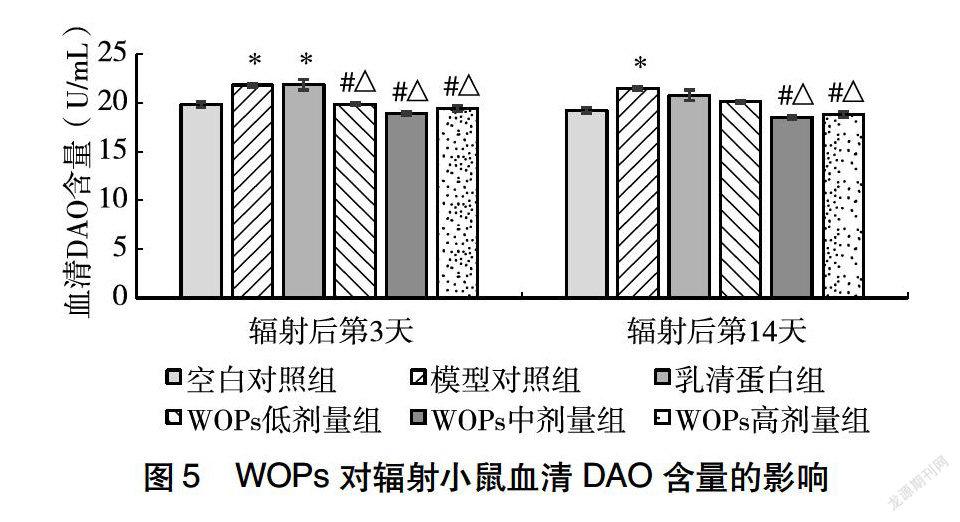
23WOPs对辐射小鼠血清DAO含量的影响
辐射后第3天,与空白对照组相比,模型对照组和乳清蛋白组小鼠血清DAO含量显著增高,WOPs各剂量组均无显著差别;与模型对照组相比,WOPs各剂量组小鼠血清DAO水平均显著降低;与乳清蛋白组相比,WOPs各剂量组小鼠血清DAO水平均显著降低。辐射后第14天,模型对照组小鼠血清DAO水平仍显著高于空白对照组,而乳清蛋白组及WOPs干预组与模型对照组相比均无显著差异;与模型对照组相比,WOPs中、高剂量组小鼠血清DAO水平显著降低;与乳清蛋白组相比,WOPs中、高剂量组小鼠血清DAO水平也均显著降低(图5)。
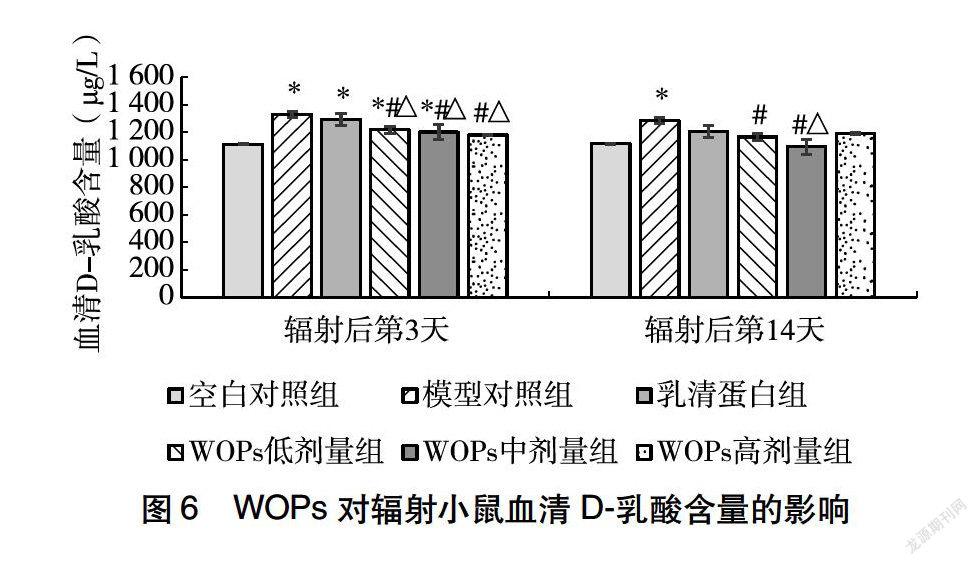
24WOPs对辐射小鼠小肠通透性的影响
辐射后第3天,与空白对照组相比,辐射显著增高了小鼠血清D乳酸水平,而WOPs高剂量组小鼠血清D乳酸水平与空白对照组相比无显著差异;与模型对照组相比,WOPs各剂量组小鼠血清D乳酸水平均显著降低;与乳清蛋白组相比,WOPs各剂量组小鼠血清D乳酸水平均显著降低。辐射后第14天,除模型对照组外,其他干预组小鼠血清D乳酸水平与空白对照组相比无显著差异;与模型对照组相比,WOPs低、中剂量组小鼠血清D乳酸水平显著降低;与乳清蛋白组相比,WOPs中剂量组小鼠血清D乳酸水平显著降低(图6)。
3结论与讨论
预先补充或后期继续给予WOPs可不同程度地降低小鼠血清D乳酸、LPS、DAO水平,小肠组织病理切片显示,WOPs干预可改善小肠黏膜损伤情况,不同程度地增高小肠绒毛高度并降低隐窝深度,对辐射小鼠小肠损伤有显著的保护作用。
电离辐射作用与机体后,通过物理、化学和生物学的复杂机制,继DNA等大分子损伤后,出现细胞、组织、器官系统乃至整个机体功能代谢和形态学的辐射损伤,最终导致多器官损伤及功能衰竭[1213]。其中,小肠的辐射损伤导致营养物质及液体吸收减少、电解质失衡、屏障功能丧失、细菌移位、全身细菌感染及脓毒症等[1417],在辐射损伤的发展中起着重要作用。因此,通过抑制辐射对小肠的损伤作用,同时提高受辐射损伤的小肠组织的修复能力不失为一种有效的辐射防护途径。越来越多的研究显示,生物活性肽有显著的辐射防护作用,可通过抑制DNA损伤和细胞凋亡,调节机体免疫反应、提高机体抗氧化能力来减轻组织的辐射损伤[18]。本研究通过检测辐射小鼠血清D乳酸、LPS、DAO水平及观察小肠组织病理损伤情况,测量小肠绒毛长度和隐窝深度来探讨WOPs对辐射小鼠小肠损伤的改善情况。为避免单纯提高蛋白质的摄入量而引起假阳性结果,本实验设立了乳清蛋白对照组。
肠黏膜上皮是成年哺乳动物中更新最快的组织,位于隐窝底部的多能ISCs增殖分化为4种主要的上皮细胞,包括绒毛细胞、杯状细胞、肠内分泌细胞和潘氏细胞,而绒毛尖端的成熟细胞逐渐凋亡。据研究,小鼠肠粘膜上皮的更新周期为3~5d[1921]。IEC具有很强的辐射敏感性,研究发现,即使005 Gy的辐射剂量也会检测到肠道上皮的损伤[22],是辐射损伤的主要靶细胞之一。本研究发现,35Gy的60Coγ射线全身辐射导致小鼠小肠绒毛排列不规则,形状大小不一,肠绒毛稀疏,萎缩,断裂,与正常小鼠相比绒毛长度显著降低,隐窝深度显著增加(P<005)。WOPs预先补充或后期继续干预均不同程度地改善了小肠形态结构,绒毛排列较整齐,绒毛长度显著增加,可见较多的再生肠腺,隐窝深度显著降低,对防治上皮细胞损伤和促进修复具有良好的作用。
急性辐射损伤导致的肠道上皮凋亡、黏膜屏障破坏,最终导致细菌及内毒素易位大量入血,血清LPS含量显著增加[23]。而内毒素血症又导致炎症介质、细胞因子的过量释放,进一步加重肠黏膜屏障损伤[24]。本研究显示,35Gy的60Coγ射线全身辐射显著增加了小鼠血清LPS水平(P<005)。辐射后第3天,预先补充乳清蛋白及WOPs显著抑制了LPS入血,使血清LPS含量处于正常水平。其中,WOPs各剂量组小鼠血清LPS水平显著低于模型对照组,WOPs中剂量组显著低于乳清蛋白组(P<005)。辐射后继续给予WOPs至辐射后第14天时,WOPs各剂量组小鼠血清LPS水平仍显著低于模型对照组,其中,WOPs高剂量组小鼠血清LPS含量显著低于乳清蛋白组(P<005)。可知WOPs预先补充或后期继续给予可减轻辐射对小肠黏膜的损伤,提高其损伤修复能力,降低血清LPS水平,避免LPS趋化炎症因子而加重组织损伤,同时改善辐照小鼠营养状况。
DAO是一种细胞内酶,主要存在于肠绒毛细胞胞漿中,具有高度活性,而在其他组织含量少,活性低。当肠粘膜细胞受损,黏膜屏障破坏时,DAO释放入血或随脱落的肠粘膜细胞进入肠腔内,进而引起血和肠腔DAO活性增高。由于DAO在外周血中活性稳定,一般通过检测DAO在外周血中的变化来反映肠粘膜损伤与修复情况[2527]。本研究显示,35Gy的60Coγ射线全身辐射显著增高了小鼠血清DAO含量(P<005)。辐射后第3天,预先补充WOPs显著降低了辐射小鼠血清DAO含量,WOPs各剂量组小鼠血清DAO水平显著低于模型对照组和乳清蛋白组(P<005)。辐射后继续干预乳清蛋白及WOPs至辐射后第14天时,干预组小鼠血清DAO含量均在正常范围内,WOPs中、高剂量组小鼠血清DAO水平显著低于模型对照组及乳清蛋白组(P<005)。上述结果说明WOPs预先补充或后期继续干预均可减轻肠粘膜损伤。
辐射产生的大量自由基攻击肠上皮细胞,导致肠黏膜细胞凋亡,细胞间的紧密连接被破坏,肠道通透性增加。此外,黏膜屏障破坏,细菌易位引起的肠源性内毒素血症,促使大量细胞因子的释放,加重黏膜屏障的损伤和肠道通透性的增加[2829]。血清D乳酸水平是反映肠道通透性增加的有效标志物。D乳酸是肠道菌群细菌的代谢产物,而哺乳动物各组织均不产生D乳酸,少量D乳酸经尿液排出。所以,D乳酸基本来源于肠道,其含量与肠道通透性密切相关,所有引起肠道通透性增高的因素均导致血清D乳酸含量增加[3031]。本研究显示,35Gy的60Coγ射线全身辐射显著增高了小鼠血清D乳酸水平(P<005)。辐射后第3天,WOPs各剂量组小鼠血清D乳酸水平显著低于模型对照组及乳清蛋白组(P<005),而与正常对照组相比,WOPs高剂量组小鼠血清D乳酸水平未发生显著增加的现象(P>005)。辐射后继续干预乳清蛋白及WOPs至辐射后第14天时,干预组小鼠血清D乳酸水平均恢复至正常水平,其中WOPs低、中剂量组显著低于模型对照组,WOPs中剂量组显著低于乳清蛋白组(P<005)。辐射小鼠血清D乳酸水平显著升高是辐射引起肠道通透性增加的重要表现。而预先补充或后期继续给予WOPs均不同程度地抑制了其升高,表明WOPs对防治肠上皮细胞损伤和促进上皮细胞修复具有良好的作用。
综上所述,WOPs可增加辐照小鼠小肠绒毛高度,降低隐窝深度,改善辐照小鼠小肠形态结构,从而降低血清D乳酸、LPS、DAO水平。WOPs的预先补充即能减轻损伤,而照后继续补充有助于提高组织修复能力。WOPs对辐射小鼠小肠损伤的保护作用的机制可能与WOPs抑制肠上皮细胞凋亡、清除自由基、免疫调节等相关。◇
参考文献
[1]胡海翔,李光伟电磁辐射对人体的影响及防护[M].北京:人民军医出版社,2015
[2]姜恩海,龚守良,曹永珍电离辐射损伤与临床诊治[M].北京:人民军医出版社,2015
[3]Fischer Julius C,Bscheider Michael,Eisenkolb Gabriel,et al.RIGI/MAVS and STING signaling promote gut integrity during irradiationand immunemediated tissue injury[J].Science Translational Medicine,2017,9(386):g2513
[4]Peterson L W,Artis DIntestinal epithelial cells:regulators of barrier function and immune homeostasis[J].Nature Reviews Immunology,2014,14(3):141153
[5]Heidegger S,Mr Van Den Brink,Haas T,et alThe role of patternrecognition receptors in graftversushost disease and graftversusleukemia after allogeneic stem cell transplantation[J].Front Immunol,2014,5:337
[6]Liang Wei,Leibowitz Brian J,Epperly Michael,et alThe GSnitroxide JP4039 improves intestinal barrier and stem cell recovery in irradiated mice[J].Sci Rep,2018,8(1):2072
[7]刘威,闵伟红,刘春雷,等核桃清蛋白抗氧化肽的制备及其活性研究[J].食品研究与开发,2017(17):4044
[8]Ma S,Huang D,Zhai M,et alIsolation of a novel biopeptide from walnut residual protein inducing apoptosis and autophagy on cancer cells[J].BMC Complementary and Alternative Medicine,2015,15:413
[9]Miao HThe Research on the impact of maca polypeptide on sport fatigue[J].Open Biomedical Engineering Journal,2015,9(1):322
[10]崔玲玉长白山核桃蛋白肽的制备及功能活性研究[D].长春:吉林农业大学,2016
[11]Li W,Zhao T,Zhang J,et alEffect of walnut protein hydrolysate on scopolamineinduced learning and memory deficits in mice[J].Journal of Food Science and Technology,2017,54(10):31023110
[12]SpotheimMaurizot M,Davídková MRadiation damage to DNA in DNAprotein complexes[J].Mutation Research,2011,711(12):4148
[13]Lu Xinyue,Nurmemet Dilber,Bolduc David L,et al Radioprotective effects of oral 17dimethylaminoethylamino17demethoxygeldanamycin in mice:bone marrow and small intestine[J].Cell & Bioscience,2013,3(1):36
[14]Booth C,Tudor G,Tudor J,et alAcute gastrointestinal syndrome in highdose irradiated mice[J].Health Physics,2012,103(4):383
[15]Naftalin RAlterations in colonic barrier function caused by a low sodium diet or ionizing radiation[J].J Environ Pathol Toxicol Oncol,2004,23(2):7997
[16]Dublineau Isabelle,et alIn vivo alterations of fluid and electrolyte fluxes in rat colon by gamma irradiation[J].Digestive Diseases & Sciences,1998,43(3):652662
[17]Gits J,Gerber G BElectrolyte loss,the main cause of death from the gastrointestinal syndrome?[J].Radiation Research,1973,55(1):1828
[18]He L X,Wang J B,Sun B,et alSuppression of TNFα and free radicals reduces systematic inflammatory and metabolic disorders:radioprotective effects of ginseng oligopeptides on intestinal barrier function and antioxidant defense[J].Journal of Nutritional Biochemistry,2017(40):5361
[19]Barker N,van Es J H,Jaks V,et alVery longterm selfrenewal of small intestine,colon,and hair follicles from cycling Lgr5+ve stem cells[J].Cold Spring Harb Symp Quant Biol,2008,73(73):351356
[20]Bjerknes M,Cheng HGastrointestinal stem cells II Intestinal stem cells[J].Current Gastroenterology Reports,2005,12(5):340348
[21]Barker,Nick,van Nbsp,et alIdentifying the Stem Cell of the Intestinal Crypt:Strategies and Pitfalls[J].Cell Stem Cell,2012,11(4):452460
[22]Helmrath Michael A,Shin Cathy E,Erwin Christopher R,et alEpidermal growth factor upregulates the expression of its own intestinal receptor after small bowel resection[J].Journal of Pediatric Surgery,1998,33(2):229234
[23]曹樂电离辐射对小鼠肠道隐窝素4表达的影响及意义[D].重庆:第三军医大学,2015
[24]Kantara Carla,et alNovel regenerative peptide TP508 mitigates radiationinduced gastrointestinal damage by activating stem cells and preserving crypt integrity[J].Laboratory Investigation,2015,95(11):12221233
[25]张锷人脐带间充质干细胞对放射性损伤大鼠肠道自由基及肠细胞调亡的影响[D].衡阳:南华大学,2015
[26]辛勇,周凤娟,唐天友,等低剂量辐射预处理对小鼠放射性肠黏膜损伤的保护作用[J].山东医药,2011,51(45):2829
[27]余磊蜂胶总黄酮对大鼠照射导致急性肠黏膜损伤保护作用的实验研究[D].苏州:苏州大学,2011
[28]Lee J S,Tato C M,Joyceshaikh B,et alInterleukin23independent IL17 production regulates intestinal epithelial permeability[J].Immunity,2015,43(4):727738
[29]Weaver Casey T,et alThe Th17 pathway and inflammatory diseases of the intestines,lungs and skin[J].Annual Review of Pathology,2013,8(1):477512
[30]李天娇,张永杰,王子龙,等干酪乳杆菌对不同剂量丙烯酰胺诱导大鼠肠道损伤的保护效果[J].食品科学,2018,39(9):121126
[31]夏振娜右美托咪啶对热射病小鼠的保护作用及基于肠道屏障的机制研究[D].上海:第二军医大学,2017

