叶黄素对大鼠视网膜LED蓝光损伤的保护作用
杨娇 张雅琴 张黎 廖章伊 侯艳梅 詹智钧 谢奎 张召锋

摘 要:目的:探讨叶黄素对视网膜LED蓝光损伤的保护作用。方法:48只雄性SD大鼠(6~8周龄,体重180~220g)随机分为6组:正常对照组、模型对照组、溶剂对照组,叶黄素低、中、高剂量组(25、50、100mg/kg)。以纯玉米油为溶剂,将叶黄素溶于玉米油中灌胃饲养30d。饲养末,将所有实验动物置于暗室中暗适应24h后,除正常对照组外,其余大鼠用LED蓝光损伤装置制备大鼠视网膜LED蓝光损伤动物模型,光暴露时间为1.5h,光暴露强度为1 400~1 500lux,光暴露后暗室饲养。24h后股静脉采血、处死,摘取眼球制备眼球壁石蜡切片,HE染色后观察视网膜形态学变化,测定血清中氧化应激相关指标。结果:模型对照组和溶剂对照组大鼠视网膜外核层厚度较正常对照组显著降低;经过叶黄素预处理的大鼠,在LED蓝光损伤后,视网膜外核层厚度降低不明显。大鼠接受LED蓝光损伤后,与正常对照组相比,模型对照组血清中丙二醛(MDA)的含量显著增加(P<0.05),谷胱甘肽过氧化物酶(GSH-Px)的含量显著降低(P<0.05)。与模型对照组和溶剂对照组相比,叶黄素各剂量组血清中MDA含量減少(P<0.05),而GSH-Px含量显著增加(P<0.05),但叶黄素三个剂量组之间MDA和GSH-Px无显著差异(P>0.05)。结论:叶黄素对大鼠视网膜LED光损伤有明显的保护作用,可能的机制是通过淬灭氧自由基,抑制脂质过氧化发挥其保护作用的。
关键词:LED蓝光;视网膜;叶黄素
发光二极管(LED)是一种长寿命的低发热光源,其需要很少的电力,因而使得LED在智能电话、计算机等电子设备的液晶显示器上得到了广泛使用。然而,电流LED发出的蓝光强度远高于白炽灯、荧光灯和自然光发出的蓝光[1]。科技的发展和电子产品的普及使得人们花费更多的时间在电子产品上。过度使用电子产品的人不仅易患上电脑视觉综合症,如眼睛疲劳的增加[2],也会导致蓝光(400~500 nm)暴露增加,而这是导致一些眼部疾病的危险因素,如年龄相关性视网膜黄斑变性(AMD)[3]。叶黄素为一种含氧的类胡萝卜色素,是视网膜黄斑色素的主要组成成分,主要存在于视网膜周围区域[4]。叶黄素由于具有过滤蓝光[5]、抗氧化[6-7]、抗炎[8]等作用在预防一些视网膜疾病如AMD[9]、糖尿病视网膜病变[10]、葡萄膜炎[11]和光诱导视网膜变性[12]等疾病中受到了广泛关注。但目前关于叶黄素防护LED蓝光损伤的研究还较少报道。我们推测,由于叶黄素具有以上多种生物学作用,可能在LED诱导的视网膜蓝光损伤中也具有良好的防护作用。因此,本研究以叶黄素为补充物质,研究叶黄素对大鼠视网膜LED蓝光损伤的保护作用及可能机制,为叶黄素用于防治眼部疾病提供科学依据。
1 材料与方法
1.1 实验动物
雄性SD大鼠48只,6周龄,体重180~200g,购自北京维通利华实验动物技术有限公司,实验大鼠饲养在中国疾病预防控制中心动物实验中心屏障环境。温度范围为(22±2)℃,相对湿度为50%~60%,昼:夜明暗交替时间为12 h∶12 h。
1.2 主要试剂与仪器
叶黄素,淡黄色固体粉末,纯度为98%,分子量为568.88,陕西森弗天然制品有限公司;纯玉米油,淡黄色油性液体,上海阿拉丁生化科技股份有限公司;超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒、丙二醛(MDA)测定试剂盒、一氧化氮(NO)测定试剂盒,南京建成生物工程有限公司;低温高速离心机,德国Eppendorf公司;光损伤仪(自制)、暗适应箱(自制)、手术显微镜(OPMI6-CFC,SONY,日本)、光学显微镜(ECLIPSS E400,Nikon,日本)、石蜡切片机(LEICA RM 2135,德国)、远方SPIC-200A光谱彩色照度计,杭州远方仪器有限公司;微量注射器、止血钳、持针器、角膜剪。
1.3 动物分组与处理
动物适应性饲养1周后,随机分为6组(n=8):正常对照组、模型对照组、溶剂对照组,低、中、高剂量叶黄素组(25、50、100mg/kg)。叶黄素各剂量组灌胃给予相应浓度叶黄素,溶剂对照组以等体积玉米油灌胃,连续30d。灌胃结束后,将大鼠放入暗室中进行暗适应24h,除空白对照组外,其余各组放入光损伤装置中进行光暴露。光损伤工作参数为:LED蓝光灯带波长为452nm、光强为1 400~1 500lux、光暴露时间为1.5h,光暴露结束后将大鼠放回暗室中继续饲养,24h后处死、取眼球。
1.4 指标测定与方法
1.4.1 视网膜形态学观察 摘除眼球,放入4%多聚甲醛中进行固定。对固定后的眼球壁脱水,脱水后透明,接着将透明的大鼠眼球壁放入蜡缸中浸蜡,包埋蜡块,用石蜡切片机进行切片,每张片子厚度约为5μm,然后进行苏木素-伊红(HE)染色,40×10倍光学显微镜下观察视网膜结构和细胞形态变化。
1.4.2 大鼠血清氧化应激指标检测 按照试剂盒说明书进行大鼠血清SOD、GSH-Px水平及MDA、NO含量测定。
1.5 统计分析
用SPSS 25.0软件对数据进行统计分析。连续变量用±s表示,组间比较采用单因素方差分析,采用最小显著差异t检验法进行组间的两两比较,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 视网膜结构与视网膜外核层变化
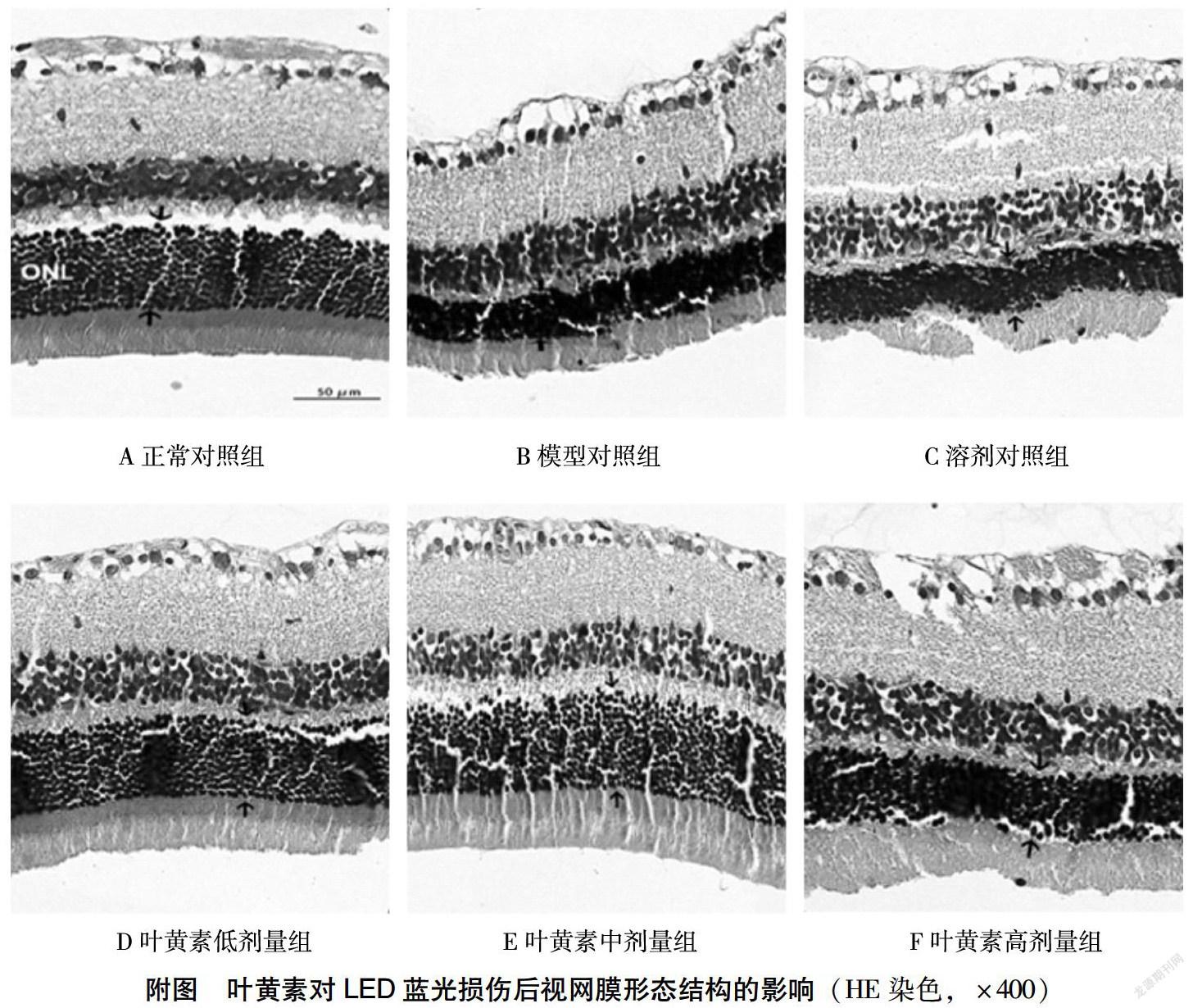
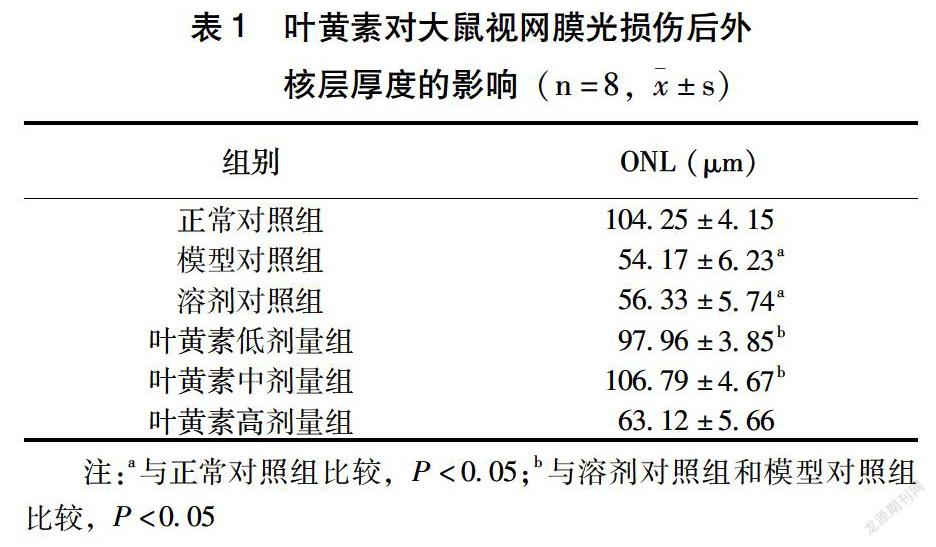
HE染色观察,正常对照组大鼠视网膜结构层次分明,视网膜内外节排列整齐,外核层(ONL)细胞核层次清楚,排列紧密(附图)。模型对照组和溶剂对照组大鼠视网膜ONL厚度显著降低(表1),且细胞核出现浓染(附图B、C)。叶黄素低剂量组和中剂量组大鼠与模型对照组比较,视网膜ONL厚度显著增加(表1),ONL细胞中未出现浓染(附图D、E)。而叶黄素高剂量组ONL厚度与模型对照组相比无明显差异(表1),ONL细胞核出现少许浓染(附图F)。
2.2 抗氧化指標检测结果
与正常对照组相比,大鼠接受LED蓝光损伤后,血清中脂质过氧化产物MDA的含量显著增加,GSH-Px含量显著降低(P<0.05)。与模型对照组和溶剂对照组相比,3个剂量叶黄素组血清中MDA含量显著减少(P<0.05),而GSH-Px含量显著增加(P<0.05),但叶黄素不同剂量组之间MDA和GSH-Px无显著差异(P>0.05);SOD、NO水平在各组间差异无显著性(表2)。
3 讨论
蓝光暴露是目前研究视网膜光损伤常见的造模方式,但既往有关视网膜光损伤的研究中,光源类型、强度、时间等很多均不一致,尚无公认的造模方式。成年大鼠和小鼠均可进行视网膜光损伤的研究。SD大鼠普遍用于营养实验,比Wistar大鼠的适应性和抗病能力更强。考虑到目前电子产品的广泛使用,采用LED蓝光暴露制备SD大鼠视网膜损伤模型[13]。预实验观察发现,LED蓝光强度为1 400~1 500lux、光照强度为1.5h时,大鼠视网膜电图出现明显变化,变化趋势稳定。因此本研究控制光照强度在1 400~1 500lux之间,结果显示,叶黄素每日25、50mg/(kg·d)灌胃预处理的大鼠,在LED蓝光照射后,视网膜ONL厚度未出现显著降低。未经叶黄素预处理的模型对照组与对照组相比,视网膜ONL厚度降低,且细胞核出现浓染。考虑到本研究所采用的溶剂为玉米油,为排除溶剂所带来的影响,加设了溶剂对照组。结果显示,溶剂对照组与模型对照组相比,大鼠视网膜形态学和ONL厚度均无显著差异,说明溶剂对大鼠视网膜光损伤无保护作用,进而证明叶黄素对大鼠视网膜光损伤保护作用的确切性。
本研究结果显示,叶黄素各剂量组大鼠血清中的MDA含量均低于模型对照组和溶剂对照组中的含量,这提示叶黄素可能是通过抑制大鼠视网膜的脂质过氧化反应来发挥其保护作用。MDA被广泛认为是光诱导的视网膜损伤中氧化应激的标志物。在人视网膜色素上皮细胞中,MDA由光反应性脂褐素颗粒产生,脂褐素颗粒产生H2O2和其他潜在的细胞毒性分子以作为对过度光照射的反应[14]。当前研究结果与徐贤荣等[15]的研究结果一致,其研究发现,大鼠玻璃体注射叶黄素能够通过降低视网膜中MDA含量而一定程度上预防蓝光暴露所诱导的视网膜损伤。此外,有研究表明,叶黄素对光损伤的保护作用还可能与调节细胞信号转导有关[16]。神经元型一氧化氮合酶(nNOS)在大鼠光损伤视网膜中表达增加[17]。现有研究显示,视网膜中nNOS介导NO的产生,其在高浓度时对视网膜细胞具有毒性作用[18]。在本研究中,大鼠视网膜光损伤后,血清中NO浓度有所增加,但是此种增加无统计学差异,叶黄素对各实验组血清中NO浓度无显著影响。同样徐贤荣等[15]在其研究中也报道,大鼠光损伤视网膜中nNOS的含量总量减少,但是差异无显著性;叶黄素对大鼠光损伤视网膜中nNOS无明显影响。
SOD和GSH-Px是体内重要的抗氧化酶类,与在其他组织一样,在视网膜中,SOD将超氧阴离子转化为过氧化氢,而GSH-Px则通过谷胱甘肽催化其还原形成水[19-20]。本研究结果显示,光损伤大鼠血清中SOD活性降低,这与之前研究一致[21-23]。Kamoshita等[24]发现,在光暴露24h时叶黄素可以抑制光损伤小鼠视网膜色素上皮细胞活性氧物质增加,并增强SOD活性;在48h时持续性的增加SOD1、SOD2 mRNA水平。然而在当前的研究中,血清中的SOD 浓度在各组间并无显著的差异,分析其原因可能是在当前的研究中测定的是血清中SOD活性,而非视网膜中SOD活性,可能只有在视网膜SOD活性达到一定程度的变化后,血清中才会出现相应变化。现有研究显示,在光诱导的氧化应激下,大鼠视网膜中GSH-Px活性降低或不变[21,25]。在当前研究中显示大鼠视网膜光损伤后血清中GSH-Px活性显著降低,其结果进一步说明,机体没有足够活性的氧化酶清除光损伤所产生的过多活性氧是光损伤的机制之一。本研究结果还表明,持续性的补充叶黄素显著增强了视网膜光损伤大鼠血清中的GSH-Px活性,有效防止了过度光暴露所导致的视网膜损伤。然而已有的体外研究报道,光暴露导致人视网膜色素上皮细胞中GSH-Px活性增加,而叶黄素则抑制了这种增加[20],分析其结果不一致的原因可能是:(1)已有报道的体外研究中所用到的暴露光源是太阳紫外线B,而当前研究中暴露光源是LED蓝光,光源的差异可能是其造成结果不一致的原因之一;(2)机体是一个复杂多变的系统,体外实验可能并不能模拟体内真实的复杂多变的情况,因此,酶抗氧化防御系统在视网膜光损伤中的作用机制以及叶黄素对该系统的影响还需要进一步的研究加以明确。
综上所述,叶黄素可通过抑制大鼠血清MDA水平升高,增加GSH-Px水平来发挥对视网膜LED蓝光损伤的保护作用。
参考文献
[1]Holzman D C. Whats in a color? The unique human health effect of blue light[J].Environ Health Perspect,2010,118(1):A22-27.
[2]Rosenfield M. Computer vision syndrome:a review of ocular causes and potential treatments[J].Ophthalmic Physiol Opt,2011,31(5):502-515.
[3]Wielgus A R,Collier R J,Martin E,et al.Blue light induced A2E oxidation in rat eyes--experimental animal model of dry AMD[J].Photochem Photobiol Sci,2010,9(11):1505-1512.
[4]Bernstein P S,Li B,Vachali P P,et al.Lutein,zeaxanthin,and meso-zeaxanthin:the basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease[J].Prog Retin Eye Res,2016,50:34-66.
[5]Junghans A,Sies H,Stahl W. Macular pigments lutein and zeaxanthin as blue light filters studied in liposomes[J].Arch Biochem Biophys,2001,391(2):160-164.
[6]Thomson L R,Toyoda Y,Delori F C,et al. Long term dietary supplementation with zeaxanthin reduces photoreceptor death in light-damaged Japanese quail[J].Exp Eye Res,2002,75(5):529-542.
[7]Barker F M,2nd,Snodderly D M,Johnson E J,et al. Nutritional manipulation of primate retinas,V:effects of lutein,zeaxanthin,and n-3 fatty acids on retinal sensitivity to blue-light-induced damage[J].Invest Ophthalmol Vis Sci,2011,52(7):3934-3942.
[8]Bian Q,Gao S,Zhou J,et al. Lutein and zeaxanthin supplementation reduces photooxidative damage and modulates the expression of inflammation-related genes in retinal pigment epithelial cells[J].Free Radic Biol Med,2012,53(6):1298-1307.
[9]Sangiovanni J P,Neuringer M. The putative role of lutein and zeaxanthin as protective agents against age-related macular degeneration:promise of molecular genetics for guiding mechanistic and translational research in the field[J].Am J Clin Nutr,2012,96(5):1223s-1233s.
[10]Sasaki M,Ozawa Y,Kurihara T,et al. Neurodegenerative influence of oxidative stress in the retina of a murine model of diabetes[J].Diabetologia,2010,53(5):971-979.
[11]Li S Y,Fu Z J,Ma H,et al. Effect of lutein on retinal neurons and oxidative stress in a model of acute retinal ischemia/reperfusion[J].Invest Ophthalmol Vis Sci,2009,50(2):836-843.
[12]Sasaki M,Yuki K,Kurihara T,et al. Biological role of lutein in the light-induced retinal degeneration[J].J Nutr Biochem,2012,23(5):423-429.
[13]Jaadane I,Boulenguez P,Chahory S,et al. Retinal damage induced by commercial light emitting diodes (LEDs)[J].Free Radic Biol Med,2015,84:373-384.
[14]Rozanowska M,Jarvis-Evans J,Korytowski W,et al. Blue light-induced reactivity of retinal age pigment. In vitro generation of oxygen-reactive species[J].J Biol Chem,1995,270(32):18825-18830.
[15]徐賢荣,林晓明. 叶黄素对大鼠视网膜蓝光损伤防护作用机制研究[J].卫生研究,2010,39(6):689-692.
[16]Chucair A J,Rotstein N P,Sangiovanni J P,et al. Lutein and zeaxanthin protect photoreceptors from apoptosis induced by oxidative stress:relation with docosahexaenoic acid[J].Invest Ophthalmol Vis Sci,2007,48(11):5168-5177.
[17]Donovan M,Carmody R J,Cotter T G. Light-induced photoreceptor apoptosis in vivo requires neuronal nitric-oxide synthase and guanylate cyclase activity and is caspase-3-independent[J].J Biol Chem,2001,276(25):23000-23008.
[18]Oku H,Yamaguchi H,Sugiyama T,et al. Retinal toxicity of nitric oxide released by administration of a nitric oxide donor in the albino rabbit[J].Invest Ophthalmol Vis Sci,1997,38(12):2540-2544.
[19]Jarrett S G,Boulton M E. Consequences of oxidative stress in age-related macular degeneration[J].Mol Aspects Med,2012,33(4):399-417.
[20]Aimjongjun S,Sutheerawattananonda M,Limpeanchob N. Silk lutein extract and its combination with vitamin E reduce UVB-mediated oxidative damage to retinal pigment epithelial cells[J].J Photochem Photobiol B,2013,124:34-41.
[21]Xie Z,Wu X,Gong Y,et al. Intraperitoneal injection of Ginkgo biloba extract enhances antioxidation ability of retina and protects photoreceptors after light-induced retinal damage in rats[J].Curr Eye Res,2007,32(5):471-479.
[22]Yamashita H,Horie K,Yamamoto T,et al. Light-induced retinal damage in mice. Hydrogen peroxide production and superoxide dismutase activity in retina[J].Retina,1992,12(1):59-66.
[23]Baksheeva V E,Tiulina V V,Tikhomirova N K,et al. Suppression of light-induced oxidative stress in the retina by mitochondria-targeted antioxidant[J].Antioxidants (Basel),2018,8(1):1-17.
[24]Kamoshita M,Toda E,Osada H,et al. Lutein acts via multiple antioxidant pathways in the photo-stressed retina[J].Sci Rep,2016(6):30226.
[25]Ohira A,Tanito M,Kaidzu S,et al. Glutathione peroxidase induced in rat retinas to counteract photic injury[J].Invest Ophthalmol Vis Sci,2003,44(3):1230-1236.
[26]杨琳娟,张秀丽,梁滨. 大学生叶黄素摄入水平与视疲劳相关症状的研究[J].中国食物与营养,2019,25(6):87-89.
Abstract:ObjectiveTo investigate the effect of lutein on retinal damage induced by blue light emitting diodes (LEDs)in rats.MethodForty-eight male Sprague-Dawly (SD)rats (6 weeks old,180 to 220g)were randomly assigned to 6 groups,including a normal,a model,a solvent and three lutein groups (25,50,100mg/kg). Corn oil was used as solvent to dissolve lutein. Before the light exposure,the rats were dark-adapted by keeping them in complete darkness for 24h after lutein supplementing for 30 days. Then,apart from the normal group all the pupils were exposed to 1 400~1 500 lux of blue LEDs for 1.5 h. After that the rats were killed,the eyes were removed and were processed to paraffin section for microscopy,then we observed the changes of retina morphous. The content of serum glutathione peroxidase (GSH-Px),superoxide dismutase (SOD),malondialdehyde (MDA),and nitric oxide (NO)were measured using oxidative stress kit. ResultThe thickness of outer nuclear layer (ONL)in model control group and solvent control group decreased significantly compared with the normal group. Compared with the model control group,the thickness of the ONL was increased in low and middle lutein groups. The content of serum MDA increased in the rats induced by photic injury and the increase was inhibited significantly in lutein groups (P<0.05),but no dose-dependent respondence. Compared with those of the normal group,the serum GSH-Px level of the model and solvent groups was reduced (P<0.05),while the GSH-Px was significantly increased in all lutein groups (P<0.05). The levels of NO and SOD were not significantly changed in all groups (P<0.05 and P<0.05,respectively).ConclusionIn the present study,the effect of prevention of lutein on retina blue LED-light damaged was significant. The mechanisms of lutein protecting retina from blue LED-light damage might be associated with quenching singlet oxygen,inhibiting lipid peroxidation.
Keywords:blue LED-light;retina;lutein
(責任编辑 李婷婷)

