溶质的质量分数题型归纳
洪兹田


溶质的质量分数的相关计算是每年中考的热点,主要包括基础小计算和综合大计算两种类型,现针对这两种类型举例分析如下。
一、基础小计算
溶质的质量分数的基础计算包括:利用溶质的质量分数公式进行溶质、溶剂、溶液的互算;溶液的稀释和浓缩的计算;结合配制一定溶质的质量分数溶液实验的计算;结合溶解度的溶质的质量分数的计算等。
例1(2019·浙江·湖州)配制500 g7.3%的稀盐酸,需要36.5%的浓盐酸 g。
解析:500 g×7.3% = m(浓)×36.5%,解得m(浓) = = 100 g。
答案:100
点评:根据溶液稀释过程中溶质的质量不变,即m(浓)·w(浓) = m(稀)·w(稀),可求出相关未知量。
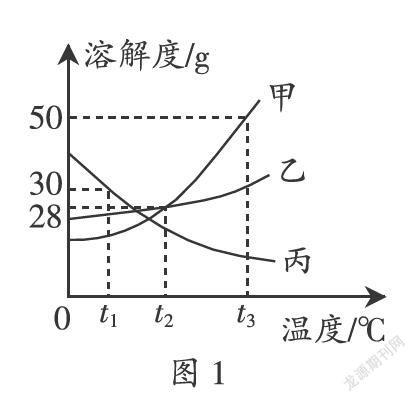
例2(2019·山东·菏泽)溶液与人们的生产生活密切相关,图1为甲、乙、丙三种固体物质的溶解度曲线。
(1)t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是 。
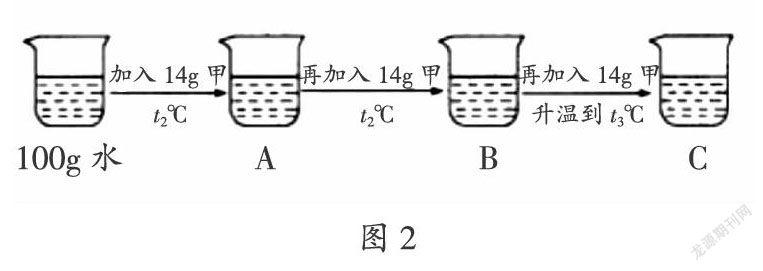
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C三种溶液,其中属于饱和溶液的是
(填字母)。
(3)t3℃时向盛有40 g甲物质的烧杯中加入50 g水充分溶解后,所得溶液溶质的质量分数为
。(结果精确到0.1%)
解析:(1)由溶解度曲线可知,在t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是:丙>乙>甲;(2)t2℃时甲物质的溶解度是28 g,即100 g水中最多可溶解28 g甲物质,所以B溶液是饱和溶液;t3℃时甲物质的溶解度是50 g,即100 g水中最多可溶解50 g甲物质,C溶液中含有溶质的质量是42 g,所以C溶液是不饱和溶液;(3)t3℃时甲物质的溶解度是50 g,50 g水中最多可溶解25 g甲物质,所得溶液溶质的质量分数为:×100% ≈ 33.3%。
答案:(1)丙>乙>甲 (2)B (3)33.3%
点评:本题综合考查了溶解度曲线的意义以及溶质的质量分数公式的计算,熟练掌握相应知识是解决本题的关键。
二、综合大计算
综合大计算通常涉及与化学方程式结合的综合计算。在溶液中进行的反应,往往是其中的溶质参加反应,所以在根据化学方程式列出有关反应物、生成物的质量比时,要用溶质的质量列比例,而不能直接用溶液的质量或体积列比例。
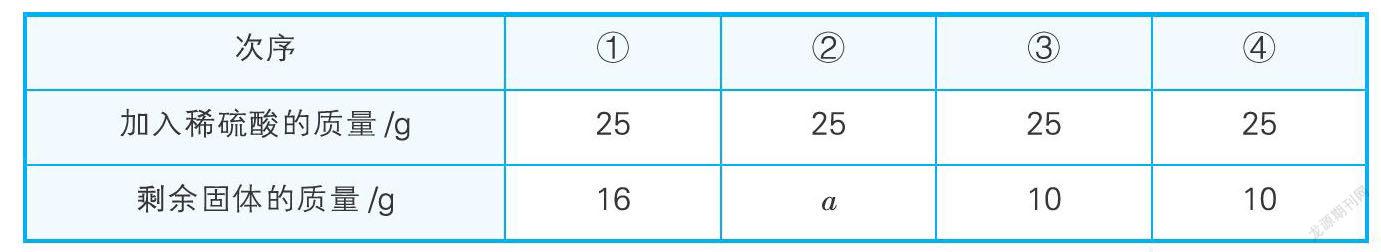
例3(2019·贵州·黔西南)为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20 g固体混合物置于烧杯中,将100 g稀硫酸分为四等份依次加入其中进行实验,测得数据如下,回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 ,实验③所得溶液中的溶质是 (填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
解析:根据第一次固体减少4 g,而第三次后質量不变,说明第二次也减少4 g,所以a = 12。第三次氧化铜完全反应,剩余的10 g为铜单质,所以氧化铜的质量为:20 g - 10 g = 10 g,原固体混合物中,氧化铜的质量分数为:×100%=50%。实验③中稀硫酸过量,所以所得溶液中的溶质是剩余的稀硫酸和生成的硫酸铜,对应的化学式为:H2SO4、CuSO4。根据25 g稀硫酸与4 g氧化铜完全反应可求稀硫酸中溶质的质量分数,设该实验所用稀硫酸中溶质的质量分数为x,
CuO + H2SO4 CuSO4 + H2O
80 98
4 g 25 g × x
=
解得x = 19.6%
答案:(1)50% (2)12 H2SO4、CuSO4 (3)19.6%
点评:根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。

