人参茎叶总皂苷对大鼠MNU所致视网膜色素变性的作用
侯阳,刘学政
(1.锦州医科大学生命科学研究院;2.锦州医科大学人体解剖学教研室,辽宁 锦州 121000)
视网膜色素变性(retinitis pigmentosa,RP)是一种具有代表性的退行性视网膜变性疾病。即患者最终都会因视网膜感光细胞死亡而致视功能下降甚至完全丧失。RP已成为发达国家主要的致盲性眼病。患病率约0.03%。目前主要治疗方法为药物治疗、视网膜色素上皮移植以及新近展开研究的基因治疗,但对RP的临床治疗效果仍不理想。N-甲基-N-亚硝基脲(MNU) 属于亚硝基化合物中的亚硝酸胺类,是广泛分布于环境中的强烷化剂。烷化剂对细胞DNA的损伤如果没有被修复,则细胞将发生凋亡。由于MNU诱导的感光细胞损害具有高度的可重复性,这种动物模型成为研究人类视网膜变性治疗措施的有用工具。前期很多实验证实人参皂苷单体对神经细胞和视神经损伤有保护作用[1-4]。本课题探讨人参茎叶总皂苷对大鼠MNU所致RP的作用及机制。
1 仪器与材料
1.1 药品与试剂
MNU(Sigma公司)、生理盐水(沈阳志鹰制药厂)、Beclin-1和LC3抗体(武汉博士德生物工程有限公司)、食用色素(上海狮头牌)。
1.2 实验动物
SPF级SD大鼠30只,100~120 g,雌雄各半,由北京华阜康生物技术有限公司提供,合格证号SCXK(京)。
1.3 仪器
Morris水迷宫由上海欣软信息科技有限公司生产,光学显微镜(OLYMPUS,BX60,Japan),视觉电生理检测仪(重庆康华公司,YT 2B),流式细胞仪。
2 方 法
2.1 动物分组及给药
SD大鼠分3组,即空白对照组、模型组及治疗组。模型制备参考文献[5],空白对照组腹腔注射生理盐水后作为对照。模型组腹腔注射MNU 60 mg/kg;治疗组在MNU 60 mg/kg腹腔注射1次,治疗组连续7 d灌胃人参茎叶总皂苷50 mg/kg。
2.2 视觉电生理检测
闪光视网膜电图检测(flashelectroretinogram,ERG) 具体步骤,参照文献[5]2689-2702。动物检查前暗适应过夜,10%水合氯醛腹腔注射麻醉,0.5%托吡卡胺滴眼液点眼散瞳,ERG接地电极为针型电极,埋植于大鼠耳垂;参考电极也为针型电极,埋植于大鼠下唇;所有操作均在微弱的红灯下暗室进行。记录a和b波振幅及峰值期,a波振幅是从基线到a波波谷的电位值,a波峰值期为从光刺激开始至a波的波峰时间;b波为a波波谷到b波波峰的电位值,b波峰值期为从光刺激开始至b波的波峰时间,振幅的单位为微伏(μV),峰值期的单位为毫秒(ms)。
2.3 光镜形态学观察
实验结束,处死大鼠,取眼球,固定,石蜡包埋前,剪开角膜,取视网膜。常规脱水、浸蜡、切片,苏木素-伊红(HE)染色,拍照。
2.4 行为学实验Morris水迷宫测试
参照文献[6],Morris水迷宫由圆形水池和自动录像仪及分析系统两部分组成。圆形水池直径160 cm、高55 cm,内壁及底为黑色,站台直径9 cm,高度在20~35 cm之间调节。图像采集卡:可存储为AVI,图象分辨率可达640 pix×480 pix,采集频率1~25帧/秒可调。水温(22±1)℃,水中加入黑色无毒食用色素,首先进行训练,水中不放站台。训练后再进行2次水池中放有站台的训练,站台高出水面2 cm。站台所在象限有一圆形标志物,该标志物高出水面1.5 cm。训练中如果在规定的最长时间120 s内未到达站台,则由实验者将其引至站台,使大鼠在站台停留15 s。检测实验由4次试验组成,大鼠在站台停留15 s后进行下一轮测试。120 s内未找到站台逃避潜伏期则记为120 s,观察并记录动物找到并爬上站台的潜伏期、总时间、路程、速度。
2.5 检测Beclin-1和LC3蛋白的表达
参考文献[7],取视网膜,常规组织处理方法,剪碎、匀浆、吹散,过滤后,离心。按照说明书,加入一抗、洗涤、二抗,PBS洗涤。流式细胞仪检测Beclin-1和LC3蛋白的表达。
2.6 统计学方法
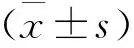
3 结 果
3.1 人参茎叶总皂苷对MNU所诱导大鼠RP的视觉电生理(FERG)和光镜下形态学的影响
各组大鼠视网膜电图见图1。空白对照组均可记录到典型的ERG波形,a、b波振幅明显;MNU组大鼠a、b波振幅基本消失,与NC组比较差异显著;治疗组大鼠a、b波振幅出现,与MNU组比较明显改善,有显著性差异。结果提示尼莫地平可拮抗MNU所诱导大鼠RP视功能的下降。
光镜下形态学比较:结果显示NC组大鼠视网膜外核层细胞排列密集整齐;MNU组大鼠外核层细胞明显减少,治疗组较模型组比较,外核层细胞数目明显增加,排列紧密。
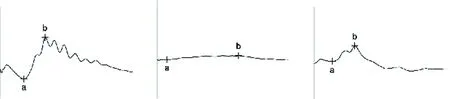
空白对照组ERG 模型组ERG 治疗组ERG

空白对照组视网膜HE 模型组视网膜HE 治疗组视网膜HE
3.2 治疗组对MNU诱导视网膜变性大鼠Morris水迷宫试验
模型组潜伏期、总时间、路程、速度明显低于空白对照组,行为学的变化表明给予MNU后视功能改变;治疗组与模型组比较总时间、潜伏期、路程、速度低于模型组。表明参茎叶总皂苷对MNU诱导视网膜变性大鼠视功能显著改善作用,见图2、表1。

空白对照组大鼠运动轨迹 模型组大鼠运动轨迹 治疗组大鼠运动轨迹

表2 人参茎叶总皂苷对MNU诱导视网膜变性大鼠Morris水迷宫试验
3.3 人参茎叶总皂苷对MNU所诱导大鼠RP的Beclin-1和LC3蛋白的影响
模型组与对照组比较,细胞Beclin-1和LC3阳性表达率增高;治疗组与模型组比较Beclin-1 和LC3阳性表达率降低,见图3。
Beclin-1
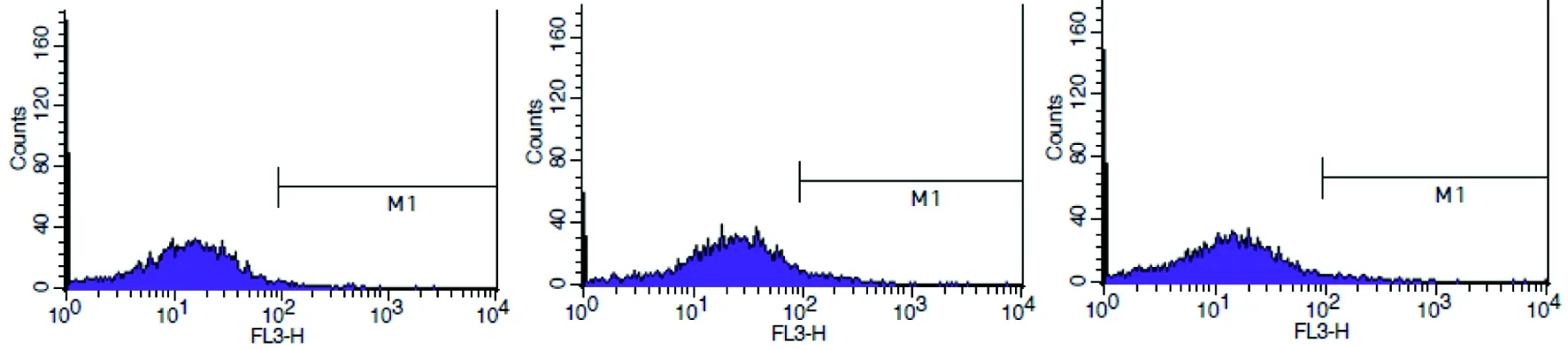
空白对照组 模型组 治疗组
LC3

阳性表达率为29.0% 阳性表达率为67.3% 阳性表达率为40.0%
4 讨 论
ERG被认为是检测由神经退行性疾病引起的视觉通路异常的最有用的神经生理学技术[8]。虽然ERG的确切起源还不清楚,但它似乎是由内层产生的中央视网膜(神经节细胞及其轴突)[9],因此,它反映了视网膜神经纤维层异常。本研究显示,模型组大鼠ERG信号明显减弱,表明视锥细胞感光功能逐渐丧失,与文献一致[10]。
单次全身给药MNU可减少外核层厚度,降低ERG反应,诱导光受体细胞死亡,所有这些都是视网膜变性的标志,类似于RP的特征症状[11]。在此,我们利用MNU诱导的RP大鼠模型与文献相同,模型组视网膜外核层明显受损伤。本研究表明人参茎叶总皂苷对MNU诱导视网膜变性大鼠视功能和形态学显著改善作用。
Morris水迷宫实验中定点航行实验能够反映动物空间记忆学习形成和再获得的能力。空间探索实验则能够评价动物空间定位能力,证明了视力是影响水迷宫实验结果的非认知能力之一。水迷宫成绩好坏与色素变性严重程度即视网膜光感受器的存活数量存在相关性,且室内非对称环境对其也有重要影响。采用Morris水迷宫实验,对受视觉功能进行评估[6]50-63。本试验结果显示空白对照组潜伏期、总时间、路程明显高于模型组,速度没有明显变化,行为学的变化表明给予MNU后视功能改变但不改变其运动。治疗组与模型组比较潜伏期、总时间、路程低于模型组,速度没有明显变化,表明人参茎叶总皂苷对MNU诱导视网膜变性大鼠视功能显著改善作用。综合视功能和形态学结果,本研究提示人参茎叶总皂苷对MNU诱导RP大鼠有改善作用。
自噬在神经元存活、清除神经系统中的衰老细胞器和错误折叠蛋白以及保护神经元方面起着关键作用,Beclin-1作为一个键自噬调节因子,调节自噬小体的形成[12]。LC3也是自噬的一个标志。自噬主要发生在视网膜神经节细胞和Muller细胞,神经损伤后视网膜神经节细胞凋亡可能与自噬激活有关[13]。
在MNU诱导的光感受器细胞死亡过程中,通过抑制PI3K/mTOR通路激活自噬[14]。本研究中我们观察人参茎叶总皂苷对AD所致家兔肺Beclin-1和LC3的影响,结果提示人参茎叶总皂苷对MNU诱导RP大鼠有保护作用,其机制可能与抑制Beclin-1和LC3蛋白表达有关。
综上所述,本研究通过动物模型实验探讨人参茎叶总皂苷对MNU诱导RP大鼠的作用及可能Beclin-1和LC3的影响。结果显示,人参茎叶总皂苷对MNU诱导RP大鼠具有改善作用,并且可能与抑制Beclin-1和LC3有关。

