氨磺必利对精分患者的治疗效果及对PRL、糖代谢水平的影响
郑鸿伟,王灵君,刘光伟,张亚莉,邓巧恩,乔德峰 ,刘惠敏
(1.石家庄市第八医院 精神科, 石家庄 050081;2. 联勤保障部队第九八O医院呼吸科,石家庄 050081)
流行病学研究表明,我国部分地区2010~2017年精神分裂症的发病率可维持在374~584/1万人左右[1]。临床上精神分裂症的发生,能够导致患者生活质量的下降,提高了患者的致残率[2,3]。对于首发精神分裂症患者,往往通过采用利培酮进而改善精神分裂症患者的阳性或者阴性症状。长期的临床随访观察研究发现,利培酮虽然能够抑制精神分裂症患者的病情进展,提高疾病的总体治疗有效率,但利培酮单独治疗后患者的锥体外系的反应仍然较为明显,治疗后的精神系统的评分改善仍然较为局限[4,5]。氨磺必利是非典型性的抗精神病性药物,其能够通过拮抗前额叶突触前受体和突触后受体,阻断D2及D3受体的激活程度,进而辅助改善多巴胺能递质的传递,提高精神分裂症的治疗效果[6]。部分研究者探讨了氨磺必利辅助治疗首发精神分裂症的临床效果,认为氨磺必利能够提高疾病的治疗有效率[7],但对于治疗后的催乳素或者血糖代谢相关指标的分析研究不足。为了指导临床上精神分裂症的治疗,本次研究选取我院2016年1月~2017年4月收治的90例首发精神分裂症患者,探讨了氨磺必利、利培酮治疗首发精神分裂症的临床效果及对催乳素水平和血糖代谢的影响,报道如下。
1 资料与方法
1.1 临床资料选取我院2016年1月~2017年4月收治的90例首发精神分裂症患者,采用随机数字表法分为观察组、对照组各45例。
观察组,年龄20~59岁,平均为39.3±11.0岁,男17例、女28例,体质量指数(BMI)22.9±2.8kg/m2,治疗前PANSS总分86.3±8.2分。对照组,年龄20~59岁,平均为40.7±12.6岁,男15例、女30例,体质量指数(BMI)23.1±3.3kg/m2,治疗前PANSS 总分85.8±7.6分。两组患者的年龄、性别、BMI、PANSS评分比较,差异不具有统计学意义(P>0.05)。
纳入标准:(1)精神分裂症患者的诊断参考中国精神疾病分类方案与诊断标准第三版(CCMD-3)中的标准;(2)年龄≥19岁且≤59岁;(3)患者入组前未服用任何抗精神病药物,均为首发患者;(4)与研究对象签署知情同意书。
排除标准:(1)脑血管病史;(2)癫痫病史、休克病史 ;(3)文盲 ;(4)听说功能障碍 ;(5)合并严重的肝肾功能疾病、免疫性疾病、感染性疾病等;(6)存在严重的抑郁或躁狂;(7)妊娠及哺乳期妇女。
1.2 治疗方法观察组:口服氨磺必利(批号为:0805001 齐鲁制药公司),初始剂量100mg,之后根据患者的症状逐渐增加至300~600mg/d左右,口服,每日1次,连续治疗8w;对照组:口服利培酮(批号:100570-200401 西安杨森制药有限公司),初始剂量1mg,每日1次,之后根据患者的症状逐渐增加至3~6mg/d,连续治疗8w。
1.3 观察指标及检测方法对比两组患者治疗前后的阳性阴性症状量表(PANSS)评分、血清PRL、空腹血糖(FPG)、餐后2h血糖(2hPG)、空腹胰岛素(Fins)、胰岛素抵抗指数(HOMA-IR)及临床疗效。
PANSS量表,该量表包含了7项阳性症状条目、7项阴性症状条目、一般精神病理症状16项、3个补充项目。临床疗效评价主要根据治疗前后患者的PANSS减分率进行评估:减分率=(治疗前-治疗后)/治疗前×100%,减分率超过75%为痊愈、减分率超过50%为显效、减分率超过25%为进步、减分率不足25为无效。
胰岛素抵抗指数的计算(稳态模型评估:HOMA-IR=FBG×Fins/22.5)。
采集入院后静脉血,1000r/min离心5min,离心半径10cm,离心后收集上清液,采用电化学发光法检测PRL水平,检测仪器为美国Bio-Bad全自动酶标仪,配套试剂盒购自南京博奥生物检测公司;收集上清液后加入采用全自动生化法检测FPG、2hPG、Fins值,加入FPG、Fins检测试剂盒,配套试剂盒购自南京碧云天生物检测公司,微型离心机HITETIC购自上海精密仪器有限公司。
1.4 统计学方法计量数据表述采用mean±SD表示,组间比较采用t检验、重复测量的单因素方差分析法;计数资料采用χ2检验、非参数检验;P值<0.05说明差异有统计学意义,统计软件采用SPSS 16.0版本。
2 结果
2.1 两组患者的PANSS总分比较治疗前,两组患者的PANSS总分差异不具有统计学意义(P>0.05);治疗4周、治疗8周后,两组患者的PANSS总分较治疗前显著的降低(P<0.05),观察组患者的PANSS总分均低于对照组(P<0.05)(表1)。
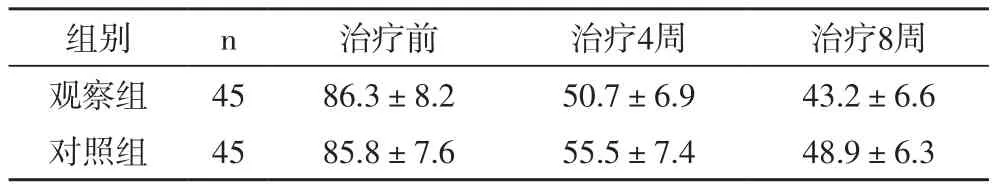
表1 两组患者的PANSS总分比较(分)
2.2 两组患者的血清PRL及糖代谢指标比较治疗前,两组患者的血清PRL、FPG、2hPG、Fins、HOMA-IR测定值差异不具有统计学意义(P>0.05);治疗8周后,观察组患者的PRL、FPG、2hPG、Fins、HOMA-IR测定值均低于对照组(P<0.05)(表2)。
2.3 两组患者的临床疗效差异比较治疗8周后,观察组患者的临床疗效优于对照组(P<0.05)(表3)。
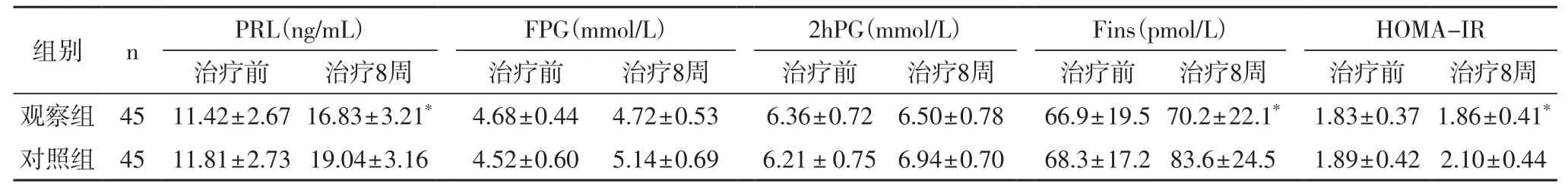
表2 两组患者的血清PRL及糖代谢指标比较

表3 两组患者的治疗效果比较[n(%)]
3 讨论
情感应激、遗传易感基因的携带或者精神创伤,均能够促进精神分裂症的发生,特别是在具有精神性疾病家族史的患者中,精神分裂症的发生率可进一步的提高[8]。临床上精神分裂症的发生,不仅能够导致患者脑功能的障碍,还能够提高致残率,严重影响患者的生活质量[9,10]。利培酮能够通过与5-羟色胺及多巴胺受体的结合,进而调节边缘系统多巴胺能神经元的电冲动活性,进而改善精神分裂症患者的临床症状[11,12]。但一项囊括了204例样本量的精神分裂症患者的临床治疗分析研究可见,利培酮治疗精神分裂症后患者的病情进展率仍然较高,治疗后的体内PRL或者空腹血糖代谢紊乱的风险仍然超过了5%以上,严重影响到了患者的远期生存结局[13]。而本次研究对于氨磺必利的治疗分析研究,能够为临床上精神分裂症的治疗提供现实方面的参考。
氨磺必利能够通过对于脑组织神经元细胞膜上多巴胺D2、D3受体的结合,进而影响前额叶多巴胺能神经元的兴奋程度,改善精神分裂症患者的阳性症状;氨磺必利对于脑组织边缘系统的D2、D3受体的影响,能够降低边缘系统多巴胺神经元的兴奋性,进而改善精神分裂症患者的阴性症状。基础方面的研究还认为,氨磺必利还能够改善神经元电冲动传递的完整性和基础节律性,改善患者的抑郁症状。部分研究者探讨了氨磺必利治疗精神分裂症的临床效果,认为氨磺必利能够在减轻患者脑功能症状的同时,降低锥体外系反应程度[14],但对于PRL或者空腹血糖(FPG)、餐后h血糖(2hPG)、空腹胰岛素水平(Fins)或者胰岛素抵抗程度(HOMA-IR)的分析研究不足。
阳性阴性症状量表(PANSS)评分是评估精神分裂症患者症状严重程度的指标,两组患者治疗后PANSS评分均明显的下降,低于对照组,差异较为明显,提示了氨磺必利能够进一步改善精神分裂症的症状,促进患者阳性和阴性症状的消退。通过分析探讨不同的临床文献,笔者认为这主要由于氨磺必利的下列几个方面的药理性作用有关:(1)氨磺必利能够通过影响到变异系统的D3受体的激活程度,进而在降低锥体外系反应的同时,抑制多巴胺能神经元,进一步改善患者的阴性症状;(2)氨磺必利作为苯胺替代物类精神抑制药,对于突触前 D2/D3多巴胺能受体的阻断效能更明显,特异性阻断的效果更好。朱庆等[15]研究者也认为,氨磺必利治疗精神分裂症患者后,患者的PANSS评分可平均下降25%以上,特别是在氨磺必利治疗周期较长或者初始治疗剂量较高的患者中,氨磺必利治疗后患者的阳性或者阴性症状的改善程度更为明显。PRL、FPG、2hPG、Fins、HOMA-IR等的上升是抗精神分裂症药物的主要不良反应,其中PRL的上升能够导致男性乳腺发育、女性不泌乳或者不孕的发生,而血糖的上升能够增加糖耐量异常的风险,导致糖尿病发病风险的上升,观察组患者采用氨磺必利治疗后,患者的PRL及血糖或者胰岛素抵抗指标均明显的下降,低于利培酮治疗组,差异较为明显,提示了氨磺必利能够显著改善患者的PRL及血糖代谢情况,减轻抗精神分裂药物治疗的副反应程度,这主要由于氨磺必利对于多巴胺受体的靶向性抑制程度较高,而对于胃肠道黏膜上皮肾上腺素能受体或者血清素能受体的影响较小,避免了其对于RPL及血糖代谢的影响。最后,本次研究发现氨磺必利治疗后的观察组患者的临床效果明显优于对照组,差异较为明显,进一步提示了氨磺必利在辅助治疗精神分裂症患者中的作用。
本次研究的创新性在于探讨了氨磺必利治疗后患者体内的PRL及血糖代谢情况。综上所述,氨磺必利能够有效辅助治疗首发精神分裂症,其能够在提高疾病治疗效果的同时,减轻对于催乳素和血糖代谢的影响,安全性更为明显。

