解淀粉芽孢杆菌YP6 对三种贝壳粉的促磷研究
孟 迪, 张力元, 江 威, 杨小凤, 廖祥儒*
(1. 江南大学 生物工程学院, 江苏 无锡214122;2. 江南大学 工业生物技术教育部重点实验室, 江苏 无锡214122)
磷是一种重要的不可再生资源,在植物生长发育过程中起着不可缺少的作用[1]。 但磷大多以不可溶形式存在于土壤中,无法满足植物生长对磷的需求,农业生产中通常采用追加磷肥的方法来补足土壤中的磷。 然而磷肥一经施放到土壤中,很容易被土壤中的金属离子固定化,变成难溶状态,使磷肥中的磷素难以发挥到最高利用价值。 研究表明,磷肥施用后仅一部分可溶磷(20%~30%)被植物吸收,绝大部分磷肥由于土壤的固定化无法被植物利用,造成了磷资源的极大浪费[2]。 因此提高土壤中难溶磷物质的利用效率, 缓解磷资源危机具有重要意义,同时也是推进“资源节约型,环境友好型”社会的必然要求。
贝壳属于天然矿物材料, 主要成分为碳酸钙(95%),其余为有机质(钙、镁、锌、铁、磷等)[3]。 根据《2013年中国渔业统计年鉴》,2012年全国贝类总产量为1208.44 万吨,江苏产量为68.2 万吨,占江苏水产总产量75.4%[4]。 在贝类丰产地区,大量的贝壳由于降解周期长, 没有得到合适处理而大量堆积,不仅占用土地资源。 同时由于贝壳有机质腐烂,造成了一系列的环境污染[5]。 传统处理贝壳资源的方法是将贝壳粉作为一种重要的钙源,建筑填充材料,污染处理材料以及催化介质[6],但存在加工成本及运输成本过高的缺点,且贝类资源丰富,应积极开发新用途。 因此,如何合理地利用贝壳资源,提高贝壳资源利用率和性价比,减少贝壳对于环境造成的污染等问题亟待解决。 研究表明将贝壳资源作为土壤改良剂日益得到重视,其加入土壤后的主要作用为调节pH,提高微生物的生理性能,并有一定的去除重金属离子的作用[7]。
基于磷消耗量增长以及全球磷源储备的日益缺乏,开发新的磷源物质尤为重要。 近年来,利用解磷微生物的生物方法逐渐被研究[8]。 解磷菌是一类能促进不溶磷物质转化为可被植物吸收利用的可溶磷物质的微生物,在提高植物对磷的吸收和作物增产中具有重要作用[9]。 关于解磷微生物的研究,目前主要集中在芽孢杆菌属 (Bacillus), 假单胞菌属(Pseudomonas), 青 霉 属 (Penicillium), 曲 霉 属(Aspergillus) 等[9]。 如Bacillus megateriumA6[10],Pseudomonas putidaGR12-2[11],Aspergillus Niger[12],Streptomycessp. CTM396[13]对含磷物质均表现出显著的溶磷作用。
为进一步丰富解磷微生物的种类,提高土壤中难溶磷物质的利用率。 作者从贵州磷矿上生长的植物根际,筛选得到一株高效解磷的解淀粉芽孢杆菌Bacillus amyloliquefaciensYP6,对其进行16S rRNA鉴定, 并探究YP6 的部分促生特性。 首次考察了YP6 菌株对贝壳粉及土壤的溶磷作用,为提供一种新型微生物磷肥提供理论依据。
1 材料与方法
1.1 实验材料
贵州磷矿上生长的植物。 贝壳粉(牡蛎粉,生蚝粉,蛤蜊粉)均来自浙江台州(表1)。 细菌基因组提取试剂盒, 购自上海生工公司;16S rRNA 基因测序由上海生工完成。 其他试剂为国产分析纯。
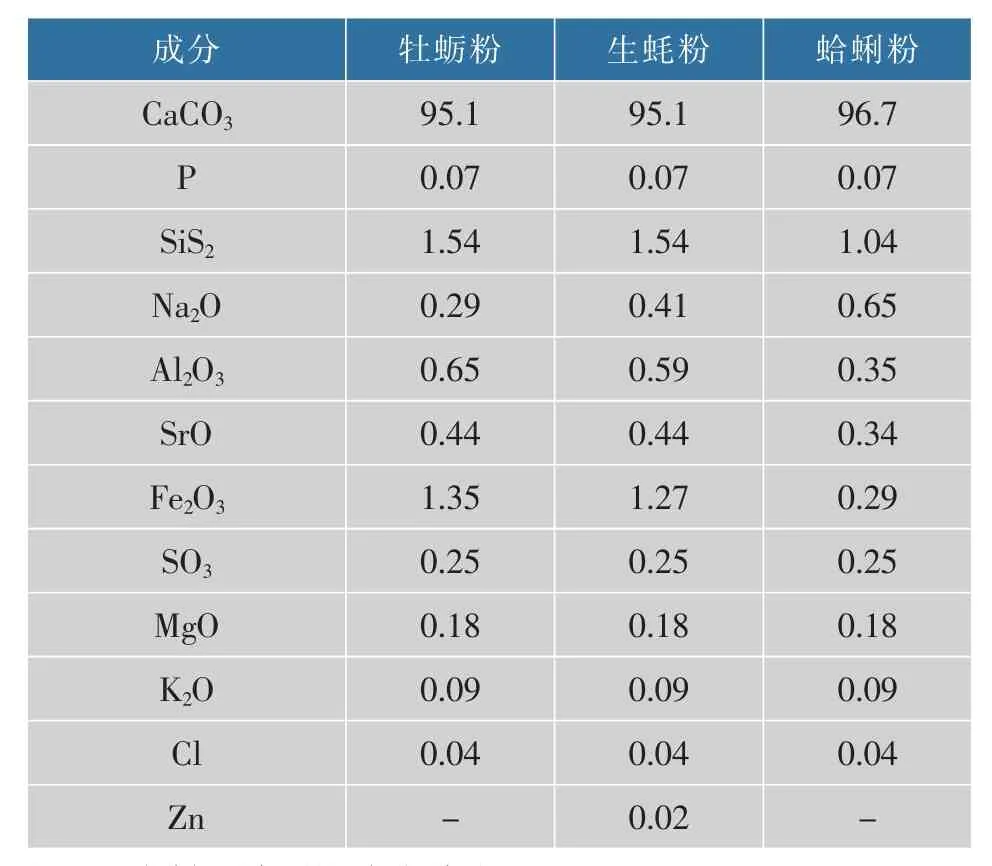
表1 3 种贝壳粉中无机组分质量分数Table 1 Inorganic components and contents in three shell powders %
1.2 菌株的筛选
植物根经过修剪, 加入三角瓶用无菌水震荡,稀释后,涂布在无机磷固体培养基(葡萄糖10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·7H2O 0.03 g,MgSO4·7H2O 0.3 g,羟基磷灰石10 g,酵母粉0.4 g,琼脂20 g;pH 7.0)平板上30 ℃培养2 d,挑选产明显透明圈的菌株并用甘油管保存,在以质量浓度2 g/dL 磷矿粉为磷源的无机磷液态培养基中,30 ℃、200 r/min,培养2 d。以不接种菌株的培养基为对照,用钼酸铵比色法[14]检测样品中有效磷的质量浓度,并根据该方法绘制标准曲线。 菌株进行复筛后,提取解磷能力最高菌株的16S rRNA 进行菌种鉴定, 提交NCBI 比对, 并用MEGA 5.0 软件绘制系统进化树。
1.3 菌株的促生能力
菌株在含有2 g/dL 磷矿粉的LB 液体培养基中,30 ℃、200 r/min,培养1~5 d,以不加菌株的样品为对照,每天取样,分别检测样品中有效磷增加量,磷酸酯酶活性(磷酸苯二钠比色法[15]),生长素质量浓度[16]以及铁载体的浓度[17]。
1.4 菌株对3 种贝壳粉的促磷作用
菌株在LB 液体培养基中培养18 h 达到对数期后,接种于含有2 g/dL 贝壳粉的LB 培养基中,以不接种菌株的培养基为对照,30 ℃、200 r/min 培养1~7 d,样品5000 g 离心5 min 后,用钼酸铵比色法检测体系中的可溶磷质量浓度。
1.5 菌株对贝壳粉和土壤混合物的促磷作用
将3 mL 菌株分别接种于10 g 灭菌土壤和10 g贝壳粉与土壤混合物(加入无菌水适当湿润),以接种3 mL 无菌水为对照, 混合均匀后自然环境下培养1~7 d,取等量样品用无菌水稀释,5000 g 离心5 min 后,测量体系中的磷质量浓度。
2 结果与分析
2.1 标准曲线的绘制
有效磷质量浓度测定:
标准曲线(1(a)),线性拟合方程(1)如下:
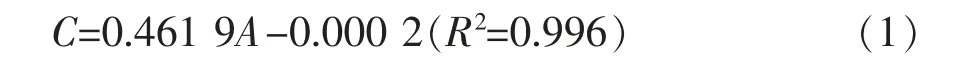
式(1)中,A 为有效磷质量浓度(mg/L);C 为在OD700下样品的吸光度值。
铁载体(DHB)浓度测定:
标准曲线(1(b)),线性拟合方程(2)如下:
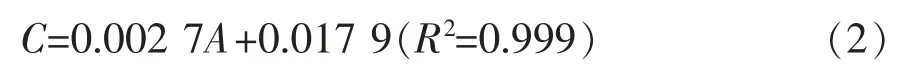
式(2)中,A 为铁载体浓度(μmol/L);C 为在OD510下样品的吸光度值。
生长素(IAA)质量浓度测定:
标准曲线(1(c)),线性拟合方程(3)如下:
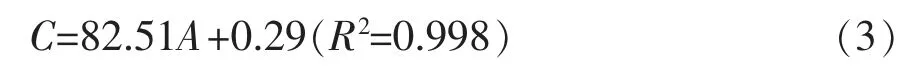
式 (3) 中,A 为生长素质量浓度 (μg/mL);C 为在OD550下样品的吸光度值。
各种促生特性检测标准曲线见图1。
2.2 菌株的筛选与鉴定
实验从样品中筛选到11 株具有明显溶磷圈的菌株, 并考察了11 株菌株的溶磷能力。 如图2 所示, 在以磷矿石为唯一磷源的培养基中,YP6 表现出最高的溶磷能力,达到109.3 mg/L。由于磷矿粉的加入,对照中存在少量有效磷(23.7 mg/L),经计算,YP6 作用的样品中溶解了的磷质量浓度是对照的4.6 倍,远高出其他菌株的溶磷能力。 因此选取YP6作为所要研究的目的菌株。

图1 各种促生特性检测的标准曲线Fig. 1 Standard curves for the detection of various growth promoting characteristics
提取YP6 的全基因组序列进行16S rRNA 序列扩增, 将测序结果提交至NCBI, 获得序列号为KP326355.1。对YP6 的16S rRNA 进行序列比对,绘制系统进化树图3。 经比较,YP6 与BacillusamyloliquefaciensXH7(登录号:CP002927.1)的16S rRNA 序列达到99%的相似度, 因此将YP6 命名为Bacillus amyloliquefaciens YP6。
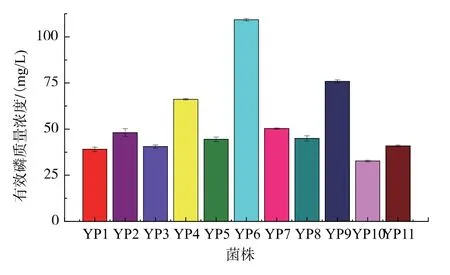
图2 11 株芽孢杆菌的溶磷能力比较Fig. 2 Comparison of phosphorus solubilizing ability of 11 strains of Bacillus

图3 基于进化树16S rRNA 基因序列构建的系统进化树Fig.3 Phylogenetic tree based on 16S rRNA gene sequence
2.3 YP6 的促生作用
如图4 所示YP6 的促生特性,有效磷质量浓度和碱性磷酸酯酶酶活均随时间上升,成正相关。 其中有效磷质量浓度在第5 天达到135.43 mg/L,其增长量约为110.31 mg/L。YP6 也具有较强的分泌生长素和铁载体的能力,其生长素质量浓度和铁载体浓度分别在第3 天和第2 天达到最高, 分别为28.62 μg/mL 和8.09 μmol/L。

图4 YP6 的促生特性Fig. 4 Growth promoting characteristics of YP6
2.4 YP6 对贝壳粉的溶磷作用
贝壳粉经YP6 作用7 d 后,结果如图5 所示。 3组对照中显示,贝壳粉和培养基中均存在少量可溶磷,但随着时间增长质量浓度并无明显变化,质量浓度分别约为9.2、11.4、5.8 mg/L。 不同贝壳粉中含有的不溶磷质量浓度不同,因此释放的可溶磷质量浓度也有区别。 3 种贝壳粉经YP6 菌株作用随时间增长可溶磷的质量浓度成正相关。 其中牡蛎粉中有效磷质量浓度最高,达到44.9 mg/L,生蚝粉中次之,为40.3 mg/L,蛤蜊粉中最少,为39.2 mg/L,可溶磷质量浓度分别是相应对照的5.0、3.4、6.7 倍。结果表明YP6 对贝壳粉具有明显的溶磷作用,可有效将贝壳粉中的不溶磷转化为可溶磷释放出来。
2.5 菌株对贝壳粉和土壤混合物的溶磷作用

图5 YP6 对贝壳粉的促磷作用Fig. 5 Phosphorus solubilization of YP6 for mussel powders
如图6 示,对照组中没有菌株的作用,可溶磷质量浓度较低, 随时间变化质量浓度并无明显变化, 其可溶磷可能来源于土壤和培养基, 约为8.4 mg/L。 经菌株作用的试验组中,随时间增长释放的溶磷量增加,在第6 天达到稳定,不再有明显增加,可溶磷质量浓度为34.9 mg/L, 提高至原来的4.2倍。 结果说明,YP6 可有效将土壤中的不溶磷释放出来,进而提高磷的利用效率。
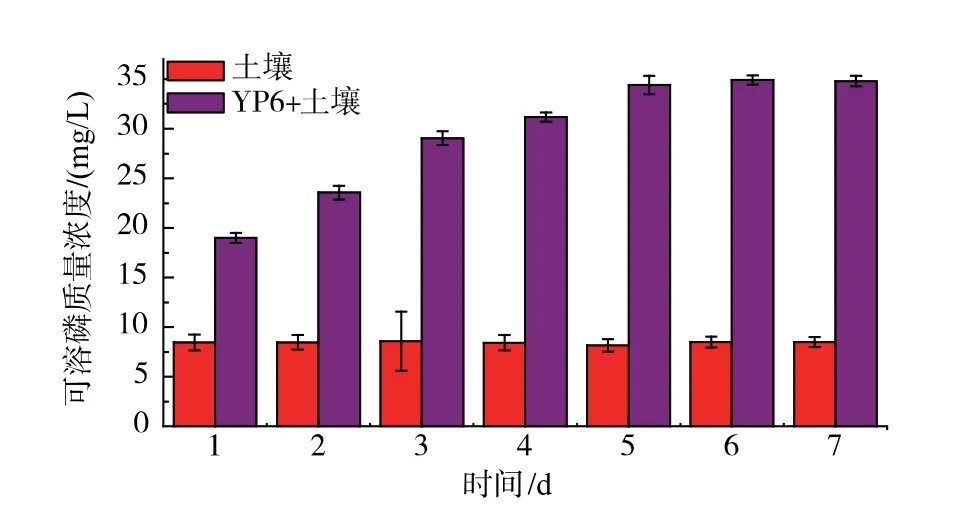
图6 YP6 对土壤的促磷作用Fig. 6 Phosphorus solubilization of YP6 for soil
图7 表示通过研究在YP6 作用下,贝壳粉和土壤混合物中的可溶磷质量浓度,来提高土壤中磷的利用效率,同时验证贝壳粉是否能作为一种新型磷肥用以施加入土壤中。 同样,未加入菌株的对照样品中可溶磷质量浓度随时间变化未呈现明显变化,来源于混合物中有效磷的质量浓度分别为16.5、19.9、13.3 mg/L。 通过YP6 的促磷作用,实验组样品中的可溶磷质量浓度显著上升, 在第7 天达到86.4、73.1、74.8 mg/L,是对照组的5.2、3.7、5.6 倍。 3组试验中,混入牡蛎粉的实验组有效磷质量浓度在第7 天最高, 在第7 天有效磷的增长均呈下降趋势, 混入蛤蜊粉和生蚝粉的实验组在5 d 后增长趋势并不明显,这与培养基的消耗以及菌株的死亡有关。
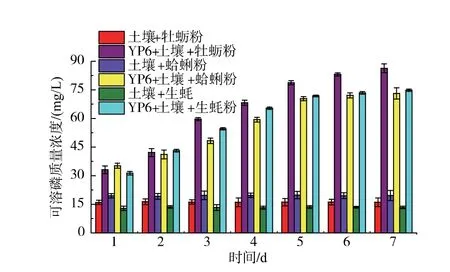
图7 YP6 对土壤和贝壳粉混合物的促磷作用Fig. 7 Phosphorus solubilization of YP6 for the mixtures of soil and mussel powders
2.6 讨论
我国磷资源总体呈现丰而不富的现状,随着磷矿大量开采,磷资源愈将匮乏,与此对应的是磷资源利用率低,大量被固定化,未能被植物吸收利用。针对土壤中磷含量丰富但有效磷缺乏,开发与利用解磷微生物是非常有效的环境友好型手段。20 世纪80年代开始, 利用微生物溶磷作用的研究越来越多。 Xiao 等从湖北磷矿筛选得到3 株解磷菌(Candidakrissii,Penicilliumexpansum,Mucorramosissimus),并优化了其溶磷条件[18]。 Vassilev 等发现Aspergillus niger的加入可有效增加有效磷的含量并促进植物的生长[19]。 Mendes Gde 等固态发酵优化Aspergillus niger的溶磷条件,并将发酵产物作为磷肥施用于土壤中,促进了植物的生长及植物对磷的吸收[20]。 实验从贵州磷矿的植物根际筛选得到一株解磷菌YP6, 发现YP6 具有良好的促生特性,适合用作土壤改良菌株。 在以2 g/dL 磷矿石为唯一磷源的培养基中培养2 d, 有效磷质量浓度达到109.3 mg/L,可溶磷质量浓度提高至4.6 倍。 YP6 应用到土壤中也展现出良好的溶磷能力,土壤中被固定化的含磷物质被释放成可被植物吸收的有效磷,可溶磷质量浓度提高至4.2 倍。 结果表明YP6 具有通过溶解含磷物质,释放有效磷的能力,可应用于农业以及肥料中。
贝壳是海产养殖的副产物, 难以自然降解,其利用不充分,对环境污染严重,目前已成为世界性难题。 贝壳同时作为一种成本低廉的自然资源,具有巨大的潜在价值。 Boey 等和Hu 等分别将海扇壳和河蚌壳作为生产CaO 的原材料,用以催化反应生产柴油[21-22]。 赵宏等以贝壳粉为原材料制备带状羟基磷灰石[23]。凡军民等发现,在金针菇栽培材料中添加贝壳粉,能有效提高子实体产量[24]。 Chang 等发现,将牡蛎粉施加入土壤后,可有效改善土壤的理化性质以及土壤中微生物的特性,调节土壤中pH,并使洋白菜增产[25]。 曹英兰等发现,牡蛎粉的加入,将土壤pH 调节到7.74,有效矫正了土壤的弱酸性,并降低了土壤中重金属镉的含量[26]。 El-Azeem 等通过研究牡蛎壳, 蛋壳和蛤贝等废弃物对土壤中Cd、Pb 和As 的修复能力, 发现土壤中pH 提高明显,Cd、Pb 和As 的含量显著下降[27]。 Paz-Ferreiro 等发现,贝壳粉与泥浆混入土壤中,可改善土壤pH 并检测了土壤性能,提出贝壳粉的添加有望改善土壤肥力[28]。
3 结 语
本实验中,通过验证YP6 对牡蛎粉、蛤蜊粉和生蚝粉同样具有释放有效磷的能力后,将YP6 应用于土壤和贝壳粉混合物中,可溶磷质量浓度随时间增长逐渐上升, 在第7 天3 种样品中分别达到86.4、73.1、74.8 mg/L,是对照组的5.2、3.7、5.6 倍。其中,牡蛎粉中释放的可溶磷最高,接近YP6 作用下的磷矿石中有效磷质量浓度。 由于不同贝壳粉中含磷物质存在差异,YP6 对3 种贝壳粉的解磷效率仍需进一步实验。 但该数据说明,YP6 可有效提高贝壳粉和土壤中有效磷质量浓度,贝壳粉有望替代磷矿石作为新的磷肥原料,或作为补充剂加入磷肥之中来缓解我国目前面临的磷矿资源紧张现状。 同时,作为一种贝壳资源回收利用的新方法,也大大减少了贝类资源的污染和浪费。
尽管解淀粉芽孢杆菌YP6 对土壤和贝壳粉具有显著的解磷作用,其解磷机制,最佳解磷条件仍不明确。 有研究报道,解磷微生物的解磷能力是由于微生物产生的有机酸(如柠檬酸,草酸,铁载体等)[29]或者微生物分泌的酶(如植酸酶、磷酸酯酶)[30]。 因此,YP6 的解磷机制仍需进一步的实验来确定。 同时,其促生能力能否促进植物的生长,有效磷能否被植物有效吸收仍有待在实际应用中进行更加深入的研究。

