亮斑扁角水虻形态观察及诱产卵菌的筛选
荆海全,钟 问,詹发强,杨 蓉,包慧芳,侯 敏,龙宣杞
(1.新疆大学生命科学与技术学院,乌鲁木齐 830052;2. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091 )
0 引 言
【研究意义】亮斑扁角水虻(Hermetiaillucens, black soldier fly)是一种双翅目(Diptera)、水虻科(sratiomyidae)亮斑扁角属(Hermatia)的一种完全变态的营腐生性资源昆虫[1]。亮斑扁角水虻免疫系统强大、抗逆性强、嗜群居、取食范围广泛、繁殖能力强、代谢快,是现阶段食源性昆虫研究的热点。亮斑扁角水虻在不同环境发育历程有所区别,新疆天气干燥,昼夜温差较大,了解亮斑扁角水虻各个生命阶段的生活习性、生命历期、及其对环境的适应性是新疆开发利用水虻的前提。提高水虻产卵量,是其在畜禽行业粪便、餐厨垃圾的利用与处理中规模化应用的基础。在新疆进行亮斑扁角水虻的适应性研究能够扩大亮斑扁角水虻的研究数据,对亮斑扁角水虻形态观察及诱产卵苗的筛选,对亮斑扁角水虻在新疆的规模养殖与利用有重要意义。【前人研究进展】杨森[2]在中国海南热带季风气候条件下,进行了连续人工饲养亮斑扁角水虻的探索,发现水虻在32 d左右可以完成由卵到成虫的发育;Fernanda Rocha de Oliveira[3]对亮斑扁角水虻幼虫及成虫进行电子显微观察和形态学描述。郑龙玉等[4]做了亮斑扁角卵携带微生物对成虫产卵行为及幼虫生长的影响,发现卵表细菌是卵诱成虫产卵的主要因素。【本研究切入点】亮斑扁角水虻各阶段发育历期因其所处环境不同而不同,新疆气候干燥,昼夜温差大,有关亮斑扁角水虻在新疆的研究还未见报道。研究亮斑扁角水虻形态学、亮斑扁角水虻生态特征,如亮斑扁角水虻种群雌雄比例变化规律、亮斑扁角水虻交配行为进行细致描述,并对卵表诱产卵细菌进行分离和鉴定。【拟解决的关键问题】对亮斑扁角水虻在新疆进行4代养殖,比较不同培养基喂养下水虻的生活史,并对卵、幼虫、预蛹、蛹、成虫形态进行观察和记录,对其促产卵菌进行分离和鉴定。通过4代本地养殖,研究亮斑扁角水虻在新疆的生活习性、种群雌雄比例变化、交配产卵等规律,筛选诱产卵菌并鉴定,为亮斑扁角水虻在本地区的应用提供研究数据。
1 材料与方法
1.1 材 料
1.1.1 供试虫卵
亮斑扁角水虻虫卵(武汉品系),由华中农业大学生物工程实验室提供。
1.1.2 设备及装置
MSSPX- 250型生化培养箱,MLS -3020 高压蒸汽灭菌锅,SW-CJ-1F B型单人双面净化工作台,恒温摇床 HWY-100,Nikon Ni-生物成像显微镜、日立SU8010扫描电镜、NY20CK-11充油式电暖器,空气加湿器、植物组织光照灯、温湿度计、塑料盆、药品箱、孵卵架、瓦楞纸板(230×20) mm、全封闭蚊帐(1 200×2 000×1 700 )mm。
1.1.3 培养基及培养料
LB培养基配方:胰蛋白胨10 g,NaCl5 g,酵母膏10 g,琼脂10 g,pH7.2、水1 L。
CB∶玉米粉∶麸皮∶水=1∶1∶1.2。
JCM:海棠果60 g,CB60 g,鸡粪120 g。
1.2 方 法
1.2.1 试验设计
2018年9月初,从华中农业大学生物工程实验室引进亮斑扁角水虻卵,于温度(26±1)℃,湿度60%±10%的条件下饲养至F2代;对F3代、F4代水虻幼虫在室内进行驯化饲养;分别观察记录各饲养条件下亮斑扁角水虻卵、幼虫、蛹、成虫等不同阶段的发育历期、生活习性、成虫种群雌雄比例,对不同期水虻显微拍照;从亮斑扁角水虻卵中分离筛选诱产卵菌并做初步鉴定。
1.2.2 亮斑扁角水虻饲喂
1.2.2.1 亮斑扁角水虻卵的孵化
将玉米粉、麸皮、水按1∶1∶1.2的比例搅拌均匀,揉碎小块,置于塑料盆中,将水虻卵放在孵卵架上并置于塑料盆上,盖3层纱布,室内温度保持在28℃左右,白天每隔4 h翻动1次培养料,以避免其发霉。
1.2.2.2 亮斑扁角水虻幼虫的培养
待水虻幼虫大量孵化出时,每日添加20 mm厚培养料,适度喷水,保持湿度60%左右和温度26℃左右,待水虻生长1周后,用4 mm网孔筛使虫粪分离,适时分盆调节种群密度,使水虻充分生长。
1.2.2.3 亮斑扁角水虻蛹的管理
待水虻开始进入预蛹期时,逐渐减少饲喂料,待水虻约一半化蛹时,停止饲喂,待约2/3水虻不动时,于水虻表面适量喷水;待水虻蛹开始羽化时,在塑料盆底部铺5 cm尾料[5],将水虻连盆放入蚊帐内,白天用植物组织光照灯光照9.5 h,夜间将灯关闭。
1.2.2.4 水虻成虫管理及雌雄比例记录
待水虻开始羽化2 d后,对水虻成虫喷水300 mL/d,植物组织光照灯光照9.5 h/d;每天早上10∶00、中午15∶00、晚上20∶00随机抓取水虻成虫轻捏其尾部观察其生殖器识别雌雄,参考“乒乓球记分法”记录种群雌雄比例,即随机抓取水虻成虫,若为雄性记雄性1分,若为雌性记雌性1分,二者中有一方至11分停止记分,早、中、晚各记录3次得分,记录后放回。
1.2.2.5 亮斑扁角水虻的驯化
F3、F4代卵分别在28℃孵化,待幼虫孵化出7 d后,适当调节水分,F3代于温度(21±1)℃、湿度60%±10%,F4代于温度(24±1)℃、湿度60%±10%条件下用培养F1代剩余的尾料培养水虻,每天观察虫子生长状态,每2 d翻动培养料1次,每周换料1次,待观察到首只水虻羽化时调节温度于27±1℃停止驯化。
1.2.2.6 收卵板的制作
将瓦楞纸用小刀裁剪为长230 mm、宽20 mm的小方条,将5个小方条用皮筋在其两边捆扎,分别称取1 g棉花塞在瓦楞纸板两侧内部,制成瓦楞纸板使用前在超净工作台内紫外灭菌30 min。
1.2.2.7 亮斑扁角水虻生活史
饲养亮斑扁角水虻11个月,用直接观察法记录亮斑扁角水虻卵孵化历期、幼虫成长史、成虫交配产卵规律。
1.2.2.8 亮斑扁角水虻形态
先分别将实验室自养的水虻卵、1日龄幼虫、幼虫、预蛹、蛹、成虫用卡罗液固定24 h,然后改用75%酒精保存12 h,在显微镜下进行观察,结合饲养过程对水虻形态特征进行描述。
1.2.2.9 水虻寿命与重量的关系
将刚孵化出的水虻成虫分为雌虫、雄虫、雌雄各半3组各20只放在采样袋里,放于植物组织光照灯下,每天统计各组水虻存活数量,记录成虫成活率并随机抓取每组水虻成虫称重(n=5),记录后放回。
1.2.3 诱产卵菌的分离、筛选和鉴定
1.2.3.1 水虻卵携带微生物的分离纯化
参考杨森等[6]的方法稍作改动。称取亮斑扁角水虻新鲜卵簇0.05 g,用小镊子取出后用无菌生理盐水洗涤3遍,再转至研钵中添加1 mL生理盐水,研磨,然后将研磨液梯度稀释,10-4、10-5、10-63个稀释梯度各自吸取0.5 mL菌液涂布于LB平板(n=3)中30℃培养,24 h后挑取典型菌落进行纯化培养,分离出典型菌落。
1.2.3.2 水虻肠道菌的分离纯化
取孵化出4 d的水虻小幼虫6只,饥饿处理24 h,在超净工作台内先将其浸入生理盐水处理处理2 min,在将其浸入酒精1 min,接着用镊子将其夹入3%次氯酸钠中处理30 s,然后将其转入新的生理盐水中处理10 s,最后将其夹入研钵中,用刀片在幼虫腹部背面轻轻划开,用镊子夹出肠道组织及内容物,加入1 mL生理盐水研磨,将研磨液梯度稀释,取10-4、10-5、10-6梯度液各0.5 mL涂布于LB平板(n=3),30℃培养,24 h后提取典型菌落纯化培养,并做标记。
1.2.3.3 发酵液的制作
将纯培养F2代的典型菌落接种于含100 mL LB发酵液的250 mL三角瓶中,于160 r/min、30℃的恒温摇床内培养24 h,然后将菌液继续接种活化1次,于160 r/min、30℃的恒温摇床内摇床培养48 h备用。
1.2.3.4 诱产卵菌的筛选
F3代、F4代水虻各处理1次。密闭蚊帐内放置600×450×500 (mm)的6个白色塑料箱,于每个塑料箱中放置1万只亮斑扁角水虻蛹,且在其上放置1个塑料托盘。水虻开始大量羽化3 d后,在每个托盘中放置3个接有发酵菌液的瓦楞纸板,每天早上09:00接菌,晚上19:30半后收集虫卵,称量各处理组虫卵量,与只接LB液体培养基的对照组对比虫卵量,卵重高于对照组的处理菌液为有诱产卵效果组。
1.2.3.5 诱产卵菌的鉴定
将有诱产卵效果的菌进行革兰氏染色、16s RNA鉴定,对获取的序列在Eztaxon官网上查找相似菌株序列,用MEGA7.0构建系统发育树。
2 结果与分析
2.1 水虻培养历期
研究表明,各饲喂组孵化所需时间为2~4 d,这与杨森[2]报道的2~6 d结果基本一致,在常规孵化条件下亮斑扁角水虻在疆能够正常孵化;驯化组开始蜕皮时间、一半化蛹时间、开始羽化时间明显变长,分析是因为驯化环境温度(21±1)℃相对偏低,水虻代谢活动相对变慢,而F4代驯化时间较F3代短,主要是因为初夏环境温度变高且亮斑扁角水虻逐渐对环境适应的结果,另外用CB饲喂水虻,水虻从卵到成虫开始羽化时间为41~42 d,这与郭凤达[7]的38 d稍有延长,在适宜条件下人工饲养水虻,地理位置对水虻的生长发育的影响不大。而驯化组生命周期变长,且初春21℃及初夏24℃驯化条件下水虻生命期分别延长20和10 d,气候环境主要是温湿度对水虻生长发育影响较大。此外,抓饭及拌面餐厨余饲喂水虻,水虻历期延长约2~4 d,而JCM饲喂水虻,水虻幼虫共经历7个多月才羽化,培养基类型对水虻生命历期有重要影响。表1

表1 亮斑扁角水虻培养历期(d)Table 1 Culturing Period of Hermetia illucens under different conditions
2.2 亮斑扁角水虻生活史
2.2.1 亮斑扁角水虻卵
雌性亮斑扁角水虻成虫在其受孕2~3 d后开始产卵,单只产卵约300~600粒,Cuncheng Liu等[8]报道的雌性单只产卵量可达900只。刚产出的卵为白色,隔天变黄以卵簇的形式聚集在瓦楞纸空隙中;亮斑扁角水虻虫卵容易因干燥失水死亡,宜在其母体产出1~2 d内孵化,另外,虫卵本身为高蛋白营养体易受霉菌侵染。水虻卵在适宜温度26~30℃阴暗环境下即可孵化,孵化历期一般为2~4 d,孵化时将其置于距离培养基15 cm高的孵化架上孵化,幼虫孵出后即落在培养基上生长。
2.2.2 亮斑扁角水虻幼虫
刚孵化出的小幼虫能够爬动,比较活泼,但同时生命力较脆弱,容易因饥饿、培养基发霉、干燥等外因而致死,需要在养殖过程中及时添料、保持湿度,适当翻动培养基;水虻幼虫柔软,其头部口器坚硬,具有较强的穿透能力,水虻幼虫利用其头部口器可以从腐生动物尸体及其粪便中刮取营养;亮斑扁角水虻幼虫白色无足,靠蠕动向前爬行,另外,幼虫复眼发育缓慢,厌光,因而虫体一般位于基质中下部。而当其在饥饿状态下时,水虻腹部背面变黑,可观察到其腹部肠道黑色内容物,据此可作为添加新培养基的依据。另外,饥饿会使老熟幼虫提前蜕皮,其原因可能为水虻在饥饿环境下提前进入休眠期以保护自身。亮斑扁角水虻幼虫在适宜温度、湿度、养料充足的条件下生长迅速,大多可长至0.14~0.2 g,部分可长至0.3~0.34 g,老熟幼虫体重约为卵期的2 000~4 000倍。亮斑扁角水虻幼虫期约20 d到数月不等,水虻幼虫滞育的原因主要是阴暗、极度潮湿、纯鸡粪等逆境环境或富营养条件。亮斑扁角幼虫在正常条件下共经历2次蜕皮,第1次蜕皮后,其体表略带淡黄色,自第2次蜕皮后,进入预蛹。
2.2.3 亮斑扁角水虻预蛹
亮斑扁角水虻进入预蛹期后,其体表变黑并逐步变硬,取食量也逐渐下降,与老熟幼虫相比,其体重稍轻,对湿热敏感,喜欢往相对干燥的环境爬动[9]。预蛹期共经历5~8 d。
2.2.4 亮斑扁角水虻蛹
亮斑扁角水虻进入蛹期后停止活动,尾部翘起,体表明显变硬达生命期最硬,内部体液为蓝色浆状稍带香味,共经历4至十几天不等,大多历期5~7 d。研究发现水虻蛹开始羽化后,适量喷水有助于蛹的进一步羽化,水虻羽化与其他昆虫一样对湿度有一定要求。[10]水虻羽化时,水虻成虫将蛹壳前端顶破,但蛹壳与成虫身体常常粘连,此时水虻成虫不停爬动,最终凭借“求生能力”脱离蛹壳进入成虫期。
2.2.5 亮斑扁角水虻成虫
亮斑扁角水虻成虫刚羽化出时,就具备天生的飞行能力,且性格相对暴躁,成虫常常上下摆动其左右触角棒以增加其对环境的了解;亮斑扁角水虻成虫头部上下点水用其吸盘饮水,一般不再取食、有访花习性。水虻成虫反应相对迟钝,很容易被捕捉,但若多次捕捉失败会提高其灵敏性;水虻成虫羽化主要在其首只羽化后3~4 d后开始集中羽化,且在水虻开始羽化2 d后在植物光照灯下即进行交配;
2.2.6 水虻交配
亮斑扁角水虻交配对温度有一定要求,24℃为临界交配温度,在24℃以下不交配,且交配主要在26~30℃进行。交配大多是在飞行的状态下开始的,雄虫在飞行中按雌虫飞行轨迹追逐雌虫与其抱团,然后一起落在地面、培养箱、蚊帐等支撑面上,接着雌虫向前爬动,此阶段雄虫煽动左右翅膀(Giulia Giunti等发现雄虫煽动翅膀对引起雌性水虻注意及交配许可尤为重要[11]),生殖器向下弯曲尝试与雌虫尾部对接,交配通常在几秒到十几秒完成尾部对接(也有可能对接失败即交配失败),待二者尾部对接完成以后,雄虫大多情况下会转头走下雌虫背部与雌虫进行交配,此后一般雌雄虫不再爬动或一方通常为雌虫爬动,另一方被其带动爬动,且二者保持相对安静,Giulia Giunti等[11]研究发现,此过程雌性基本不动,雄性以较低的频率上下轻微摆动触角棒。水虻交配大多以180°直线型、尾对尾、两头反向交配,少数以60~90°“V”字型进行交配,交配持续时间较长,可达40~80 min。另外水虻交配也可以以雄虫飞到雌虫背部与雌虫交配,但这种交配方式持续时间短,效果差;水虻成虫交配在光照的环境照下进行,在无光的情况下可以持续,但大多交配在有光照下进行。此外,水虻交配存在竞争行为,具体表现为5~6只水虻叠加抱成一团,且各雄虫生殖器向下弯曲,但这种行为持续时间因负重短暂,是1种无效的交配方式。水虻并非只在雌雄之间空中抱团,也存在一部分雄雄抱团现象,分析可能是水虻雄虫的竞争行为也可能是水虻雄虫对水虻雌虫识别力较差的缘故。
2.2.7 雌虫产卵
水虻完成交配后约2~3 d后开始产卵,产卵一般在有孔或缝隙的纸板上进行,雌性水虻产卵时尾部露出生殖器2~4 mm伸进产卵孔隙内进行产卵,产卵期间相对安静,但当正产卵水虻遇到其他水虻干扰时,产卵雌性水虻发出“嗡嗡”叫声警告驱逐其他来犯水虻,亮斑扁角水虻雌虫有此种表现可能是产卵水虻与其他雌性水虻竞争产卵地,雌性产卵水虻可在一个纸孔中连续几十分钟产卵,水虻有时也选择在不同的空隙附近走动,均匀向孔隙中产卵。产卵通常在光照下进行,但在黑暗环境中产卵行为可以继续保持,产卵早晚都可进行,雌性水虻产卵对产卵基质有一定的嗜好性,通常在有培养基质、有卵、有幼虫的地方产卵。
2.2.8 成虫死亡
亮斑扁角水虻成虫飞行、交配等生命活动大量消耗了其体内贮存的脂肪,亮斑扁角水虻雄虫在生命末期其腹胸部脂肪基本耗尽,虫体体内水分大大减少,最后一般失去爬行能力,煽动翅膀直至死亡,新鲜虫尸略带香味。图1
2.3 亮斑扁角水虻形态特征
研究表明,卵椭圆、表面光滑、白色至透明隔天变黄、近似米粒状,由一层保护膜所包裹的实体;刚孵化出幼虫11节,白色,头部淡黄色,刚毛渐长;熟幼虫刚毛较长,侧板、背板刚毛清晰整齐,左右一致,随日龄增加各节背毛变多,毛刺渐粗颜色也渐深,各节缝后短从毛渐少,短于侧板毛。
亮斑扁角水虻蛹金黄至深褐光泽,节缝沟深而明显,刚毛较短,蛹组织分布均匀、头部有明显刺突,触角棒等各器官渐形成;另外亮斑扁角水虻复眼发育迟缓;
雄虫头部亮黑色,复眼宽分离,黑褐色,无毛,小眼面较小,大小一致。单眼瘤小,明显,单眼黄褐色到红褐色。后头两侧近复眼顶角处有2个浅黄斑。上额中部和下额微凸,下额上部两侧各有一个浅黄色小圆斑,中部触角上的位置有1对黄色纵条斑。颜部微凸,中下部向前下方延伸成1个圆锥形小鼻突,颜中部具1个浅黄色纺锤形纵斑,两侧沿复眼缘有黄褐色向下渐窄的纵条斑。头部的浅黄斑有时为黄褐色或不明显。头部被白色直立短毛,头顶、颜下部和颊毛较明显。
触角黑色,但梗节和第1~3鞭节红褐色,第8鞭节长为其余鞭节总长的1.3倍;柄节和梗节被长黑毛,鞭节密被浅黄粉,触角芒被短黑毛。
喙黑色,被长黄毛。须2节,黑色,极短小,被短黄毛。
翅长11~13 mm,翅脉清晰,左右翅膀基本对称,后翅演化为平衡棒,平衡棒基部尖细,端部小叶状、白色,左右翅重叠覆盖于腹背板上部。
腹部长椭圆形,向端稍渐窄,长于胸部。腹部红褐色,第1背板和第2背板侧边黑褐色,第1背板端缘两侧(除侧边缘外)和第2背板两侧(除侧边缘外)为白色稍透明,形成2个近方形白色透明斑;第1腹板端半部和第2腹板白色稍透明。
雄性外生殖器:第9背板长大于宽,心形,基缘具半圆形凹缺,端缘较尖;尾须长卵圆形;生殖基节长稍大于宽,基缘平,端缘中部具2个方形突,两侧各具一个端部钝的扁侧突;生殖基节突端部远超过生殖基节基缘,超出部分长几乎达生殖基节长的一半;生殖刺突与生殖基节强烈愈合,陷入生殖基节腹面端部,与其几乎融为一体;生殖刺突端缘中部凸,内侧具1个小乳头状突,顶端具一丛刷状毛,外侧具一较大的乳头状突;阳茎复合体明显细长,三裂叶,三叶等长,向端渐细呈针状,明显分开。
雌虫与雄虫相似,仅触角第1~3鞭节明显膨大,雄虫触角第1~3鞭节不膨大。图1

注:A、B为卵整体面观; C、D、E、F分别为从卵孵化出1日、2日、15日、20日幼虫面观;G、H为老熟幼虫头部面观;I为老熟幼虫尾部面观;J为蛹背面观、K蛹腹面观、L为蛹尾部面观;M、N、O为蛹头部面观P、Q为成虫头部面观;R、S为左右翅面观;T为雄虫腹部背面观U为雄虫腹部腹面观V为雌虫腹部背面观、W为雌性生殖器面观、X为雄性生殖器面观A、B Holistic view of eggs; C 、D、E、F The Holistic view of larvae hatched from eggs on the 1st, 2nd fifteenth and tentieth day respectively;G 、H Holistic view of mature larvae head ;I Tail view of mature larvae;Jpupa back view;K Holistic view of Pupa abdomen L The appearance of pupa tail;M、N、O Electronic Scanning of Pupae Head;P、QHolistic view of Adult head;R、S Wing View;T The back view of male adult;U Abdominal aspect of male adult;V Abdominal appearance of female adult W Female genital aspect,X Male genital aspect图1 亮斑扁角水虻形态观察结果Fig.1 Morphological Observation of Hermetia illucens
2.4 水虻成虫群雌雄比例、成虫重量变化规律
研究表明,水虻开始羽化2 d内雄虫占绝对优势,但雌性水虻成虫数量逐渐迅猛增多,到第4 d时雌虫数量与雄虫数量相当且雌性成虫以此比例保持2 d,到第5 d时水虻成虫雌性与雄性水虻在量上进入“可竞争期”;到第6 d时雌性水虻数量总体超过雄性水虻,其后每天早中晚9次统计中雌性比例总体“占上风”,在第17 d时,雄性水虻比例处于劣势,到21 d时水虻群主要以雌性为主,此时水虻群整体处于末期。图2

图2 亮斑角水虻成虫群雌雄比例变化Fig.2 Change of male-female ratio of adult population of Hermetia illucens
研究表明,亮斑扁角雌虫水虻重量略高于雄虫,亮斑扁角水虻雌雄虫重量随着羽化后天数的变化而逐渐下降,且水虻成虫前期体重下降较快,后4 d体重下降趋缓,因为水虻成虫前期以飞行为主的活动耗能较多,其体重下降稍快;亮斑扁角水虻雌虫重量高于雄虫且基本贯穿成虫生命期;亮斑扁角水虻成虫寿命在试验条件下约为7~9 d,低于周芬等[12]报道的13~14 d,但与Chelsea D. Miranda等[13]报道的8 d接近。图3

图3 亮斑扁角水虻成虫重量变化Fig.3 Weight Changes of Adult Hermetia illucens
2.5 亮斑扁角水虻诱产卵菌筛选
研究表明,e1和Y3 2菌发酵液对亮斑扁角水虻产卵有较好的引诱效果,其产卵量明显高于对照组,e1和Y3 2菌液诱产卵量分别为对照组的6.26和7.40倍,具有明显的诱产卵效果。 表2

表2 不同发酵菌液诱导亮斑扁角水虻产卵量Table 2 Statistical Table of oviposition induced by different fermentation bacteria
2.6 亮斑扁角水虻诱产卵菌鉴定
研究表明,e1及Y3 为2种菌皆为革兰氏阳性菌,系统发育树结果,初步鉴定e1为暹罗芽孢秆菌、Y3为新微球菌属,且Y3为1种潜在的新菌。表3,图4~6

表3 亮斑扁角水虻诱产卵菌的革兰氏染色结果Table 3 Gram staining results of oviposition-inducing bacteria of Tadpole Leptospira
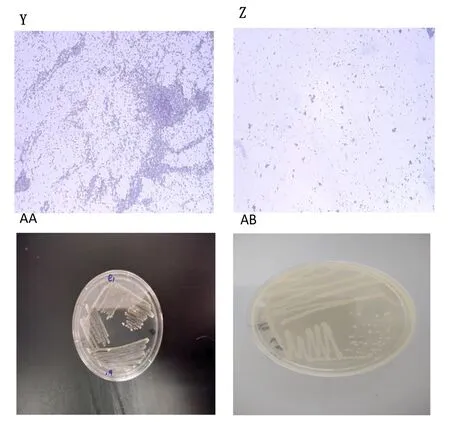
注:Y、Z分别为e1、Y3革兰氏染色结果,AA、AB分别为e1、Y3菌落形态Note:Y, Z , as e1,Y3 Gram staining respectively, AA,AB as e1,Y3 colony morphology respectively图4 诱产卵菌革兰氏染色结果及形态Fig.4 The results of Gram staining and colony morphology of oviposition-inducing bacteria

注:标尺表示遗传距离Note:Scale bar indicates the genetic distance图5 邻接法分析菌株e1系统发育树Fig.5 Phylogenetic tree of strains e1 based on 16 SRNA constructed by Neighbor-joing method

注:标尺表示遗传距离Note:Scale bar indicates the genetic distance图6 邻接法分析菌株Y3系统发育树Fig.6 Phylogenetic tree of strains Y3 based on 16 SRNA constructed by Neighbor-joing method
3 讨 论
亮斑扁角水虻凭借其强大的生命力和适应性在世界范围内广泛分布,我国海南、广西、广东、湖北、江苏、山东、辽宁、河北、四川、云南、贵州、陕西、台湾、香港等省份和地区都有分布[14],并且其正处于产业化发展的初期,发展势头迅猛,前景广阔,在新疆等西北地区开展亮斑扁角水虻的研究对于综合了解水虻适应性从而更好在该地区开发利用水虻具有积极意义。
在新疆室内条件下养殖亮斑扁角水虻11个月。经过长期观察,对亮斑扁角水虻卵、幼虫、蛹、成虫各阶段生活习性、形态特征、交配方式、产卵规律做了详细记录和描述。有关亮斑扁角水虻的交配行为、形态特征较前人报道也更为详尽;亮斑扁角水虻6×104只成虫群在实验条件下约保持24 d,说明成虫群产卵期较长,另外其每天产卵数百孔,亮斑扁角水虻可在该地区世代规模养殖。
对亮斑扁角水虻诱产卵菌进行了分离筛选,共筛到2株可明显诱产卵的菌株e1和Y3,其中e1初步鉴定为暹罗芽孢杆菌,其与Bacillusvelezensis(贝莱斯芽孢杆菌)及Bacillusamyloliquefaciens(解淀粉芽孢杆菌)进化关系较近,而杨森等[6]报道的诱产卵菌EEAM-10B及EEAM-3都与解淀粉芽孢杆菌进化关系较接近;Y3对亮斑扁角水虻诱产卵效果较好,初步鉴定为节杆菌属,而此菌在前人的研究中未见报道,亮斑扁角水虻诱产卵菌并不局限于少数几种菌,为一种潜在的新菌。
4 结 论
亮斑扁角水虻从卵到幼虫孵化历期与其培养基类型、温度等因素有关,亮斑扁角水虻在新疆驯化周期有所延长,但其发育完好,能够在该地区进行世代饲养,具有规模生产和开发利用潜力;观察并记录了其卵、幼虫、蛹、成虫及其其生殖器形态;筛选到对亮斑扁角水虻雌性成虫有诱导产卵效果的2株菌e1、Y3,其发酵液处理组平均产卵量分别为对照组的6.26和7.40倍,2株菌皆为革兰氏阳性菌,经16S RNA测序、Eztaxon查找相似序列菌,MEGA7.0构建系统发育树,鉴定e1为暹罗芽孢杆菌,Y3为节杆菌属,且Y3为一种潜在的新菌。

