阿维菌素凝胶微球的制备及性能评价
朱海云 高萌萌 张洪悦 杨晓静 张保华


摘要 以海藻酸钠和氯化钙为成球材料,以壳聚糖和PVA为覆膜材料,制备负载阿维菌素的凝胶微球。以载药率、包封率和溶胀率为主要筛选指标,通过正交试验优化,确定了最优制备工艺条件,各组分质量分数:海藻酸钠1%、氯化钙4%、壳聚糖2%、PVA 2%、戊二醛1.5%。同时,测定了阿维菌素凝胶微球的溶胀率和缓释性能。结果表明,凝胶微球在pH 7时溶胀率最大,温度和pH对载药微球的缓释性能有一定影响。
关键词 阿维菌素;凝胶微球;优化;性能
中图分类号 TQ 460文献标识码 A文章编号 0517-6611(2020)16-0146-05
doi:10.3969/j.issn.0517-6611.2020.16.040
The Preparation and Performance Evaluation of Avermectin Gel Microspheres
ZHU Hai-yun1, GAO Meng-meng2, ZHANG Hong-yue2 et al
(1.College of Energy and Chemical Engineering, Ningxia Vocational Technical College of Industry and Commerce,Yinchuan, Ningxia 750021;2. New Pesticide Innovation and Research Institute, Qingdao Agricultural University, Qingdao, Shandong 266109)
Abstract Alginate and calcium chloride were used as ball forming materials, chitosan and PVA as coating materials,gel microspheres loading avermectin were prepared. Taking the drug loading rate, encapsulation rate and swelling rate as the investigation indexs, the preparation conditions were determined by orthogonal experiment optimization,the mass fraction of each component was:sodium alginate 1%, calcium chloride 4%, chitosan 2%, polyvinyl alcohol(PVA) 2%, glutaraldehyde 1.5%. At the same time, the swelling and slow release properties of avermectin gel microspheres were measured. The results showed that the swelling rate of gel microspheres was the largest at pH 7, and temperature and pH had certain effects on the sustained release properties of avermectin gel microspheres.
Key words Avermectin;Gel microspheres;Optimization;Properties
基金項目 宁夏自然科学基金项目(2018AAC03198);宁夏高校科学研究项目(NGY2018209)。
作者简介 朱海云(1976—),女,陕西乾县人,副教授,硕士,从事药物合成与制剂研究。*通信作者,副教授,博士,从事农药环境友好制剂研究。
收稿日期 2020-04-07;修回日期 2020-04-29
在农业生产中,常规农药剂型的利用率低,释放较快、药效持续时间短,且农药流失严重导致生态污染,而农药缓释技术可有效地解决此问题。辛露露等[1]、许同桃等[2]以海藻酸钠为包埋材料制备了载药微球,实现了药物的缓释性能,提高了利用率。
阿维菌素(avermectin,AVM),即阿拂曼菌素[3],在多种溶剂中具有良好的溶解度。阿维菌素具有杀虫、杀菌、杀螨作用,此外还有杀线虫活性,其作用原理是释放γ-氨基丁酸,抑制节肢动物的神经传导,从而干扰害虫的神经生理活动[4]。阿维菌素不仅广泛应用于灭杀螨类和昆虫,而且在国外也用作寄生虫的治疗[5]。阿维菌素作为生物杀虫剂中不可或缺的一员,其速效且对环境和作物安全的优点使其具有良好的应用前景,但阿维菌素易受紫外线和微生物等影响而降解失活[6]。
海藻酸钠(sodium alginate)是一种聚阴离子海藻酸的钠盐,其结构中含有多个羟基和羧基官能团,可与多种二价和三价阳离子反应形成水凝胶[7]。海藻酸钠和钙离子的反应广泛应用于凝胶微球的制备,Song等[8]利用内源和外源乳化法制备海藻酸钠、壳聚糖凝胶微球用于食品和生物工程领域;杨军星等[9]利用海藻酸钠和钙离子交联,层层包裹壳聚糖,制备了负载血管内皮生长因子和万古霉素的多药载药微球。
壳聚糖(Chitosan)又称为脱乙酰甲壳素,是由甲壳素脱乙酰后而形成[10]。壳聚糖分子中的伯氨基可通过静电作用与海藻酸钠中的羧基发生络合反应,形成一种聚电解质复合膜[11]。聚乙烯醇(简称PVA)可以和海藻酸钠进行复合化学交联,形成互穿的网络水凝胶结构,使制备的凝胶微球具有较高的机械强度,球型更坚挺。王莹等[12]采用海藻酸钠和PVA作为包埋剂,以硼酸和氯化钙的混合液作交联剂制备微球,并探讨了包埋的最佳理化条件。
笔者以阿维菌素为供试药物,利用海藻酸钠和氯化钙的交联反应得到的交联材料为载体,制备缓释微球,然后在微球表面包覆一层PVA和壳聚糖,测定其各项性能,并结合正交试验优化制备工艺,以得到性能优良的阿维菌素凝胶微球,为阿维菌素农药缓释微球的开发奠定基础。
1 材料与方法
1.1 试验材料
阿维菌素原药(96%),河北威远化工有限公司;海藻酸钠(化学纯),天津博迪化工股份有限公司;壳聚糖(脱乙酰度大于85%),天津化学试剂有限公司;无水氯化钙(分析纯),天津巴斯夫化工有限公司;二甲苯(分析纯)、冰醋酸(分析纯)、莱阳市康德化工有限公司;烷基酚聚氧乙烯醚、蓖麻油聚氧乙烯醚,青岛源鑫达化工有限公司;戊二醛,天津博迪化工股份有限公司。BME100L-X實验型高速剪切混合乳化机,上海德雨机电设备有限公司;傅里叶变换红外光谱仪,Nicolet IR200 Thermo Electron Corporation U.S.A;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;ZK-82 B型电热真空干燥箱,上海沪粤明科学仪器有限公司。
1.2 试验方法
1.2.1 阿维菌素凝胶微球的制备。
分别配制一定质量浓度的海藻酸钠溶液、阿维菌素乳液、壳聚糖冰醋酸溶液、聚乙烯醇溶液、戊二醛溶液和氯化钙溶液。在高速剪切混合乳化机的剪切(3 000 r/min)下,将配好的阿维菌素乳液逐滴加入到海藻酸钠溶液中,充分搅拌均匀,用针管(规格5 mL)将阿维菌素和海藻酸钠混合乳化液滴到氯化钙溶液中,保持钙化30 min,形成阿维菌素凝胶微球,将微球过滤分离清洗后备用。
将所制备的阿维菌素凝胶微球加入到一定质量浓度的壳聚糖溶液与PVA的混合溶液中覆膜3 h,加入一定质量浓度的戊二醛溶液进一步交联,交联10 min后用蒸馏水反复冲洗干净,抽滤分离微球,放入54 ℃烘箱中烘至恒重后取出,即得阿维菌素@海藻酸钠/壳聚糖/聚乙烯醇复合凝胶微球。
1.2.2 阿维菌素标准曲线。
以甲醇为溶剂配制5、10、15、20、25 mg/L的阿维菌素溶液,甲醇作空白对照,用紫外可见分光光度计在245 nm处测定阿维菌素溶液不同浓度的吸光度(阿维菌素在245 nm处有最大吸光度[13]),得到标准曲线方程:y=0.028 5x+0.115 7,R2=0.994 6,式中,y为吸光度,x为浓度(mg/L)。
1.2.3 阿维菌素凝胶微球载药率和包封率的测定方法。
按照文献[1]方法,根据公式(1)和(2)计算载药率和包封率。
载药率 =(球中药的质量/药球的总质量)×100%(1)
包封率 =(球中药物的质量/药球的总质量)×100%(2)
1.2.4 阿维菌素凝胶微球溶胀率测定方法。
精确称量干燥微球放入不同pH溶液介质中溶胀,不同时间点取出,用滤纸吸干表面液体快速称其质量,按照公式(3)计算溶胀率。
溶胀率=[(溶胀微球质量-干燥微球质量)/干燥微球质量]×100%(3)
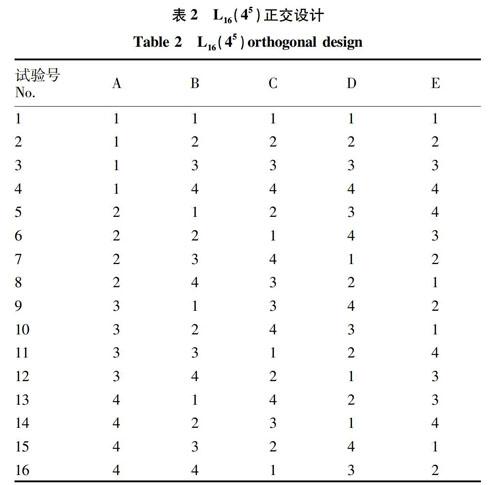
1.2.5 阿维菌素凝胶微球制备工艺正交优化设计。
设置5因素4水平正交试验,因素及水平见表1,各正交试验设计见表2。按照“1.2.1”制备阿维菌素凝胶微球,以载药率、包封率和溶胀率为指标,考察海藻酸钠(A)、氯化钙(B)、壳聚糖(C)、PVA(D)和戊二醛(E)5个因素不同质量分数对凝胶微球载药率、包封率和溶胀率的影响,从而选出最优制备工艺。
1.2.6 红外光谱表征。
采用溴化钾压片法,分别取烘干至恒重的阿维菌素原药及载药微球适量,于傅里叶红外光谱仪下4 000~400 cm-1的范围内进行扫描分析。
1.2.7 阿维菌素凝胶微球缓释性能测定。
分别精确称取干燥的阿维菌素凝胶微球置于一定体积的介质溶液中,分别调整pH(3、5、7、9)和不同温度(20、30、54 ℃),间隔一段时间取一定体积溶液测定吸光度,并以相同介质补齐,计算溶出浓度,分析微球的药物缓释性能。
2 结果与分析
2.1 阿维菌素凝胶微球制备工艺的优化结果
马萍等[14]利用微球重量变化来表示凝胶反应的速率,提出胶凝反应的速度与胶凝剂的用量有关。此外,制备材料用量不同,凝胶微球的成球效果不同,也会影响微球的溶胀率、载药率和包封率等性能。
以所制备的阿维菌素凝胶微球的载药率、包封率和溶胀率为考察指标,对制备工艺条件进行优化,结果见表3。根据试验结果,分别以溶胀率、载药率、包封率为指标进行分析,结果见表4~6。
由表4可知,与微球溶胀率密切相关的是戊二醛质量分数,戊二醛是交联反应剂,谭真等[15]提出戊二醛分子中的醛基与PVA和海藻酸钠中的氢原子发生缩醛化反应,增加了微球的交联密度使微球不易溶胀。此外,戊二醛用量对成球效果也产生显著的影响。王碧等[16]提出戊二醛质量分数少会导致微球变少,但戊二醛用量过多,会使微球黏连导致不易成球,从而影响溶胀率。而凝胶微球的载药率和包封率都与海藻酸钠、氯化钙的质量分数有关。海藻酸钠与氯化钙的质量分数直接影响了微球的成球效果,海藻酸钠和氯化钙的质量分数偏低时,形成的微球结构松散,形状不规则,偏高则溶液黏度大,针管挤出困难,不宜成大小均匀的微球,所以海藻酸钠和氯化钙的质量分数直接影响了微球对药物的包载情况,从而影响了微球的载药率和包封率。
对于载药微球而言,包封率表示药物被负载的程度,包封率越高,说明药物在制备过程中损失越小,载药率则表示微球包含药物的多少,会影响到后期的使用浓度和效果,而溶胀率与药物的缓释性有一定关系,分别计算各指标隶属度,综合评价微球性能,并进一步处理数据得到微球制备工艺优化参数,具体结果见表5、6。
综合考虑溶胀率、载药率和包封率3个指标对微球制备工艺的响应性,海藻酸钠和氯化钙用量对微球性能的影响大于其他因素,在微球制备中起决定作用。经优化后得到的微球制备最优方案(各物质质量分数):海藻酸钠1%、氯化钙4%、壳聚糖2%、PVA2%、戊二醛1.5%(表6)。
2.2 性能评价
2.2.1 阿维菌素凝胶微球外观形貌。
从图1可以看出,空白微球和载药微球外观均呈规则的球形,具有良好的形貌特征。
2.2.2 阿维菌素凝胶微球红外表征。
阿维菌素(a)谱图中1 738 cm-1 处为阿维菌素中酯基C=O的吸收峰,在载药阿维菌素凝胶微球谱图中也出现了相应的峰,表明凝胶微球包裹了阿维菌素原药(图2)。
2.2.3 pH對阿维菌素凝胶微球溶胀性能的影响。
由图3可知,在酸性条件下(pH为1、3、5),凝胶微球的溶胀性能均低于中性条件下的溶胀性能。随着时间的延长,微球溶胀性趋于平衡。
2.2.4 阿维菌素凝胶微球缓释性能。
2.2.4.1 pH对阿维菌素凝胶微球缓释性能的影响。
由图4可知,随着溶出时间的延长,不同pH条件下的溶出度在12 h左右达到最大值,然后趋于平衡。不同pH条件下溶出度曲线显示,随着pH增大,尤其为碱性时,药物溶出度高于其他pH条件,说明pH增加有利于药物的溶出。
2.2.4.2 温度对阿维菌素凝胶微球缓释性能的影响。由图5可知,在20和30 ℃条件下,药物的溶出度均随着时间延长而增加,但总体来看,温度高有利于阿维菌素的快速溶出。
3 结论
该研究以海藻酸钠和氯化钙为成球材料,以壳聚糖和PVA为覆膜材料,戊二醛为交联剂,通过正交试验优化工艺
制备了负载阿维菌素的凝胶微球。最终确定了最优制备条
件,各组分质量分数:海藻酸钠1%、氯化钙4%、壳聚糖2%、PVA2%、戊二醛1.5%。通过对制备的阿维菌素凝胶微球红外光谱分析表明阿维菌素被成功包埋在凝胶微球中。阿维菌素凝胶微球的溶胀性能测定结果表明,凝胶微球在pH=7时溶胀率最大。制备的阿维菌素凝胶微球的药物溶出性能对温度和pH具有响应性,随着pH和温度的升高溶出度增大,均表现出一定的缓释性。
参考文献
[1] 辛露露,张雨,刘宝传,等.阿维菌素凝胶微球的制备及其缓释性能[J].精细化工,2018,35(4):652-657.
[2] 许同桃,金义翠,朱文静,等.微囊化缓释复合农药海藻酸钠-苯磺隆的制备与表征[J].江苏农业科学,2016,44(6):202-204.
[3] 尚青,李国庭,范婷婷.阿维菌素缓释微球的研制[J].河北师范大学学报(自然科学版),2007,31(2):208-211.
[4] 赵明明,杨利,王智,等.24%螺螨酯·阿维菌素悬浮剂的制备及表征[J].农药,2015,54(8):576-579.
[5] FINK D W,DEMONTIGNY P,SHIM J S K.Evolution of a specific fluorogenic derivatization of ivermectin for bioanalytical applications.A review [J].The analyst,1996,121(11):1533-1537.
[6] MACCONNELL J G,DEMCHAK R J,PREISER F A,et al.Relative stability,toxicity,and penetrability of abamectin and its 8,9-oxide[J].Journal of agricultural and food chemistry,1989,37(6):1498-1501.
[7] 张琨,林松,李敬安,等.药物控释用海藻酸钠、壳聚糖、明胶的研究进展[J].国际生物医学工程杂志,2008,31(4):197-200.
[8] SONG H Y,YU W T,GAO M,et al.Microencapsulated probiotics using emulsification technique coupled with internal or external gelation process [J].Carbohydrate polymers,2013,96:181-189.
[9] 杨军星,王琦,王媛媛,等.双重载药多层海藻酸盐-壳聚糖缓释微球的制备及体外释放[J].高等学校化学学报,2015,36(5):1025-1032.
[10] 徐蕾.农药-壳聚糖共聚物微胶囊缓释剂的制备及性能研究[D].哈尔滨:东北农业大学,2013.
[11] 史同瑞,刘宇,苏永福,等.壳聚糖-海藻酸钠微囊形成机理及制备方法研究进展[J].上海畜牧兽医通讯,2015(5):11-13.
[12] 王莹,汪航,曾日中,等.海藻酸钠-聚乙烯醇交联微球制备参数优化研究[J].热带作物学报,2015,36(12):2254-2259.
[13] 刘群,卢芳,曾勇.紫外分光光度法测定阿维菌素预混剂的含量[J].甘肃畜牧兽医,2002,32(1):19-20.
[14] 马萍,祝力,孙淑英,等.海藻酸钙凝胶微球的制备和pH依赖性溶胀[J].中国海洋药物,2003,5:35-37.
[15] 谭真,张雷,张倩.聚乙烯醇/羧甲基纤维素钠交联微球的制备及性能研究[J].塑料工业,2015,43(3):41-44.
[16] 王碧,刘凯,张良英.2,4-D在明胶/壳聚糖微球中的包埋与释放[J].内江师范学院学报,2008,23(6):57-60.

