父亲年龄对体外受精-胚胎移植术后妊娠结局影响的Meta 分析*
沈金华 周雅倩 阳益德 蔡素芬 彭扬琴 李 健** 罗春香** 湖南师范大学医学院,湖南长沙,4003 中信湘雅生殖与遗传专科医院,湖南长沙,40008
1978 年路易斯布朗的出生, 标志着体外受精- 胚胎移植(In vitro fertilization-embryo transfer,IVF-ET)成为治疗不孕症的手段之一[1]。 目前,全世界通过IVF-ET及其衍生技术出生的婴儿已超过800 万[2]。 随着我国二胎政策的开放,接受生育治疗夫妇的年龄也越来越高[3]。已有研究表明[4],母亲年龄的增加会影响胚胎着床及妊娠结局,而男性在辅助生殖技术(Assisted reproductive technology,ART)中也占据着重要作用[5],但是关于父亲年龄对IVF-ET 术后的影响仍存在争议。2017 年Zhong等人研究结果显示,父母年龄越大,不良妊娠结局如流产的风险就越大[6]。然而另外一项研究表明[7],父亲年龄的增长与流产没有明显关系。 对男性而言,有专家认为可将40 岁作为高龄生育的界限[8],其年龄超过40 岁,会导致不良妊娠结局[9]。 因此本研究采用Meta 分析的方法评价父亲年龄超过40 岁与IVF-ET 术后妊娠结局的关系,为临床上提供更可靠的参考依据。
资料与方法
一、文献纳入与排除标准
(一)纳入标准
1.研究类型:队列研究或病例对照研究。 2.研究对象:接受IVF-ET 助孕治疗。 3. 分组:非暴露组:父亲年龄<40 岁,暴露组:父亲年龄≥40 岁。 4. 结局指标:①妊娠;②生化妊娠;③临床妊娠;④流产;⑤活产。
(二)排除标准
1. 非中文和英文文献;2. 重复发表的文献;3. 不能获取所需数据,且与作者联系无果;4. 研究对象接受了其他不孕治疗方式包括宫腔内人工授精、 卵胞浆内单精子注射和胚胎移植前遗传学诊断;5.供精、供卵周期。
(三)妊娠结局定义
1. 妊娠:胚胎移植后尿妊娠试验或血β-HCG 阳性和/或B 超检查有孕囊。
2. 生化妊娠:胚胎移植后,尿妊娠试验或血β-HCG检测阳性确定为生化妊娠。
3.临床妊娠:移植后行B 超检查,有孕囊者确定为临床妊娠。
4. 流产:妊娠<28 周,胚胎或胎儿因某种原因(非人为引产)脱离母体而排出者。
5.活产:分娩时至少有一个新生儿存活。
二、检索策略
计算机检索PubMed、EMBASE、Web of Science、中国知网(CNKI)、中国生物医学文献数据库(CBM)、维普数据库(VIP)和万方数据库(WANFANG Data),搜集比较不同的父亲年龄对IVF-ET 治疗后妊娠结局的影响,检索时限均从建库至2020 年6 月15 日。 中文检索词包括:体外受精、体外受精胚胎移植、体外受精-胚胎移植、IVF-ET、IVF、辅助生殖技术、父亲年龄、男方年龄、男性年龄等;英文检索词包括:Fertilization in Vitro、Assisted reproductive technology、infertility therapy、IVF-ET、IVF、paternal age、father age、male age、old father、aged father 等, 所有检索策略采用主题词[MEDLINE(MeSH),EMBASE(EMTREE)]和自由词组合检索。 以PubMed 为例,具体检索策略如下。
#1 Fertilization in Vitro [Mesh] OR Reproductive Techniques,Assisted[Mesh]
#2 IVF [Title/Abstract] OR infertility therapy [Title/Abstract]OR IVF-ET[Title/Abstract]
#3#1 OR#2
#4 paternal age[Mesh]
#5 father age[Title/Abstract]OR male age[Title/Abstract]OR old father [Title/Abstract]OR aged father[Title/Abstract]
#6#4 OR#5
#7#3 AND#6
三、文献筛选、资料提取和质量评价
由2 名研究者独立筛选文献、 提取资料并交叉核对。 如遇到分歧,则通过讨论或与第三位研究员商议。如有需要,可通过邮件、电话等方式联系原始研究作者以获取信息。 资料提取内容包括:①纳入研究的基本信息:研究题目、第一作者、发表时间等;②研究对象的基线特征和暴露因素;③是否控制女方年龄;④所关注的结局指标。 纳入研究的偏倚风险评价由2 位研究员独立评价,并交叉核对结果。 采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)进行偏倚风险评价,如遇到分歧,通过第三研究员讨论解决[10]。NOS 评价表满分为9 颗星(1 颗星代表1 分),其分数越高,文献质量越好。
四、统计分析
采用Cochrane 协作网提供的Review Manager 5.3软件进行Meta 分析。 采用比值比(odds ratio,OR)及其95%CI 为效应分析统计量。 采用χ2检验分析各文献结果间的异质性, 结合I2判断异质性大小, 检验标准α=0.1。若P>0.1 且I2<50%,提示各研究结果间同质性较好,采用固定效应模型;若P≤0.1 和/ 或I2≥50%,提示各研究结果间存在异质性, 进一步分析导致异质性的原因, 在排除明显临床异质性和方法学异质性的影响后,采用随机效应模型合并效应量。 发表偏倚的分析采用漏斗图进行判断。
结 果
一、文献筛选流程及结果
通过数据库检索初检获得相关文献1167 篇,经过筛选后,最后纳入本研究11 篇[11-21],其筛选过程及结果如图1 所示。
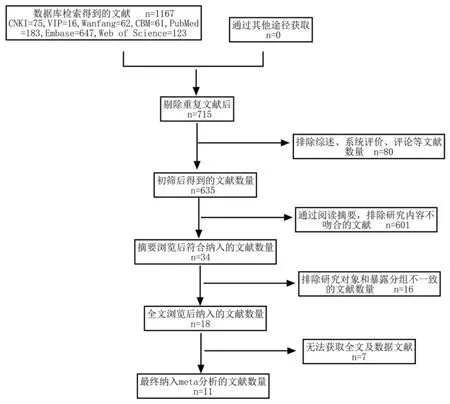
图1 文献筛选流程及结果
二、纳入文献的基本特征及质量评价
纳入文献11 篇均为队列研究,来自中国的研究共有8 篇,其他地区的研究共有3 篇,根据纽卡斯尔- 渥太华量表质量评价标准其得分均≥6 分,其一般基本特征和偏倚风险评价结果见表1。
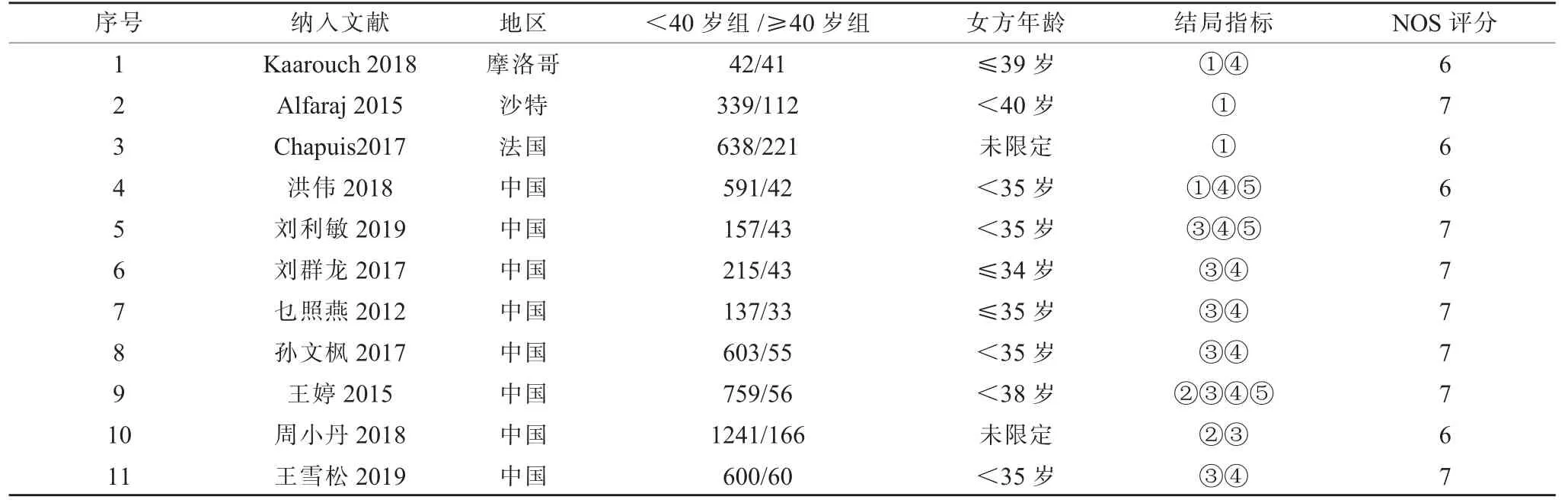
表1 纳入文献基本信息
三、Meta 分析结果
(一)妊娠相关指标
妊娠指标共纳入11 项研究[11-21]。经过异质性检验发现I2=0%(P=0.56),说明异质性非常小,采用固定效应模型,Meta 分析结果显示:父亲年龄≥40 岁组妊娠率低于年龄<40 岁组, 差异具有统计学意义(OR=0.80,95%CI:0.69-0.93,P=0.004)(图2A)。 生化妊娠指标共纳入2 项研究[18,19]。 经过异质性性检验发现I2=11%(P=0.29),说明异质性非常小, 采用固定效应模型,Meta 分析结果显示:父亲年龄≥40 岁组生化妊娠率低于年龄<40 岁组,差异具有统计学意义(OR=0.75,95%CI:0.57-0.99,P=0.04)(图2B)。 临床妊娠指标共纳入7 项研究[14-20]。 经过异质性性检验发现I2=0%(P=0.67),说明异质性非常小,采用固定效应模型,Meta 分析结果显示:父亲年龄≥40 岁组临床妊娠率低于年龄<40 岁组, 差异具有统计学意义(OR=0.74,95%CI:0.61-0.91,P=0.004)(图2C)。 根据纳入研究所在地区亚分组,共纳入8 篇文献[13-20],结果显示在中国,父亲年龄≥40 岁组的妊娠率低于年龄<40 岁组,差异具有统计学意义(OR=0.75,95%CI:0.62-0.90,P=0.002)(图2D);而在其他地区共纳入3 篇文献[11,12,21],父亲年龄≥40 岁组的妊娠率与年龄<40 岁组相比, 差异不具有统计学意义(OR=0.89,95%CI:0.70-1.14,P=0.37)(图2E)。 针对IVF-ET 术后妊娠这一结局指标绘制漏斗图,显示各项研究左右分布基本对称,结果如图3 所示。
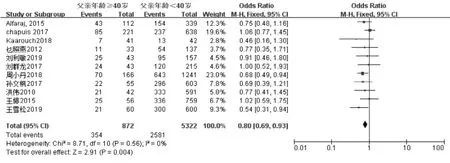
图2A 父亲年龄与IVF-ET 术后妊娠率的Meta 分析
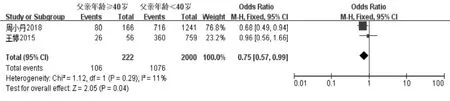
图2B 父亲年龄与IVF-ET 术后生化妊娠率的Meta 分析
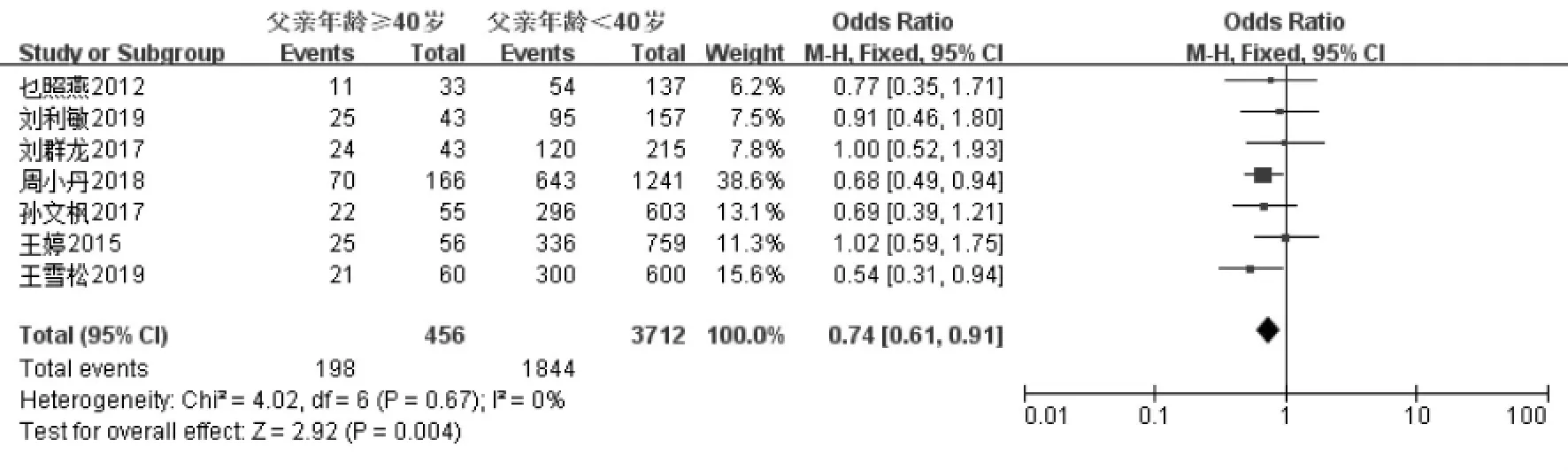
图2C 父亲年龄与IVF-ET 术后临床妊娠率的Meta 分析
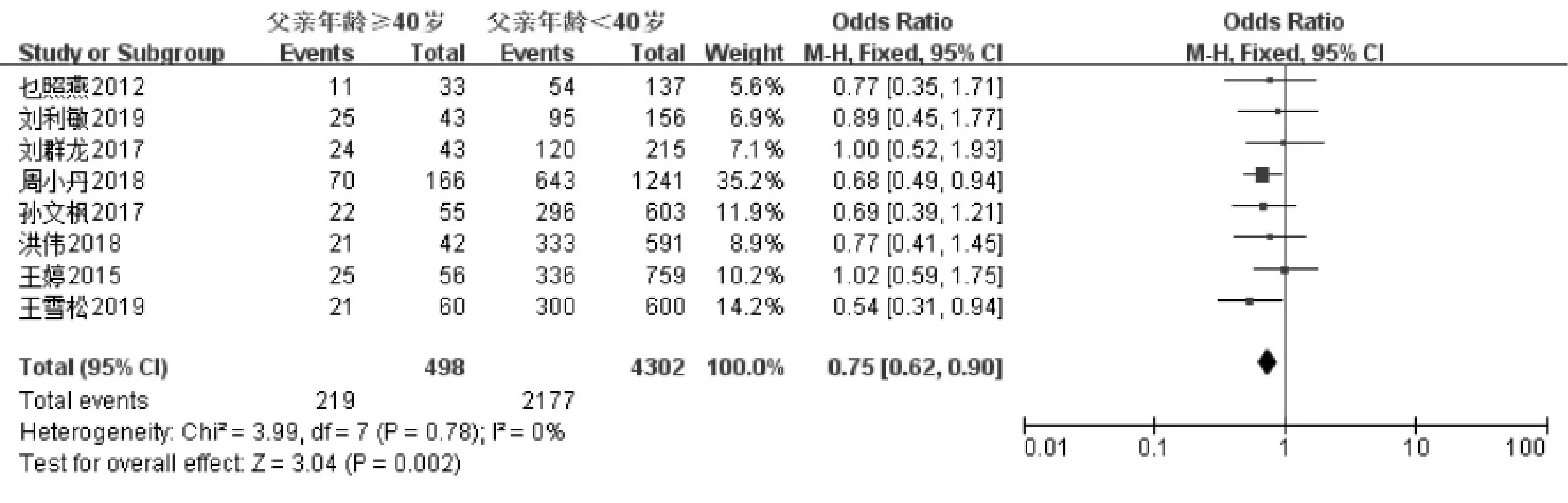
图2D 中国父亲年龄与IVF-ET 术后妊娠率的Meta 分析
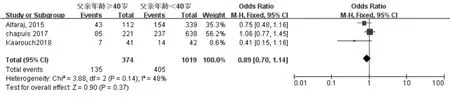
图2E 其他地区父亲年龄与IVF-ET 术后妊娠率的Meta 分析
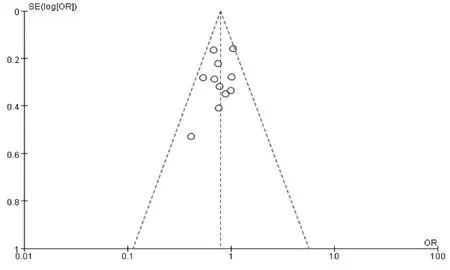
图3 IVF-ET 术后妊娠指标的漏斗图
(二)流产率
未限定母亲年龄时共纳入8 项研究[11,13-18,20],经过异质性检验发现I2=0%(P=0.77),异质性非常小,采用固定效应模型,Meta 分析结果显示:父亲年龄≥40 岁组的流产率高于年龄<40 岁组, 差异具有统计学意义(OR=1.62,95%CI:1.05-2.51,P=0.03)(图4A)。 控制母亲年龄≤35 岁共纳入6 项研究[13-17,20],经过异质性检验发现I2=0%(P=0.54),异质性非常小,采用固定效应模型,Meta 分析结果显示: 父亲年龄≥40 岁组的流产率与年龄<40 岁组相比, 差异无统计学意义(OR=1.57, 95%CI:0.94-2.62,P=0.08)(图4B)。 控制母亲年龄<38 岁共纳入7项研究[13-18,20]。 经过异质性性检验发现I2=0%(P=0.67),异质性非常小,采用固定效应模型,Meta 分析结果显示:父亲年龄≥40 岁组的流产率高于年龄<40 岁组, 差异具有统计学意义 (OR=1.63,95%CI:1.04-2.54,P=0.03)(图4C)。 针对IVF-ET 术后流产这一结局指标绘制漏斗图,显示各项研究左右分布基本对称,结果如图5 所示。

图4A 未控制母亲年龄,父亲年龄与IVF 术后流产率的Meta 分析
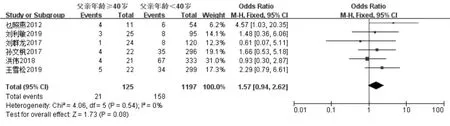
图4B 控制母亲年龄≤35 岁,父亲年龄与IVF 术后流产率的Meta 分析
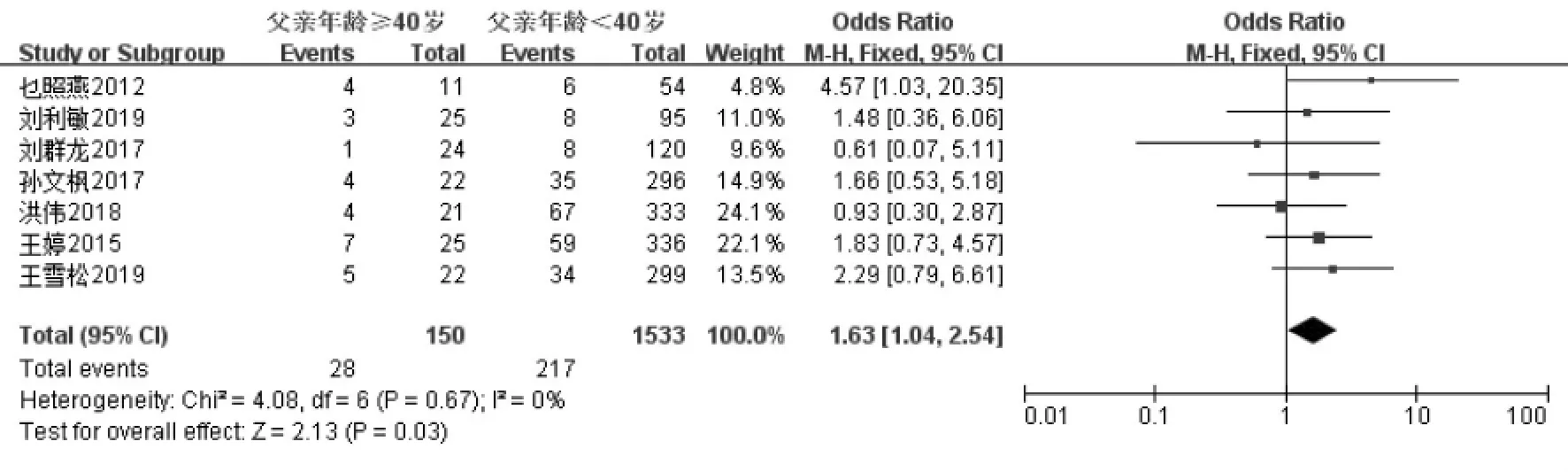
图4C 控制母亲年龄<38 岁,父亲年龄与IVF 术后流产率的Meta 分析
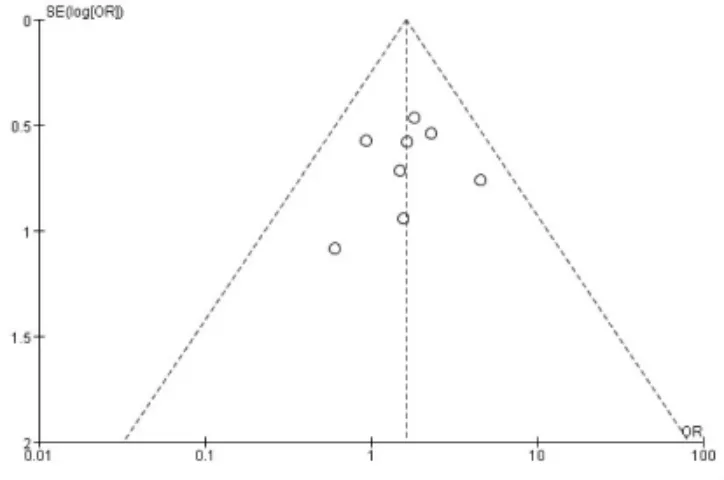
图5 IVF-ET 术后流产指标的漏斗图
(三)活产率
共纳入3 项研究[13,14,18],经过异质性检验发现I2=0%(P=0.66),异质性非常小,采用固定效应模型,Meta 分析结果显示:父亲年龄≥40 岁组与年龄<40 岁组的活产率相比,差异无统计学意义(OR=0.74,95%CI:0.40-1.37,P=0.34)(图6)。 针对IVF-ET 术后活产这一结局指标绘制漏斗图,显示各项研究左右分布基本对称,结果如图7 所示。
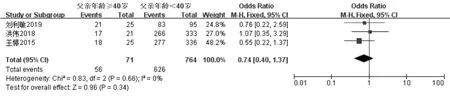
图6 父亲年龄与IVF-ET 术后活产率的Meta 分析
讨论
本研究一共纳入11 篇文献, 文献整体质量良好,所有研究各组的基线均具有可比性,选择偏倚风险小。虽然纳入的文献在母亲年龄、所在地区、不孕原因等方面存在一定的差异,但是所有研究异质性检验结果I2<50%,不影响数据的合并。
图7 IVF-ET 术后活产指标的漏斗图
随着社会的发展,生殖技术的不断创新,高龄夫妇的人数也越来越多, 其不良妊娠结局也受到了广泛的关注。为达到优生优育的目标,研究父亲高龄对IVF-ET术后的妊娠结局显得尤为重要。 本次Meta 分析结果显示,与年龄<40 岁的男性相比,年龄≥40 岁的男性在接受IVF-ET 治疗后会降低妊娠的发生包括生化妊娠、临床妊娠,由此可见,父亲年龄≥40 岁可能在一定程度上会影响胚胎在子宫的着床。 亚组分析结果显示,在中国父亲年龄≥40 岁会降低接受IVF-ET 治疗后的妊娠率,而在其他地区未发现两者的关联,但不一定意味着其他地区父亲≥40 岁不影响, 可能与本研究中纳入的国外文献数量有限有关系,也有可能与种族、人群特点等有关系。 同时,本研究结果显示:在控制母亲年龄≤35 岁,父亲年龄≥40 岁与父亲年龄<40 岁相比,其发生流产的风险不会升高。当在控制母亲年龄<38 岁时,父亲年龄≥40 岁会增加流产的风险。 推测随着母亲年龄的增大,IVF-ET 治疗后流产率的风险呈上升趋势。活产是辅助生殖技术的最终目的, 也是临床医生关注的重要指标之一,其影响因素较多,机制复杂。 2019 年郑州大学的一项研究结果显示[22],在IVF-ET 周期中并未发现父亲年龄对活产有影响,与本研究结果一致,与父亲年龄<40 岁相比,当父亲年龄≥40 岁时一旦成功妊娠后活产率将不受影响,可能与本次Meta 分析中纳入文献数量有限有关,今后有必要进一步研究。
目前多项研究表明,父亲年龄超过40 岁,其怀孕的可能也会降低[9,23],可能与男性在40 岁以后其精子质量下降有关[24]。 男性损伤精子的增加对IVF-ET 术后的受精能力有负面影响[25]。 男性年龄越大,精子DNA 损伤、 端粒缩短等促进细胞衰老或凋亡的细胞过程就越容易出现缺陷,影响胚胎着床[26-27],从而影响妊娠的成功率[28]。 同时精子DNA 损伤会增加IVF-ET 术后流产的风险[29]。精原细胞每隔16 天进行一次有丝分裂,随着父亲年龄的增长,其生殖细胞发生更多的有丝分裂,并面临着更高的DNA 断裂风险和有害点突变频率,从而对遗传变异、疾病和进化产生影响,增加流产的风险[30]。此外高龄夫妇年龄的交互作用也可能会增加流产的风险。 这提示我们尽管技术上足够成熟,但是针对高龄夫妇应该增加遗传咨询,改善IVF-ET 术后的妊娠结局。
本研究尚存在不足:①本次Meta 分析仅检索中英文数据库,并公开发表的,可获取全文的文献,可能存在文献收录不全;②纳入的研究在促排卵方案、不孕不育原因等方面存在一定的差异,文献数量有限,并未在此基础上进行亚组分析;③由于纳入文献的数量有限,上述结论尚待更多的研究予以验证。
综上,在接受IVF-ET 治疗的不孕夫妇中,父亲年龄≥40 岁会降低妊娠率,增加流产风险,但是一旦成功妊娠活产率不会受到影响。 这提示我们应该更加重视父亲高龄对妊娠结局的负面影响,应减少高龄生育,鼓励高龄父亲的生育遗传咨询,从而增加成功妊娠率,促进优生优育。

