腹腔镜前列腺癌根治术联合辅助疗法治疗高危前列腺癌的早期效果分析
王大明 谢栋栋 于德新 丁德茂 张志强 刘志奇 孙 伟 李博闻
安徽医科大学第二附属医院泌尿外科(合肥 230000)
近年来,随着人口老龄化及生活水平的提高,我国前列腺癌的发病率和病死率均呈持续增长趋势[1]。 由于我国PSA 筛查存在地区差异, 约70%的患者发现时已是高危进展性前列腺癌,甚至是晚期[2]。《2014 版中国泌尿外科疾病诊断治疗指南》 对高危前列腺癌的定义:PSA >20 ng/ml 或临床分期≥T2c 或Gleason 评分≥8分[3]。 中国泌尿外科学会(CUA)和欧洲泌尿外科学会(EUA) 指南均提出手术应作为高危前列腺癌综合治疗的手段之一[3,4],但有研究指出对单纯接受根治术的高危前列腺癌患者术后进行跟踪, 术后生化复发率可达55%~70%[5], 因此高危前列腺癌治疗可以手术为核心的包括新辅助治疗、术后辅助治疗等综合性治疗,目前国内无统一标准, 治疗方式多样, 本研究回顾性分析2013 年6 月至2017 年9 月于我院行手术及联合辅助治疗的高危前列腺癌患者, 探讨手术与各种辅助治疗结合的初期效果,现报道如下:
资料和方法
一、一般资料
收集2013 年6 月至2017 年9 月我科前列腺癌患者信息,纳入标准:诊断为高危前列腺癌,行腹腔镜前列腺癌根治术,随访信息齐全。 排除标准:初始资料不全;肿瘤侵犯直肠、盆壁、骨转移>3 处或远处转移;随访过程中信息不全;随访间隔时间>3 个月;随访中治疗方案更改或外院治疗随访;生存期小于24 个月。 根据纳入和排除流程图(见图1),共有69 例高危前列腺癌患者纳入, 根据治疗方式不同分为腹腔镜前列腺癌根治术加上术后长期行内分泌治疗(radical prostatectomy+adjuvant hormone therapy,RP+AHT) 组37 例、术前新辅助内分泌治疗加上腹腔镜前列腺癌根治术及术后再行内分泌治疗组(neoadjuvant hormone therapy+radical prostatectomy+adjuvant hormone therapy,NHT+RP+AHT)组21 例、术前新辅助化疗联合雄激素剥夺治疗加上腹腔镜前列腺根治术及术后再行内分泌治 疗(neoadjuvant chemohormonal therapy + radical prostatectomy + adjuvant hormone therapy,NCHT+RP+AHT)11 例。
二、治疗方法
腹腔镜下前列腺癌根治术加上盆腔淋巴结清扫术,先清扫髂外动脉,下至腹股沟内环,上至输尿管与髂外动脉交叉处, 髂外动脉与髂外静脉之间淋巴结亦清除。 沿髂总动脉向下清扫髂内动脉,清扫闭孔旁淋巴结,常规探查骶前、髂总淋巴结,如术前影像学检查提示或术中探查发现髂总、骶前淋巴结可疑则一并清扫。两侧清扫的淋巴结逐个分离、 标记解剖部位并送病理检查,然后切除前列腺。
内分泌治疗, 比卡鲁胺50 mg 每日1 次口服加上戈舍瑞林3.6 mg 或亮丙瑞林3.75 mg 每月1 次皮下注射或曲谱瑞林3.75mg 每月一次肌注。
新辅助化疗联合雄激素剥夺治疗: 多西他赛(75 mg/m2,静脉滴注,第1 天)联合口服泼尼松(5 mg,每天2 次,第1~21 天)的3 周方案化疗,在输注多西他赛前12、3 和1 h,分别口服地塞米松7.5 mg,同时接受亮丙瑞林或曲谱润林的雄激素剥夺治疗。
三、研究目标
主要研究目标为PSA 无进展生存期(Progressive-free survival,PFS),即从开始前列腺癌治疗至进展为生化复发的时间, 三组术后并发症发生情况(根据Clavien-Dindo 严重程度分级系统进行分级)、尿控恢复情况(每日使用0~1 张尿垫为尿控基本恢复正常,每日使用2~3 张为轻度尿失禁)、病理切缘、术前新辅助治疗后的病理变化。 住院或门诊定期复查,每1-3 月复查PSA、睾酮、肝功能等, 每6~12 月复查超声、MRI 及骨骼ECT 等,随访时间24~60 月,中位随访时间41 月。

图1 高危前列腺癌纳入、排除及分组流程图
四、统计方法
采用SPSS19.0 统计软件处理数据,Kolmogorov-Smirnov 方法检验计量资料是否符合正态分布,非正态分布的资料用M(全距)表示,计数资料用百分比表示,采用kruskal-wallis 检验和卡方检验比较, 卡方检验组间比较采用Bonferroni 校对检验,应用GraphPad Prism分析PSA 无进展生存期,以P<0.05 为差异有统计学意义。
结 果
三组在年龄、BMI、初始PSA、前列腺体积、Gleason评分、TNM 分期比较无差异(P>0.05)。RP+AHT 组术后AHT 疗程21(8-24)次;NHT+RP+AHT 组术前NHT 疗程3(3~8)次,术后AHT 疗 程18(10~24)次;NCHT+RP+AHT 组术前NCHT 疗程4(3-6)次,术后AHT 疗程13(7-18)次。(见表1)
随访时间为24-60 月,RP+AHT 组进展为生化复发例数22 例(59.5%),NHT+RP+AHT 组进展例数10例(47.6%),NCHT+RP+AHT 组进展例数6 例(54.5%),PSA 无进展生存期及术后病理示切缘阳性例数三组比较无差异(P>0.05)(表2)。 三组患者采用GraphPad Prism 分析PSA 无进展生存曲线(图2),无统计学差异(P=0.65)。
术中并发症:RP+AHT 组1 例直肠损伤,术中予以缝合修补, 术后禁食及肠外营养支持治疗后治愈;NCHT+RP+AHT 组1 例术中大出血,予以输血400ml。术后并发症Clavien-Dindo 分级, 三组无IV 级和V 级并发症,RP+AHT 组:Ⅰ级6 例(发热和疼痛),Ⅱ级9例(吻合口漏尿4 例、不全性肠梗阻1 例、出血予以输血1 例、下肢静脉血栓抗凝治疗1 例、淋巴漏1 例、阴囊及下肢水肿1 例);NHT+RP+AHT 组:Ⅰ级6 例(发热和疼痛),Ⅱ级3 例(吻合口漏尿2 例、出血予以输血1 例),Ⅲ级1 例(1 例患者术后2 天内出现每日尿量约400ml,肌酐进行性升高,最高达532umol/L,诊断为急性肾功能不全,排除药物毒性和肾前性因素,行CT 检查示双肾积水,输尿管扩张,局麻行膀胱镜检查示吻合口距离双侧输尿管口较近,周围损伤水肿所致,予以输尿管置管后好转);NCHT+RP+AHT 组:Ⅰ级3 例(发热和疼痛),Ⅱ级2 例(吻合口漏尿),并发症发生率三组无显著差异(P>0.05)(表2)。 三组术后1 月、3 月、6 月尿控恢复例数无显著差别(P>0.05)(表2),术后12 月三组患者尿控基本完全恢复。
NHT+RP+AHT 组术后病理变化示:1 例微小残留灶(少量癌细胞及大量泡沫细胞),1 例术前穿刺Gleason 评分4+4 分, 术后为4+3 分, 其它未见明显变化。NCHT+RP+AHT 组术后病理变化示:2 例术后病理完全缓解(pathologic complete response,pCR)大量泡沫细胞未见癌细胞,2 例微小残留灶, 余7 例病理未见明显变化。
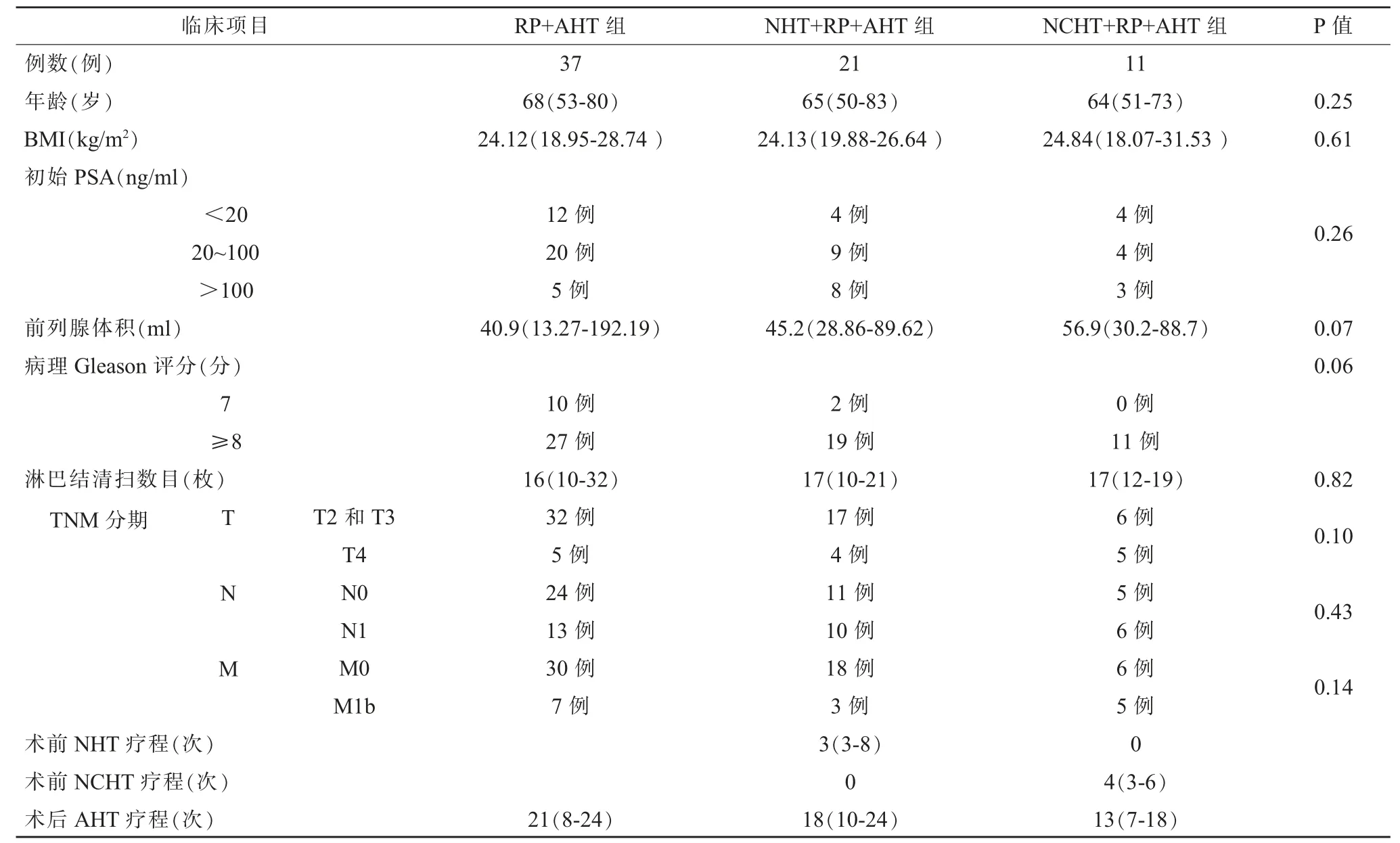
表1 各组一般临床资料对比及治疗疗程
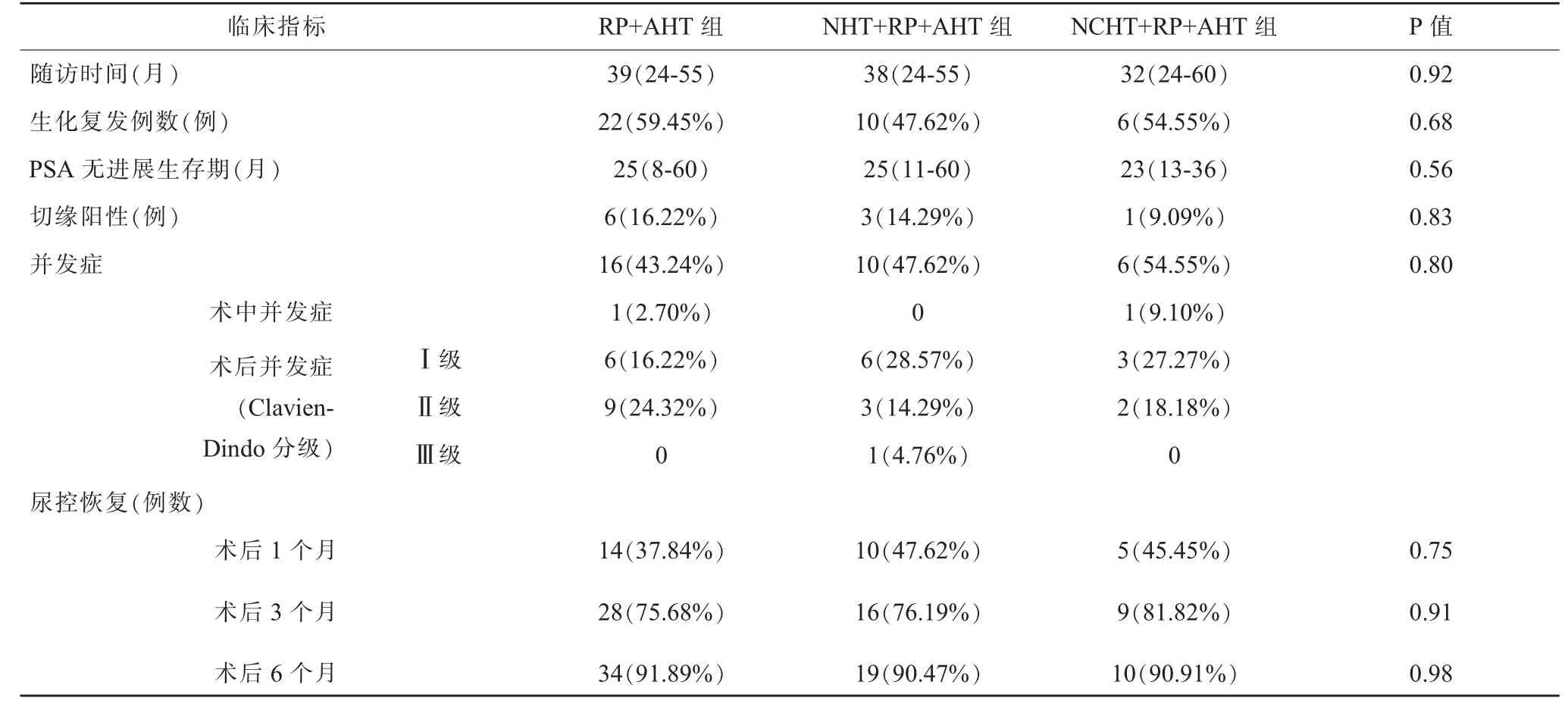
表2 三组术后临床指标比较
讨 论
高危前列腺癌患者在总体生存率和肿瘤特异性生存率方面可以从RP 治疗中获益,根治术能很好地控制局部原发肿瘤,以及根据术后病理Gleason 评分及分期采取监测及辅助治疗, 而且是决定开展综合治疗方法和时机的重要指标[6]。 随着手术技术进步及辅助治疗的发展, 目前对于少量骨转移的前列腺癌患者可行减瘤性根治性前列腺切除术(cytoreductive prostatectomy,CRP),可延长患者的无疾病进展生存期和总生存期,同时手术并发症并未增加[7]。CRP 的目的在于减少肿瘤的负荷、提高辅助治疗效果,减少肿瘤导致的血尿和疼痛等,但不能达到根治的目的,因此,在选择病例时需要进行严格的筛选或术前多学科讨论, 目前CRP 研究的焦点在于少量寡转移的前列腺癌患者, 对于骨转移病灶>5 处、盆腔局部固定无法切除、身体状态无法耐受手术或预期寿命不长的患者,均为CRP 的禁忌证,另外无论CRP 还是RP, 盆腔局部应尽量予以根治性切除,在不增加并发症的同时,尽量减少切缘阳性率,这样术后辅助治疗效果最佳[8]。 目前对于高危前列腺癌不推荐常规行扩大盆腔淋巴结清扫,虽然有利于病理分期,但Yaxley 等[9]研究中、高危前列腺癌患者接受扩大和标准淋巴结清扫的治疗效果比较, 扩大淋巴结清扫对患者的预后并无显著改善。 本研究三组在清扫淋巴结数目上对比无差别。
对于高危前列腺癌辅助治疗方法及时机的选择目前有较多争议,Shelley 等[10]指出根治手术前的辅助内分泌治疗可以改善病理结果, 但不能提高无生化复发生存期和总生存期,2016 年EAU、NCCN 指南均不推荐除临床试验外对高危前列腺癌患者行术前NHT[11-12],但近期Tosco 等[13]研究1170 例单纯行RP 和403 例术前行NHT 再行RP 对比前列腺癌相关死亡率, 发现术前NHT 能明显降低前列腺癌患者相关死亡率,Shintaro等[14]研究指出根治术前化疗能明显降低高危前列腺癌生化复发风险及改善病理。 本研究通过对比术前新辅助内分泌治疗、 单纯术后内分泌治疗及术前新辅助化疗治疗,虽然三组在PSA 无进展生存期、术后病理切缘阳性例数上无明显差别,但术前NHT 或联合化疗能给分级、分期较高的患者提供手术机会,可减少切缘阳性及提高切除率,不增加术后并发症及尿失禁的发生,并出现明确的病理改善, 尤其新辅助化疗组2 例患者出现完全病理缓解(pCR),2 例患者术后病理示微小残留癌细胞。 有研究指出激素敏感性前列腺癌为一种高度异质性疾病, 在初治阶段就已存在雄激素敏感的细胞克隆和雄激素不敏感的细胞克隆, 早期化疗可以极早地抑制甚至杀灭雄激素受体阴性的细胞克隆, 降低瘤负荷,从而使前列腺癌患者远期生存获益[15]。 虽然三组手术并发症发生率无差别, 但RP+AHT 组术中出现1例直肠损伤, 其它两组未出现, 对于瘤体较大, 术前MRI 检查示前列腺与直肠分界不清的高危前列腺癌患者,术前予以新辅助治疗待瘤体缩小,无明显粘连后再行手术可避免术中直肠损伤。 对于术中膀胱颈口切除较多的,重建吻合时注意双侧输尿管口位置,避免造成输尿管口损伤,必要时术中放置支架管予以标记。 本研究中术前无新辅助治疗直接行根治性手术患者占多数,无进展生存期与其它两组无差别,除手术切除率高外,术后及时、长程内分泌治疗起到重要作用,无论术前有无辅助治疗, 高危前列腺癌术后即刻予以内分泌治疗可控制疾病进展及转移, 有助于改善高危前列腺癌的预后[16]。

图2 三组PSA 无进展生存期曲线对比
目前在高危前列腺癌治疗方面,国内无统一标准,本研究发现术前是否新辅助治疗在无进展生存期上无明显差别,可能研究例数较少,受限于单中心、回顾性研究,造成结果有所偏倚,需要多中心、大样本的长时间随访研究, 但发现术前新辅助治疗出现明显的病理改善,为后期治疗提供帮助,延长总体生存期,内分泌治疗目前仍为高危前列腺癌治疗的基石, 联合化疗使患者受益明显,为部分患者提供手术机会,增加手术切除率及减少切缘阳性, 术后即刻及长程的内分泌治疗有助于控制疾病进展。

