纳米金溶胶的绿色制备及其在三聚氰胺可视化检测中的应用
周美双, 李琼霞, 付云芝
(海南大学理学院, 海口 570228)
由于三聚氰胺(Melamine, Mel)中氮含量高达66.6%且其性质类似于蛋白质,故常被非法添加至奶粉乳制品、饲料或其他食品中[1].长期或过量摄入Mel不仅会损害人类肾脏、生殖系统和泌尿系统等,而且可进一步诱发膀胱癌[2].2017年, Mel被报道可能为内分泌干扰物和神经毒物[3-4].目前, 检测Mel的方法主要有电化学法[5]、气相色谱-质谱法[6]、高效液相色谱法[7]、毛细管电泳法[8]和拉曼光谱法[9]等,上述方法大多须借助大型仪器设备且费用较高, 人力、物力资源消耗多.通过比色法和紫外光谱分析[10]检测Mel则具有操作简单、成本低和耗时短等优点, 现已成为研究热点.AuNPs因具有局域表面等离子体共振特性以及独特的尺寸和粒子间距离相关的光学性能, 可被广泛用于Mel的比色分析[10-11].本文拟通过具有保护能力的海草提取液直接生物还原氯金酸来绿色制备AuNPs溶胶, 并采用比色法和紫外-可见吸收光谱分析检测Mel.
1 实验
1.1 试剂与仪器
氯金酸(HAuCl4)、抗坏血酸、尿素、谷氨酸、缬氨酸、苯丙氨酸、苏氨酸、赖氨酸、亮氨酸、甲硫氨酸、异亮氨酸和无水碳酸钠均购自中国国药集团; Mel单体购自上海梯希爱(TCI)仁成工业发展有限公司,无水氯化钙、氯化钠、氢氧化钠、乙腈和无水乙醇购自西陇有限公司; 硫酸铵、活性炭粉、氯化钾和葡萄糖购自广州化学试剂厂;三氯乙酸和乳糖购自上海阿拉丁生化科技股份有限公司;上述试剂均为分析纯.海草购买于海南省海口市东门市场; 水为超纯水.
UV-2500紫外-可见分光光度仪(岛津公司,日本); TENSOR 27傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)仪(布鲁克公司, 德国);ESCALAB 250Xi X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)仪(赛默飞世尔科技公司, 美国); JEM-2100透射电子显微镜(transmission electron microscopy, TEM)(电子株式会社, 日本).
1.2 海草提取液的制备
将2.0 g洗净晒干粉碎后的海草加入80 mL无水乙醇中, 混合后于80 ℃下磁力搅拌1 h, 提取液冷却至25 ℃后抽滤, 加入适量活性炭粉静置24 h脱色,抽滤去除活性炭粉, 将滤液离心,加水稀释10倍后得海草提取液, 置于4 ℃冰箱保存备用.所有玻璃仪器均用王水(V(浓硝酸)∶V(浓盐酸)=1∶3) 洗涤.
1.3 AuNPs溶胶的制备
取海草提取液1.00 mL, 调节其pH至12.12, 向其中加入5 mL 1 mmol·L-1氯金酸溶液, 设定反应温度为50 ℃, 于水浴锅中磁力搅拌30 min,得酒红色AuNPs溶胶.分别讨论反应温度、海草提取液用量及提取液初始pH值等3个因素对制备AuNPs溶胶的影响, 固定其中2个变量, 将另一变量设定一个梯度,探究最优反应条件.设计温度变量的梯度为25,40,50,60,70,80 ℃; 提取液用量的梯度为1.00,2.00,3.00,4.00,5.00,6.00 mL;提取液初始pH的梯度为11.72, 11.90, 12.12, 12.23, 12.33, 12.42.
1.4 AuNPs溶胶及与Mel混合反应后溶液(Mel-AuNPs)的紫外-可见光谱测定
取2.00 mL最优反应条件下所制备出的酒红色AuNPs溶胶, 向其中加入3.00 mL浓度为0.6 μmoL·L-1的Mel溶液, 于25 ℃下混合反应10 min后进行紫外-可见吸收光谱测定.
1.5 Mel的可视化检测
准确称取0.100 0 g Mel单体粉末标准品于25 mL烧杯中, 加水溶解并定容至100 mL, 得到1.0 g·L-1Mel储备液.将其配制成浓度分别为0.0, 0.1, 0.2, 0.3, 0.4, 0.45, 0.5, 0.55, 0.6, 0.7, 0.8, 0.9, 1.0 μmoL·L-1的标准溶液.将3 mL上述不同浓度的Mel标准溶液加入2 mL酒红色AuNPs溶胶中, 于25 ℃下混合反应10 min, 观察混合液颜色变化并进行紫外-可见吸收光谱测定.
2 结果与讨论
2.1 反应条件的优化
1) 反应温度.固定海草提取液用量为1.00 mL和初始pH为12.12, 不同反应温度时所得AuNPs溶胶的紫外-可见吸收光谱如图1(a)所示.由图1(a)可见: 随着温度的升高,所制备AuNPs溶胶的颜色由浅灰色变为浅紫色、最终变为酒红色, AuNPs溶胶的紫外最大吸收峰强度呈现先增大后减小的趋势,紫外最大吸收峰位置和峰宽在50 ℃后基本保持不变; 当反应温度为60 ℃时, 生成AuNPs数量最多且粒径分布较均匀;反应温度超过50 ℃后对所制备AuNPs的粒径分布影响较小, 但会影响AuNPs成核数量.根据能斯特方程, 温度是影响海草提取液中有效还原物质还原电位的因素之一, 低温不利于还原物质还原电位的下降, 从而不利于对氯金酸的还原成核.鉴于实验选择最节能的反应条件,将后续的反应温度设定为50 ℃.
2) 海草提取液用量.固定反应温度为50 ℃和海草提取液初始pH为12.12, 不同提取液用量下所得AuNPs溶胶的紫外-可见吸收光谱如图1(b)所示.由图1(b)可见: 随提取液用量的增加, 所制备AuNPs溶胶的颜色无明显变化, 均为酒红色; 当海草提取液用量由1.00 mL逐渐增至6.00 mL时, 紫外最大吸收峰的峰位逐渐红移,相应的强度逐渐降低.根据吸收峰位置和半峰宽,可以判定当提取液用量为1.00 mL时生成的AuNPs粒径最小, 分布最好.其原因是植物提取液用量越大,体系中的海藻酸越多,海藻酸间的羧基可能失水交联,增强了液体的黏度,从而阻碍Au3+的运动, 使得Au3+被锚定在海藻酸某个部位成核并长大,所以生成的纳米颗粒得不到保护,容易形成较大颗粒.
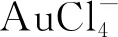
2.2 AuNPs溶胶及与Mel反应后溶液(Mel-AuNPs)的UV-Vis分析
图2给出了AuNPs和Mel-AuNPs的紫外-可见吸收光谱图, 且在图中显示了AuNPs和Mel-AuNPs的颜色.由图2可知, 加入Mel标准液后的AuNPs溶胶由酒红色变为蓝灰色, 最大紫外吸收峰的峰值与峰形均出现明显变化, 表明Mel的加入会引发AuNPs颗粒聚集, 从而导致溶液颜色变化及紫外吸收的显著不同.由此可知该AuNPs溶胶对Mel有响应, 可应用于Mel的可视化检测.
2.3 FTIR分析
图3为海草提取液、AuNPs及Mel-AuNPs等3个样品的红外分析光谱图.由图3可见: 1) 海草提取液的红外光谱中, 在3 386 cm-1和3 163 cm-1处有2个较强的吸收峰是O—H引起的伸缩振动, 表明羟基的存在; 1 640 cm-1和1 402 cm-1处出现的尖峰可归属于C=O伸缩振动, 这可能是由于羧酸的存在所致; 1 205 cm-1和1 044 cm-1处的峰归因于C—O或C—O—C的拉伸振动; 海草提取液中存在羟基、羧基等都有助于AuNPs的形成; 2) 在AuNPs的FTIR中, 3 425 cm-1处的吸收峰归因于O—H的伸缩振动; 1 578, 1 420 cm-1处2个峰可归因于—COO的反对称和对称拉伸振动, 可能来自羧酸盐; 1 044, 1 014 cm-1处的吸收峰是由于C—O—C的拉伸振动; 3) 在Mel-AuNPs的红外光谱中, 3 469, 3 419, 3 335, 3 134 cm-1处的4个尖峰均为Mel的—NH2伸缩振动; 1 654 cm-1为Mel中N—H弯曲振动; 1 555, 1 469, 1 440 cm-1处3个吸收峰都在Mel的另一光谱特征区域1 400~1 600 cm-1范围内, 归因于Mel中1,3,5-三嗪环的C=N伸缩振动; 在1 030 cm-1和815 cm-1处的峰对应于Mel中三嗪环中的C—N伸缩振动[12].此外, 在 3 134 cm-1和1 198 cm-1处出现2个吸收峰可能预示Mel和AuNPs溶胶的结合[13].
2.4 XPS分析
对AuNPs和Mel-AuNPs样品进行XPS研究以获得样品的表面元素组成, 结果如图4所示.由图4可见 :1) 在Mel-AuNPs的元素扫描谱图中出现明显的氮信号, 表明有Mel被AuNPs吸附在表面; 2) Mel-AuNPs的N 1s光谱显示在398.16 eV和399.05 eV有2个分离良好的峰, 分别属于—N=C和—NH2, 其峰丰度大小与Mel的N 1s特征XPS峰一致[14]; 3) 2个样品Au 4f光谱谱图中的Au峰位并未见明显位移, 均可分配给Au0; 4) AuNPs和Mel-AuNPs的C 1s的信号峰位极为相似, 均可被分解为两个清晰可辨的峰, 表明存在不同类型的碳键: 284.8 eV(AuNPs)和284.9 eV(Mel-AuNPs)处的峰可归因于C—C、C—O、C—O—C; 288.2 eV处的峰属于羰基碳(—C=O)[15], 这些结果与FTIR分析中证实的AuNPs表面含有羧基相一致; 5) 2个样品的O 1s峰存在较小差异, AuNPs存在531.1 eV和535.8 eV两个分离峰,前者与—C—O—C、—OH、—COOH的存在相关, 后者可归因于羰基碳(—C=O); Mel-AuNPs的分析结果中显示出531.3 eV和534.9 eV两个分离峰, 这表明在Mel-AuNPs表面有羧酸分子保留.
2.5 TEM分析
图5为AuNPs和Mel-AuNPs的TEM图.由图5可知, AuNPs的粒径约为8~11 nm, 且呈现单分散状态,当加入Mel标准液后颗粒呈聚集状态.这是由于AuNPs具有局域表面等离子体共振特性和其光学特性, 当Mel加入后AuNPs会发生聚集.保护在AuNPs表面的分子以海藻酸居多,作为桥梁分子的Mel的加入,使得氨基与羧基发生失水缩合作用,促使AuNPs间的聚集.
2.6 Mel的可视化检测
图6为与不同浓度Mel标准液混合后的AuNPs的紫外-可见吸收光谱图.由图6可见: 随Mel浓度的增加, 紫外吸收峰形状和峰值逐渐变化, 且AuNPs溶胶颜色由酒红色变为紫色, 最终变为蓝黑色, 表明AuNPs溶胶由分散态向聚集态发生转变.这是由于Mel中的氨基与羧基发生失水缩合作用,造成AuNPs间的聚集.当Mel含量越高时,体系中氨基的含量越多,失水缩合程度加剧,从而加剧颗粒的聚集程度.当AuNPs溶胶中所含有Mel标准液的浓度足够大时, 该体系不稳定, 待一段时间后会产生聚沉,上层液呈无色透明状.
图7为Mel标准液物质的量浓度与吸光度比值A650/A520关系曲线.如图7可知, 当Mel标准液浓度为0.4~0.8 μmol·L-1时, Mel-AuNPs在波长为650 nm和520 nm下的吸光度比值A650/A520与Mel标准液浓度存在正相关关系,标准曲线可表示为A650/A520=3.211 15c(Mel)-1.049 17(R2=0.989), 检出限为0.359 μmol·L-1, 远低于美国FDA和欧盟规定的牛奶中三聚氰胺的最大残留标准2.5 mg·L-1(即20 μmol·L-1).
2.7 抗干扰实验
现配制浓度均为Mel标准溶液浓度100倍的各物质溶液, 即浓度均为60 μmol·L-1的NaCl、KCl、CaCl2、(NH4)2SO4、抗坏血酸、尿素、谷氨酸、缬氨酸、苯丙氨酸、苏氨酸、赖氨酸、亮氨酸、甲硫氨酸、异亮氨酸、葡萄糖、乳糖溶液加入酒红色的AuNPs溶胶中进行抗干扰实验, 结果如图8所示.由图8可知,与加入浓度为0.6 μmol·L-1Mel标准溶液的样品(编号18)相比,其他样品在紫外光谱吸收和颜色上均无明显差异; Mel的吸光度比值(A650/A520) 明显高于其他干扰因素的, 表明即使大量存在其他因素也不会影响AuNPs溶胶对Mel的检测, 体系对Mel的检测存在特异性.
3 结论
本文以海草提取液为环境成功制备颗粒较小且分布均匀的酒红色AuNPs溶胶, 利用紫外-可见吸收光谱法实现了对Mel简单、快速、低成本及可视化检测.基于Mel可引起AuNPs之间的聚集, 从而使AuNPs溶胶颜色及其紫外-可见吸收光谱均发生变化, 对Mel进行检测.结果表明, 当Mel标准溶液浓度在0.4~0.8 μmol·L-1范围内存在良好的线性关系, 最低检测限为0.359 μmol·L-1.通过抗干扰实验结果表明本文方法的选择性较好, 在检测非法添加Mel方面具有很好的应用前景.

