车前草水提取物对糖尿病肾病大鼠肾纤维化及p38 MAPK/过氧PPAR-γ通路的影响
张凯,赵龙
牡丹江医学院附属红旗医院药学部,黑龙江 牡丹江 157000
在糖尿病患者中糖尿病肾病是较为常见的微血管并发症,系膜增生与基底膜增厚是其主要的病理结构特征,最终能够导致肾小球硬化以及肾间质纤维化情况出现,严重威胁患者身体健康及生命安全[1]。P38是丝裂原活化蛋白激酶(简称MAPK)家族的重要成员之一,并在糖尿病肾病发生以及发展中具有至关重要的作用,同时在细胞外基质纤维化等诸多生理及病理过程中均有参与[2]。相关研究显示,机体内的高糖情况还能够诱导肾小球系膜细胞内的过氧化物酶体增殖物激活受体-γ(简称PPAR-γ)出现表达降低情况,从而导致胞外基质由于降解减少而出现堆积情况,系膜增生后能够导致肾小球硬化情况出现,进而导致糖尿病肾病的发生[3-4]。据临床实践显示,车前草具有较好的祛痰、利尿以及明目等效果,许多国家将其作为保健食品的原料以及传统药草进行应用[5]。本研究通过对糖尿病肾纤维化大鼠采用车前草水提取物治疗,从而探讨对p38 MAPK/过氧PPAR-γ通路的影响。报道如下。
1 资料与方法
1.1 一般资料
1.1.1 实验动物 选取2018年1月—2018年12月在某医学动物实验中心饲养的60只大鼠[动物生产许可证:SCXK(广)2008—2009]作为本研究对象。大鼠体重为160~180g,平均(170.4±11.8)g,均对所有大鼠进行1周的适应性喂养,湿度40%~60%,温度(23.2±1.8)℃,动物造模前自由进水,但禁食12h,该研究符合相关的动物伦理学要求。
1.1.2 实验用药物 将100g车前草采用纯水浸泡20min,之后采用100mL水进行2次煎煮,待煮沸后采用文火煮30min,合并2次药液后经蒸发浓缩至100mL,其中含1g/mL的生药量,最后冷藏备用。
1.2 方法
1.2.1 动物模型 将50只大鼠采用高脂高糖喂养与65mg/kg的链脲佐菌素经单次腹腔注射的方式建立糖尿病肾病大鼠模型。并将剩余的10只大鼠作为对照组,并给予其等量的柠檬酸盐溶液注射。在链脲佐菌素注射后的第3天与第7天分别采集大鼠的尾静脉血进行血糖值检测,若连续两次的血糖值均 ≥16.5mmoL/L则为模型制备成功。
1.2.2 分组与给药 在造模成功1周之后,取造模成功的40只大鼠随机分为车前草低剂量组、高剂量组,阳性药物组与模型组,各10只。其中,车前草低剂量组与高剂量组的给药分别为1.15g/kg、4.64g/kg;阳性药物组,缬沙坦(生产厂家:北京诺华制药有限公司,国药准字H20173014)4.8×10-3g/kg,每天经灌胃给药1次,给药体积约为1mL/次。此外,对照组与模型组均按照体重给予等体积的生理盐水灌注,连续灌注及给药12周。
1.3 观察指标
(1)生化指标检测。在用药12周后,分别对大鼠的空腹血肌酐(serum creatinine,Scr)与血尿素氮(blood urea nitrogen,BUN)水平进行测量,并将大鼠置入代谢笼内,收集其24h的尿液,取其上清液对其24h尿蛋白含量进行检测。
(2)在治疗12周后对各组大鼠进行血清中肾纤维化相关指标的检测,采用酶联免疫吸附法进行检测,检测指标主要包含大鼠半胱氨酸蛋白酶抑制剂/胱抑素C(CysC)、基质金属蛋白酶抑制剂抑制因子 1(tissue inhibitors of metalloproteinase 1,TIMP-1)、转化生长因子β1(transforming growth factor 1,TGF-β1)。(3)检测并比较各组大鼠肾组织的相关指标,主要包含P38 MAPK、P-P38 MAPK及PPAR-γ的表达水平,具体为:①HE染色,在给药12周之后将大鼠采用颈椎脱臼方法处死,经腹腔将其左肾取出,并沿肾脏矢状面将其一分为二。之后将其中一半肾脏放入浓度为10%的中性甲醛中进行固定,并做常规的脱水处理,在进行石蜡包埋后用作HE染色;同时将另一半放入液氮中进行冻存。将大鼠的肾组织标本切为5μm厚度,为避免出现脱片情况,对其进行2h的60℃烤片,在HE染色后置于光镜下进行仔细观察,并进行相应的组织病理学检测。②Western blot分析,将在液氮中保存的肾组织取出,并经充分研磨后将适量的蛋白缓冲液加入其中,依据常规方法进行蛋白提取,并利用BCA法定量进行相应的浓度调节。之后去50μg的蛋白样品,经SDS-PAGE电泳后转至硝酸纤维素膜,将其浸入浓度为5%的脱脂奶粉中并进行1h的避光封存;经洗涤后浸入一抗稀释液当中,其中P38 MAPK、P-P38 MAPK及PPAR-γ的具体稀释比例为1:1000,之后放入4℃的环境中孵育过夜,次日清晨进行第二次洗涤,之后浸入二抗稀释液当中,比例为1:5000,再经1h的室温摇床孵育,洗涤采用ECL发光液进行滴加,经3次曝光,选取相应的重叠值,其中采用Image J软件进行蛋白条带灰度值分析,采用β-actin进行内参蛋白分析。
1.4 统计学方法数据应用SPSS21.0进行分析,其中计数资料以(例/%)表示,进行χ2检验,计量资料以()表示,进行t检验,P<0.05提示差异有统计学意义。
2 结果
2.1 各组大鼠Scr、BUN及24h尿蛋白含量对比模型组的Scr、BUN及24h尿蛋白含量均高于对照组、阳性药物组及低剂量、高剂量组,且高剂量用药物组的Scr、BUN及24h尿蛋白含量均低于低剂量用药组(P<0.05),具体见表1。
表1 比较各组大鼠的Scr、BUN及24h尿蛋白含量()
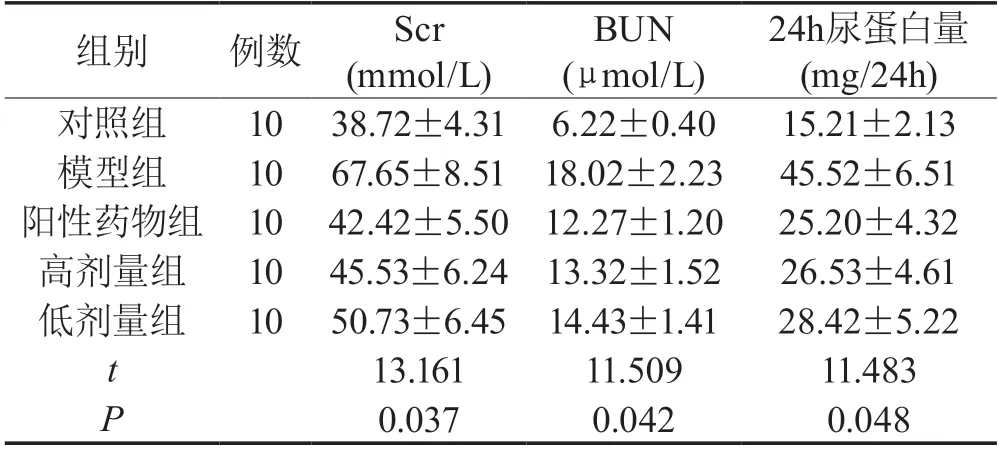
表1 比较各组大鼠的Scr、BUN及24h尿蛋白含量()
2.2 大鼠血清纤维化的相关指标各组大鼠的CysC、TIMP-1及TGF-β1指标差异有统计学意义(P<0.05),且高剂量用药组的各项指标均低于低剂量组(P<0.05),具体见表2。
表2 比较各组大鼠血清肾纤维化的相关指标()
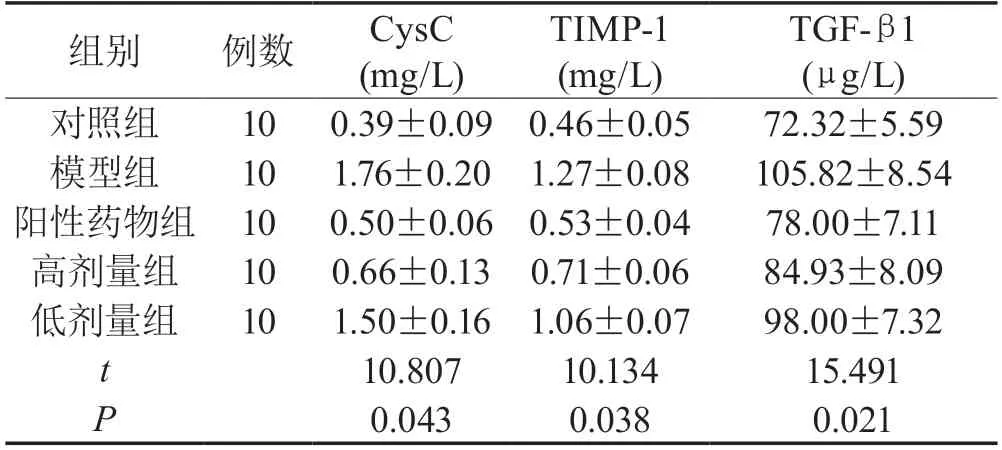
表2 比较各组大鼠血清肾纤维化的相关指标()
2.3 大鼠肾组织P38 MAPK、P-P38 MAPK及PPAR-γ表达水平对比各组大鼠的P-P38 MAPK及PPAR-γ水平差异有统计学意义(P<0.05),且高剂量用药组的P-P38 MAPK水平低于低剂量组,而PPAR-γ水平高于低剂量组(P<0.05),各组的P38 MAPK水平差异无统计学意义(P>0.05),具体见表3。
表3 比较各组大鼠肾组织P38 MAPK、P-P38 MAPK及PPAR-γ表达水平()
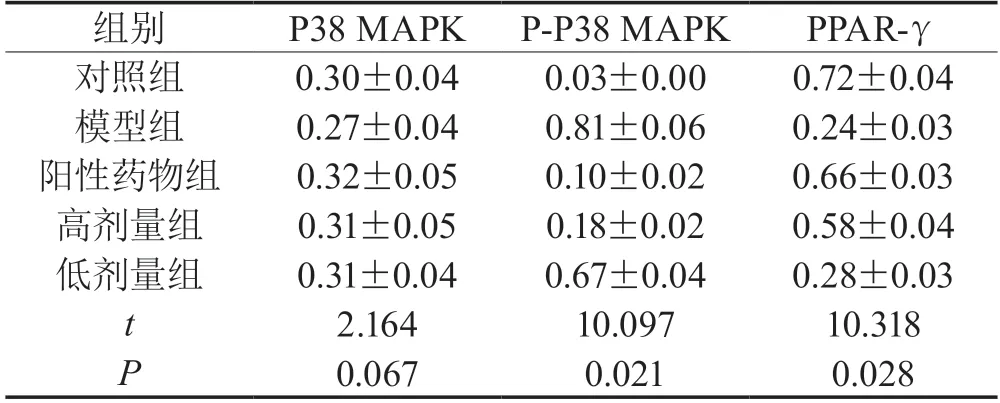
表3 比较各组大鼠肾组织P38 MAPK、P-P38 MAPK及PPAR-γ表达水平()
3 讨论
糖尿病肾病是糖尿病患者中较为严重的并发症类型,当机体出现持续性蛋白尿情况时,若不采取及时有效的救治措施,则极有可能导致肾衰竭,从而对患者身体健康及生命安全造成严重威胁[6]。因此,积极寻求科学、有效的治疗药物对逆转糖尿病肾病具有至关重要的作用。
本研究中通过采用脲佐菌素诱导而建立相应的糖尿病肾病大鼠模型,并经HE染色显示,模型组的大鼠肾脏出现显著萎缩情况,肾小管显著扩张,系膜基质明显增加,肾小球存在硬化情况[7]。而经车前草水提取物治疗后期肾脏病变情况显著缓解,且给药浓度较高的大鼠其肾脏病变的严重情况相对较轻,从而说明在对糖尿病肾病大鼠在进行肾组织损伤修复的过程中,采用车前草水提取物治疗具有较好效果[8-9]。经本研究显示,模型组的Scr、BUN及24h尿蛋白含量均高于对照组、阳性药物组及低剂量、高剂量组,且高剂量用药物组的Scr、BUN及24h尿蛋白含量均低于低剂量用药组(P<0.05)。由此可见,采用高剂量的车前草水提取物治疗能够促使糖尿病肾病大鼠的肾功能指标得到显著改善,并对大鼠肾功能损伤情况进行有效保护。糖尿病肾病患者在出现肾功能损伤的同时,也会伴有不同程度的肾脏纤维化情况,其主要特征为胞外基质的异常堆积[10]。血管活性物质、高血糖以及炎性因子等多种纤维化细胞因子存在的异常高表达情况及其相互之间的作用,最终导致机体出现肾间质纤维化[11]。
糖蛋白以及胶原蛋白合成代谢情况的明显增加,从而极易导致CysC、TIMP-1及TGF-β1等与肾纤维化密切相关的指标出现异常升高情况[12]。其中,TIMP-1还与肾纤维化中的血管重塑紧密相关,而TGF-β1则是至关重要的致纤维化因子,在机体胞外基质平衡的维持中具有重要作用,同时还能够有效调控机体的炎性反应,致使胞外基质合成及堆积情况增加,胞外基质降解的情况也得到有效抑制。综合上述指标,它们都能对肾纤维化程度进行有效反应[13]。在本研究中发现:各组大鼠的CysC、TIMP-1及TGF-β1指标均存在显著差异(P<0.05),且高剂量用药组的各项指标均低于低剂量组(P<0.05)。由此说明,对糖尿病肾病大鼠采用车前草水提取物治疗,能够促使CysC、TIMP-1及TGF-β1表达情况得到有效抑制,进而减缓肾纤维化进程。
P38 MAPK是MAPK中的重要家族成员,是进行细胞外信号转导的共同通路,几乎在生物体的整个生理及病理过程中均有参与,尤其是氧化应激以及炎性反应等[14]。P38 MAPK主要在细胞质内进行表达,在机体正常的生理状况下其活性相对较低,经磷酸化激活后P-P38 MAPK转移至核内,能够磷酸化激活较多的转录因子,并对炎性因子等所累靶基因表达情况进行有效调控,同时与机体糖尿病血管并发症的出现紧密相关[15]。在细胞因子表达机制的有效调控中P38 MAPK具有至关重要的作用,通过对该通路进行有效抑制能够对促炎因子的表达情况进行有效抑制,机体炎症反应情况得到有效缓解[16]。在本研究中经Western blot分析显示:各组大鼠的P-P38 MAPK及PPAR-γ水平均存在显著差异(P<0.05),且高剂量用药组的P-P38 MAPK水平低于低剂量组,而PPAR-γ水平高于低剂量组(P<0.05),说明采用车前草水提取物能够有效降低大鼠的P-P38 MAPK水平,而PPAR-γ水平得到有效提升。经车前草水提取物及阳性药物干预后,与模型组比较大鼠的P-P38 MAPK水平明显降低,且高剂量给药组的水平相对较低,由此可见,经车前草水提取物干预后能够有效抑制P38 MAPK的磷酸化过程[17]。
PPAR-γ属于核因子超家族中的一员,能够对大量基因表达所需的核受体进行有效调节,并在机体的免疫炎症反应及糖脂代谢中发挥着至关重要的作用,高糖能够促使肾小球系膜细胞内的PPAR-γ水平得到显著提升,从而导致胞外基质沉积以及系膜增生情况出现,最终导致肾小球硬化以及纤维化[18-19]。对于糖尿病肾病中肾组织损伤的大鼠采用车前草水提取物能够促使PPAR-γ表达情况得到有效激活,P38 MAPK通路得到有效抑制,肾纤维化情况得到有效缓解[20]。但由于糖尿病肾病的发病机制相对复杂,对糖尿病肾病采用车前草水提取物治疗的过程中,对于其具体的作用机理还需更多的临床研究及实践来证实。
综上所述,对糖尿病肾病大鼠采用车前草水提取物治疗,能够显著降低对大鼠肾脏的损伤,肾纤维化情况显著减轻,该情况出现的原因可能与P38 MAPK通路受到显著抑制以及PPAR-γ通路得到有效激活的情况有关。

