晴隆酸菜发酵过程中微生物菌群多样性动态分析
郭倩倩,卢 彪
(兴义民族师范学院 生物与化学学院,贵州 兴义562400)
酸菜是一种深受国人喜爱的蔬菜发酵食品,在我国很多地方都有自己特色的发酵蔬菜制品,如东北酸菜[1]、四川的老坛酸菜[2]和凉山的无盐酸菜[3]等。由于发酵工艺不同,发酵体系中的微生物群落结构、风味特性和质地均有不同[4]。而且自然发酵的产品,由于其发酵微生物均来源于发酵原料与发酵环境[5],因此研究发酵食品中的微生物组成以及发酵过程中微生物的动态变化是了解发酵食品中微生物之间的相互作用、揭示食品风味与发酵菌群的关系、保持产品稳定性的关键。
近年来对发酵微生物多样性的研究已经逐步成为酸菜研究的热点。谷懿寰等[6]利用传统分离技术、16S rRNA以及荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术对30份不同地域和种类的海南发酵蔬菜进行研究,共得到乳杆菌属、肠球菌属和片球菌属的16个属172 株乳酸菌,通过数量分析得出海南发酵蔬菜的优势属为乳杆菌属,优势种为植物乳杆菌(Lactobacillus plantarum);折米娜等[7]利用高通量测序技术与变性梯度凝胶电泳相结合的技术对施恩地区酸菜水中的细菌多样性进行了研究,结果表明,乳杆菌属为优势菌属,含量达76.25%,优势乳酸菌为植物乳杆菌(Lactobacillus plantarum)。吴进菊等[8]利用高通量测序分析了湖北襄阳大头菜发酵过程中真菌的多样性,结果表明,发酵前期明梭孢属(Monographella)为优势菌属,发酵中期和后期德巴利氏酵母属(Debaryomyces)和接合酵母属(Zygosaccharomyces)为优势菌属。本研究为了全面的了解晴隆酸菜中发酵微生物的动态变化,采用高通量测序的方法对晴隆酸菜发酵过程中细菌和真菌进行了种属分类以及群落结构的动态分析,研究了晴隆酸菜各发酵时期的优势发酵菌群及菌落结构,为研究晴隆酸菜风味与微生物之间的关系、保持晴隆酸菜生产的稳定性提供了理论依据,同时也可以为其他发酵食品的研究提供参考依据。
1 材料与方法
1.1 材料与试剂
自然发酵晴隆酸菜:实验室自制;E.Z.N.A.RSoil 脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:美国OMEGA公司;2×HieffRRobust PCR Master Mix、Hieff NGSTMDNA Selection Beads:中国Yeasen公司;Qubit3.0 DNA检测试剂盒:美国Life公司。
1.2 仪器与设备
ETC-811 PCR仪:北京东胜创新生物科技有限公司;FR-1000凝胶成像系统:上海复日科技有限公司;Q32866 QubitR3.0荧光计:美国Invitrogen公司;Research plus 0.5~10.0μL移液器:德国Eppendorf公司;DYY-6C电泳仪、DYCZ-21电泳槽:北京市六一仪器厂。
1.3 方法
1.3.1 晴隆酸菜的制备
以晴隆芥菜为发酵原料,利用传统土陶坛为发酵容器,经清洗、干燥脱水(60 ℃热风干燥2 h)、加盐(8%)揉搓腌渍,加糖(4%),密封发酵28 d,即得晴隆酸菜。
1.3.2 酸菜样品采集及发酵菌体收集
分别采取自然发酵7 d(前期)(T1)、14 d(中期)(T2)、21 d(后期)(T3)、28 d(末期(成品)T4)晴隆酸菜样品各500 g,分别编号为T1、T2、T3、T4。
将2 g酸菜样品放入5 mL样品管,加入适量磷酸缓冲盐溶液(phosphate buffer saline,PBS)进行表面振荡冲洗,收集PBS冲洗液,12 000 r/min离心2 min后用移液枪小心吸除上清液,留取沉淀菌体。
1.3.3 基因组DNA的提取与检测
用E.Z.N.ATMMag-Bind Soil DNA提取试剂盒对收集的菌体进行DNA的提取,并通过琼脂糖凝胶电泳检测DNA。
1.3.4 PCR扩增
提取的基因组DNA通过Qubit3.0 DNA检测试剂盒精确定量后,作为模板进行PCR第一轮扩增。
第一轮PCR扩增引物分别为Nobar_341F:CCTACGGGNGGCWGCAG,Nobar_805R GACTACHVGGGTATCTAATCC(细菌);ITS1F:CTTGGTCATTTAGAGGAAGTAA,ITS2:GCTGCGTTCTTCATCGATGC(真菌)。第一轮扩增体系:2×HieffRRobust PCR Master Mix 15 μL,Primer F 1 μL,Primer R1 μL,基因组DNA 10 ng;加水至30 μL。第一轮扩增条件:94 ℃,3 min→(94 ℃,30 s→45℃,20 s→65 ℃,30 s)5个循环→(94℃,20s→55℃,20s→72℃,30 s)20个循环→72 ℃,5 min→10 ℃,∞。
以第一轮扩增的PCR产物为模板进行第二轮PCR扩增。第二轮PCR扩增引物分别为341F:CCTACGGGNGGCWGCAG,805R:GACTACHVGGGTATCTAATCC(细菌);ITS1F:CTTGGTCATTTAGAGGAAGTAA,ITS2:GCTGCGTTCTTCATCGATGC(真菌)。第二轮扩增体系:2×HieffRRobust PCR Master Mix 15 μL,Primer F 1 μL,Primer R 1 μL,产物DNA 20 ng;加水至30 μL。第二轮扩增条件:95 ℃,3 min→(94 ℃,20 s→55 ℃,20 s→72 ℃,30 s)5个循环→72 ℃,5 min→10 ℃,∞。
1.3.5 DNA定量与上机测序
PCR产物利用2%琼脂糖凝胶电泳进行检测,并通过Qubit3.0荧光定量仪对PCR产物进行定量。PCR产物由生工生物工程(上海)股份有限公司的Illumina Mieq测序平台将进行测序。
1.3.6 数据处理与分析方法
将上机测序后的原始序列通过去除引物接头、序列拼接、过滤、去除嵌合体以及非特异性扩增序列后得到各样本的有效数据。将最终优化的有效数据按照序列间的距离进行聚类,并根据序列之间的相似性将序列分成不同的操作分类单元(operational taxonomic units,OTU),在97%相似度水平下进行OTU聚类分析。因酸菜样本在提取基因组DNA时不可避免的会混入酸菜植物自身的基因组DNA,因此通过基因内转录间隔区(intergenic transcribed spacer,ITS)引物扩增后会产生植物序列。为避免植物ITS序列的干扰,测序结果去除了植物类的OTU后再进行后续分析。
Alpha多样性分析:选取了OTU数、覆盖率(Coverage)、香农(Shannon)指数、辛普森(Simpson)指数、超(Chao1)指数进行分析。其中覆盖率(Coverage)代表文库是测序深度指标;Chao1指数代表微生物总数指标,其数值越高表明微生物总量越大;微生物多样性由Shannon、Simpson指数进行评估,Shannon指数与微生物多样性呈正相关,Simpson指数与微生物多样性呈负相关。
微生物分子生物学鉴定:细菌鉴定数据库(核糖体数据库项目(ribosomal database project,RDP)数据库、Silva数据库、美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库);真菌鉴定数据库(RDP数据库、Unite数据库)。
2 结果与分析
2.1 测序数据合理性分析
稀释曲线(rarefaction curve)是采用对测序序列进行随机抽样的方法,以抽到的序列数与多样性指数做曲线,主要用来判断测序深度是否合理。当曲线趋向平坦时,说明测序数据量合理,反之则表明继续测序还可能产生较多新的OTU,测序深度不够。各样品所获得的有效扩增序列数分别为:细菌分类测序中T1:1 726条、T2:2 219条、T3:6 758条、T4:9 638条;真菌分类测序中T1:3 862条、T2:10 381条、T3:5 651条、T4:2 448条。由各抽取的序列数与Shannon指数构建的稀释曲线见图1。
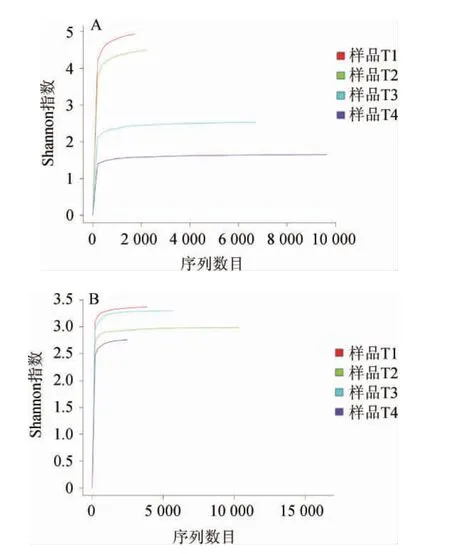
图1 酸菜样品中细菌(A)和真菌(B)的Shannon指数稀疏曲线Fig. 1 Rarefaction curves of Shannon indexes of bacteria (A) and fungi (B) in sauerkraut samples
由图1A可知,细菌分类测序中得到的有效序列数从样品T1到T4逐渐增多,稀释曲线均趋向平坦。由图1B可知,真菌分类测序中得到的有效序列数从样品T1到T3逐渐增多而样品T4最少,稀释曲线也均趋向平坦。结果表明,测序数据量合理,更多的数据量只会产生少量新的OTU,测序结果可信度高。
2.2 Alpha多样性分析
通过对4个酸菜样品进行细菌和真菌两方面的高通量测序分析,对分析结果的OTU数、Coverage、Shannon指数、Simpson指数、Chao1指数进行Alpha多样性分析,结果分别见表1和表2。

表1 酸菜样品中细菌Alpha多样性指数分析结果Table 1 Analysis results of Alpha diversity indexes of bacteria in sauerkraut samples
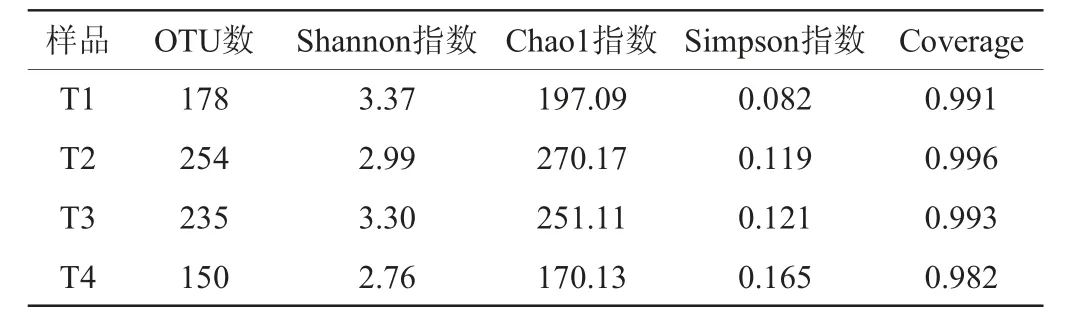
表2 酸菜样品中真菌Alpha多样性指数分析结果Table 2 Analysis results of Alpha diversity indexes of fungi in sauerkraut samples
由表1和表2可知,各酸菜样品中细菌的OTU覆盖率为86.9%~98.2%,真菌的OTU覆盖率为98.2%~99.6%,表明样品中的微生物种类的绝大部分都被检测到。从体现微生物总量的Chao1指数上看,发酵末期(T4)细菌和真菌的总量均最少,推测由于发酵末期酸菜中各种有机酸的积累导致pH较低抑制微生物的生长有关。从与微生物群落多样正相关的Shannon指数以及负相关的Simpson指数来看,随着发酵时间的延长,细菌Shannon指数逐步减小,Simpson指数逐步增加,真菌Shannon指数除T2时期外也是逐步减小,Simpson指数逐步增加。说明酸菜中微生物群落多样性呈下降趋势,发酵末期的微生物群落多样性最低;随着发酵的进行微生物群落多样性逐渐降低主要由于优势发酵菌群的形成、营养物质的消耗、代谢产物的积累,从而抑制其他菌群的生长。
2.3 基于OTU丰度的样本聚类分析
聚类树图可以通过树枝结构直观表示各个样品间的相似性和差异关系,根据各样本细菌和真菌OTU丰度计算样本间多样性距离矩阵,分别绘制样本聚类树图,结果见图2。
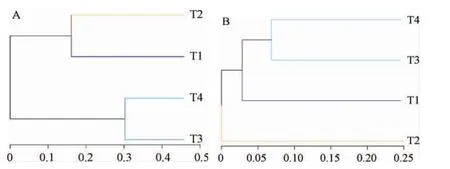
图2 酸菜样品中细菌(A)和真菌(B)树状聚类图Fig. 2 Tree cluster diagram of bacteria (A) and fungi (B) in sauerkraut samples
由图2可知,酸菜样品中细菌聚类结果显示样品T1、T2相似性较高为一聚类,样品T3、T4相似性较高为另一聚类。酸菜样品中真菌聚类结果显示样品T3、T4相似性较高为一聚类,样品T1和T2与其他样品相似性都较低单独聚类。从参与发酵的真菌和细菌两个方面来看,酸菜发酵前期微生物群落结构随着发酵的进行变化大,相似性较低;而酸菜发酵的后末期发酵微生物群落结构趋于稳定相似性较高。
2.4 发酵微生物组成分析
2.4.1 发酵微生物门属个数分析
通过高通量测序分析四个不同发酵时期的晴隆酸菜,共鉴定出细菌24门262属,真菌7门131属。具体各发酵时期鉴定结果见表3。

表3 酸菜样品中细菌和真菌门、属个数Table 3 Number of phylum and genus of bacteria and fungi in sauerkraut samples
由表3可知,四个不同发酵时期的晴隆酸菜中微生物处于动态变化之中,随着发酵的进行微生物种类也在进行着新增与消亡。从总体微生物门属来看,发酵后期(T4)晴隆酸菜中所含有的微生物种属门类最少。结果与Alpha 多样性分析结果中发酵后期(T4)晴隆酸菜中微生物多样性最低相一致。该现象的出现与发酵后期酸菜中营养物质的消耗,各种代谢产物的积累,pH值降低等因素相关。
2.4.2 发酵微生物属层面韦恩图
通过不同发酵时期所鉴定的所有微生物属(细菌、真菌),分析各时期的独有和共有属,制作属层面的韦恩图,从而直观的展现出各发酵时期的属数目组成相似性及重叠情况,结果见图3。

图3 酸菜样品中细菌(A)和真菌(B)属水平韦恩图Fig. 3 Venn of bacteria (A) and fungi (B) in sauerkraut samples based on genus level
由图3可知,四个发酵时期共有细菌属91个占总数的34.7%,共有真菌属32个占总数的24.4%。四个发酵时期细菌特有菌属个数分别为:T1为27个、T2为17个、T3为26个、T4为13个;四个发酵时期真菌特有菌属个数分别为:T1为14个、T2为13个、T3为18个、T4为9个。发酵末期(T4)所含的特有微生物属(细菌和真菌)是最少的,其结果与T4时期微生物多样性最低、微生物种属个数最少具有一定的相关性。
2.4.3 发酵微生物属相对丰度分析
根据分子鉴定结果将样本中的微生物以属为最小分类单元进行相对丰度的统计,构建细菌和真菌属水平相对丰度柱状图,其中不同颜色代表不同的微生物属种类,柱状的方块的长短代表相对丰度的高低,结果见图4。
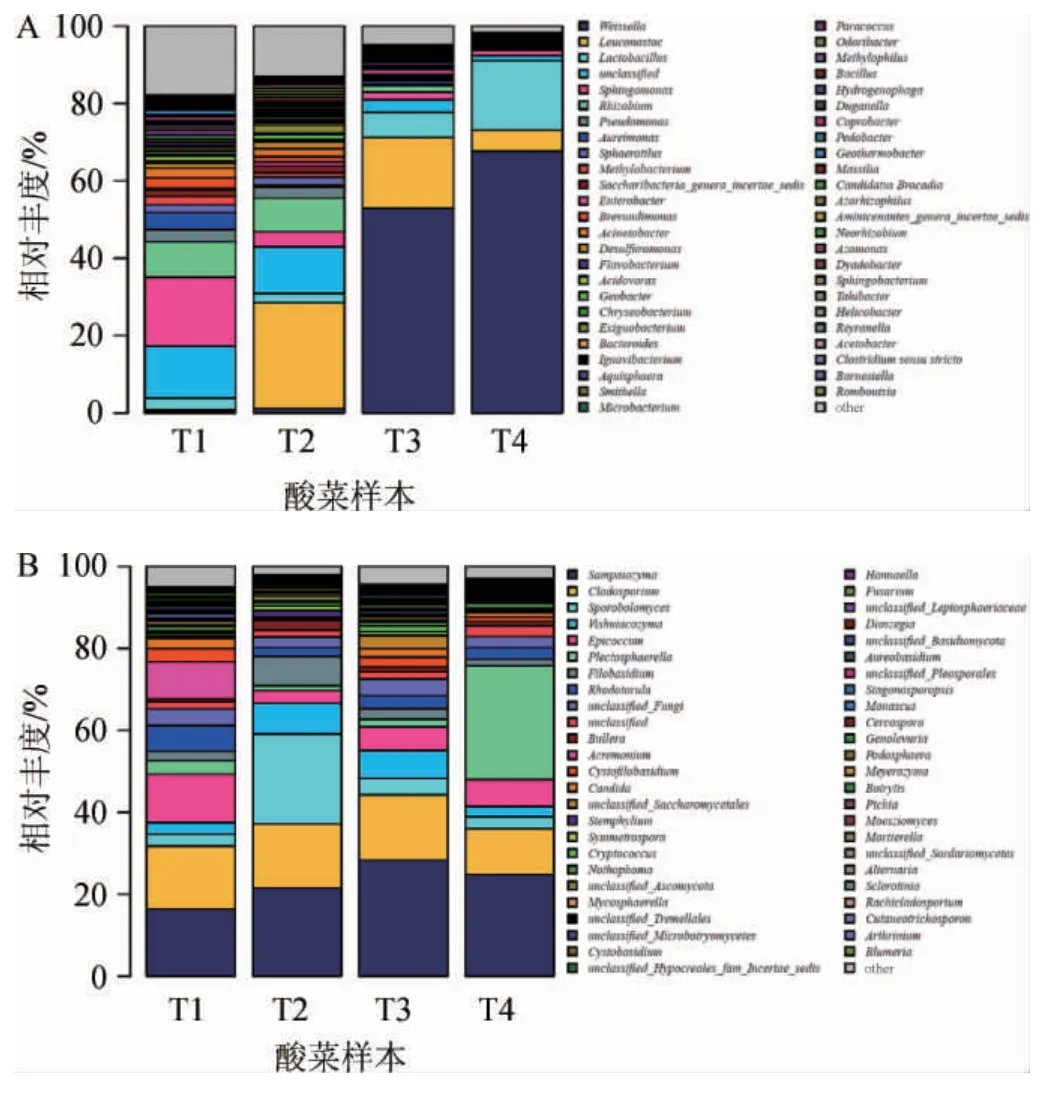
图4 酸菜样品发酵过程中细菌(A)和真菌(B)基于属水平的相对丰度Fig. 4 Relative abundance of bacteria (A) and fungi (B) in sauerkraut samples during fermentation based on genus level
由图4A可知,从样品T1到T4体现了自然发酵过程中随着发酵的进行,细菌菌属多样性逐渐降低,逐渐出现优势发酵菌属的过程,发酵后末期魏斯氏菌(Weissella)相对丰度(67.68%)最高成为最主要的优势菌。由图4B可知,发酵真菌群落随着发酵的进行,群落结构发生着动态的变化,种属相对丰度也随之变化。Sampaiozyma和枝孢菌(Cladosporium)两个属在发酵过程中一直占有较高的相对丰度(分别≥16.42%和≥11.23%),Plectosphaerella在发酵后期出现优势(相对丰度为27.74%)。
2.4.4 优势发酵微生物属分析
通过属水平上微生物分类,统计各微生物属的相对丰度,根据相对丰度划分出各发酵时期的优势微生物(相对丰度>5.0%),结果见表4。
由表4可知,发酵优势细菌方面,各时期的优势菌属总数较少只有5个属。鞘脂单胞菌(Sphingomonas)和根瘤菌(Rhizobium)两个属随着发酵的进行,相对丰度逐步降低,分别由17.79%、9.21%降低至1.41%、0.34%;而魏斯氏菌(Weissella)则随着发酵的进行,相对丰度逐步提高,由0.41%升高至67.68%,尤其是从发酵后期(T3)开始增速明显;乳杆菌(Lactobacillus)同样在发酵前中期(T1、T2)相对丰度较低,而到发酵末期(T4)最终达到17.9%。明串珠菌(Leuconostoc)则呈现先扬后抑的动态变化,从发酵前期(T1)0.41%迅速增长至发酵中期(T2)27.35%,而从发酵后期(T3)开始逐渐降低,到发酵末期(T4)降至5.5%。
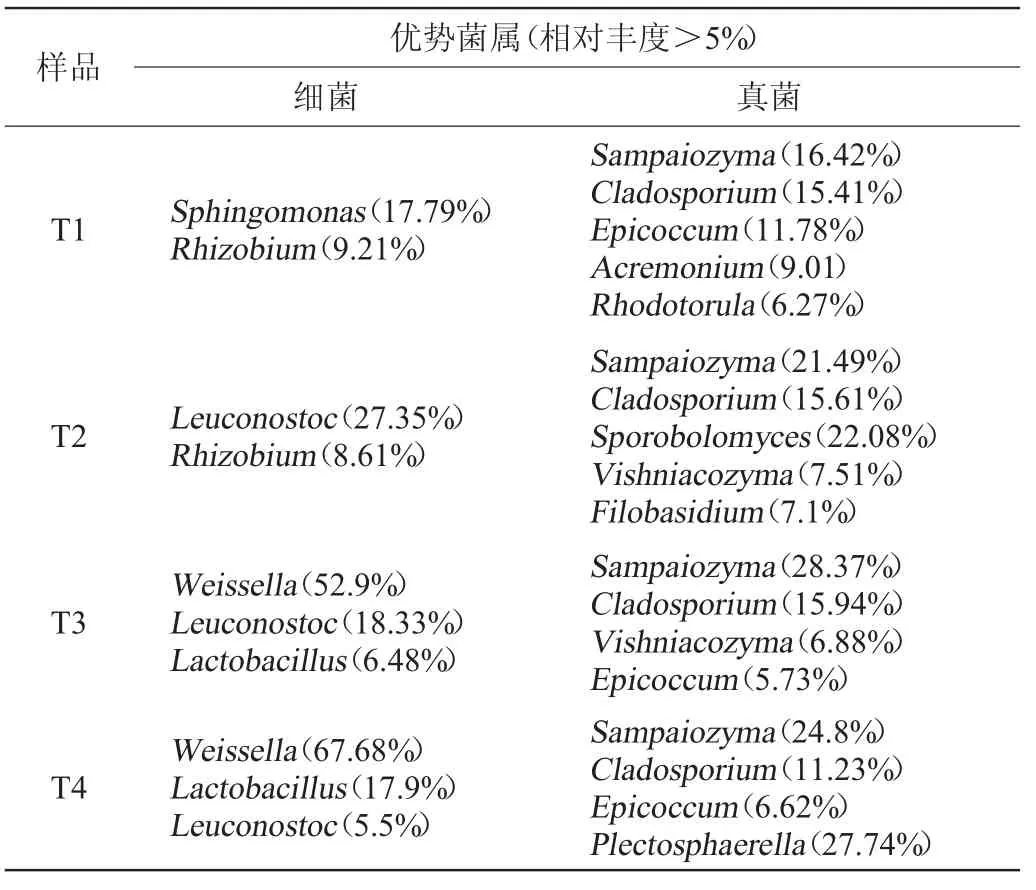
表4 酸菜样品发酵过程中优势菌属Table 4 Dominant genus in sauerkraut samples during fermentation
发酵优势真菌属方面,各时期的优势菌属总数较多有9个属。相对丰度动态变化较为明显的为Plectosphaerella和掷孢酵母(Sporobolomyces)。Plectosphaerella在发酵前中后期(T1、T2、T3)相对丰度均在2%左右,而在发酵末期(T4)相对丰度迅速增加至27.74%成为占比最大的优势菌属掷孢酵母(Sporobolomyces)则是在发酵前期(T1)和发酵后末期(T3、T4)相对丰度较低3%左右,而在发酵中期(T2)相对丰度则达到了较高的水平(22.08%);Vishniacozyma在发酵前中期(T2、T3)两个时期相对丰度增加明显,最高达到7.51%,但T4期结束时降到了2.45%。其他优势菌属动态变化不大,相对丰度略有增减。
2.5 讨论
晴隆酸菜成品(T4)所包含的三个优势细菌属分别为魏斯氏菌(Weissella)(67.68%)、乳酸杆菌(Lactobacillus)(17.9%)、明串珠菌属(Leuconostoc)(5.5%);四个优势真菌属分别为Sampaiozyma(24.8%)、枝孢菌(Cladosporium)(11.23%)、附球菌(Epicoccum)(6.62%)、Plectosphaerella(27.74%)。在真菌方面,Sampaiozyma可产淀粉酶、脂肪酶、植酸酶、几丁质酶、菊粉酶等多种胞外酶[9],可能参与酸菜发酵过程中生物大分子的降解。枝孢属具有产木聚糖酶和纤维素酶功能[10-12],可对酸菜中的纤维素进行分解。附球菌属可利用自身分泌的抗菌物质抑制其他病原菌生长,其中抗霉菌效果显著[13-14],从而抑制酸菜中霉菌的生长。Plectosphaerella在食品方面未见研究报道。三个优势细菌属魏斯氏菌、乳酸杆菌、明串珠菌均属于发酵食品中常见的乳杆菌目(Lactobacillales),而发酵成品(T4)中总的乳杆菌目(Lactobacillales)达到了91.17%。魏斯氏菌是食品发酵中一类重要的乳酸菌,存在于泡菜[15]、酱油[16]、白酒[17]、酱肉[18]等发酵食品中,在发酵食品中具有广泛的应用价值。食品发酵过程中魏斯氏菌可以显著增加食品中短链脂肪酸、有机酸、酯类等风味物质含量,提高发酵食品风味[19]。乳杆菌属作为常见的食品发酵菌属以及益生菌属,广泛运用于酸奶、益生菌制剂等方面。乳酸杆菌可以定植在机体消化系统内,提高消化系统菌群中乳酸菌的优势,具有维持消化系统微生态系统的平衡、对消化系统进行功能改善、治疗消化系统疾病等功能[20-21]。明串珠菌属生存环境比较广泛,植物表面和根部都有存在[22],在韩国泡菜、中国酸菜、德国干酪等发酵食品中也属于优势菌种[23-24]。明串珠菌通过代谢除了产生乳酸、乙酸外还可以产生甘露醇、细菌素、胞外多糖、双乙酰等代谢产物,使其在食品保健、医药卫生等领域具有广阔前景。晴隆酸菜成品(T4)中所含的细菌超过90%均为常见的食品发酵菌属,且具有提高发酵风味、具有益生菌功能等特点,为晴隆酸菜在营养价值与促进健康方面提供理论支撑。优势发酵菌属同时也抑制了其他杂菌的生长,维持了酸菜发酵菌群的稳定,为晴隆酸菜的微生物安全稳定提供一定的保障。
3 结论
本研究采用高通量测序的方法,对晴隆酸菜四个发酵时期(T1、T2、T3、T4)微生物多样性、发酵微生物菌群动态变化、优势菌群等方面进行了分析。通过与细菌真菌数据库比对鉴定出细菌24门262属,真菌7门131属。通过Alpha多样性分析以及具体微生物种属组成的研究,结果表明晴隆酸菜中微生物群落多样性随着发酵的进行呈下降趋势,发酵末期的微生物群落多样性最低、微生物种属数量最少。通过基于OTU的样品聚类分析,晴隆酸菜发酵前中期微生物群落结构不稳定、相似性较低,而发酵后末期微生物群落结构稳定、相似性较高。四个发酵时期的酸菜中存在着优势菌属的消长变化,总发酵过程中优势菌属为细菌5个魏斯氏菌(Weissella)、乳酸杆菌(Lactobacillus)、明串珠菌(Leuconostoc)、鞘脂单胞菌(Sphingomonas)、根瘤菌(Rhizobium),真菌9个Sampaiozyma、枝孢菌(Cladosporium)、掷孢酵母(Sporobolomyces)、Vishniacozyma、附球菌(Epicoccum)、Plectosphaerella、Filobasidium、红酵母(Rhodotorula)、枝顶孢(Acremonium)。发酵酸菜成品(T4)的三个优势细菌属分别为魏斯氏菌Weissella(67.68%)、乳酸杆菌Lactobacillus(17.9%)、明串珠菌Leuconostoc(5.5%)均属于乳杆菌目(Lactobacillale),为食品发酵常见发酵菌属。

