双胎与单胎妊娠孕晚期、产时和产后血清脑钠肽(BNP)水平差异
刘 婧 周 进 唐 瑶 盛雨佳 彭 婷△
(1复旦大学附属妇产科医院产科,2检验科 上海 200011)
双胎妊娠女性心输出量增加约20%,血浆容量增加10%~20%,因此当合并其他危险因素时发生肺水肿的风险增加,是围产期心肌病的高危人群。分娩前后孕产妇心脏功能变化尤其明显,而动态监测双胎心脏功能的相关报道较少。脑钠肽(brain natriuretic peptide,BNP)又称B 型利钠肽,在心室升高的容量、压力负荷及室壁张力下,其前体在心室肌细胞中裂解为具有生物活性的BNP,释放入血后具有排钠、利尿、扩张血管、延缓心肌重构等作用,可作为心衰患者心脏负荷增加的监测指标。目前认为BNP 与左室功能有显著相关性。在肺水肿孕妇中BNP 水平显著升高[1]。研究发现妊娠期高血压患者在孕晚期、产前及产后8 周的左心室舒张功能与BNP 的降解产物心房利钠肽前体N 末端片段(Nterminal fragment of pro-atrial natriuretic peptide,NproANP)存在相关性,但未涉及双胎研究。因此本课题尝试回顾性分析BNP 在无基础心肺疾患及子痫前期等严重产科并发症的双胎妊娠孕晚期、产时及产后的变化趋势,探索双胎心脏负荷变化。
资料和方法
资料来源回顾性分析2015 年7 月至2017 年4月在复旦大学附属妇产科医院产科完成分娩的产妇,且在我院建卡定期产检,孕早中期建卡时及孕30~34 周心电图未提示异常,未主诉既往体检有心脏异常或心功能异常,受产检内容限制孕期均未做心超检查。
入组标准及分组分娩孕周设定为孕28~41周,孕晚期或产后检测BNP 指标,以评估心脏功能。所有单胎和双胎剖宫产产时处理一致;均应用头孢类抗生素,静脉补液量标准为手术当天≤1 500 mL,术后第1 天无静脉补液;产后出血<1 000 mL 且未输血。考虑到合并并发症可能影响双胎心脏负荷,且病情轻重会影响组间均衡,因此排除标准设定为:高血压,子痫前期,活动性肝肾疾病,甲亢,风湿病,恶性肿瘤,妊娠合并糖尿病,妊娠合并严重贫血(Hgb≤80 g/L)等可能影响心血管疾病。单胎组:单胎活胎;双胎组:分娩为双胎活胎,自然受孕或体外受精。
根据病案记录采集孕妇基本情况:根据病史记录孕期≥28 周产时及产后2 天内BNP 检测值。将检测值按检测时间分为<34 孕周、≥34 孕周、产时(分娩后当天)及产后48 h 内。本研究BNP 值为测量人次,且在围产期动态监测,存在同一病例不同时间点重复计算。
BNP 测定方法研究对象为孕晚期入院后,非空腹状态下采静脉血3 mL,加入EDTA,摇匀,立即4 ℃离心(3 000×g,10 min)分离血浆待测。用ELISA法严格按照说明书进行测定,试剂盒由美国Market公司提供,参考值范围(0~100 pg/mL)。
统计学分析采用SPSS 16.0 软件进行统计分析。计量结果以x+s表示,正态分布采用单样本KS检验方法,组间及组内比较采用非参数检验Mann-Whitney U 和Kruskal-Wallis 检验。计数资料以率表示,P<0.05 为差异有统计学意义。
结 果
基本情况最终共252 例孕妇入组(表1)。其中单胎组148 例,平均年龄(31.21±4.6)岁,双胎组104 例,平均年龄(30.4±4.0)岁,两组年龄差异无统计学意义。双胎组与单胎组分娩方式差异有统计学意义,单胎妊娠组剖宫产比例为68%,双胎组为100%。单胎组与双胎组孕期不同时间点的妊娠合并贫血(Hgb>80 g/L)、妊娠期糖尿病比例差异均无统计学意义。

表1 单胎及双胎妊娠状态晚孕期、产时及产后BNP 水平Tab 1 Differences of BNP in late pregnancy,delivery and postpartum in single and twin pregnancies (pg/mL,x±s)
两组BNP 水平孕晚期双胎组与单胎组BNP水平分布总体差异无统计学意义,34 周前后两组BNP 水平差异无统计学意义。产时双胎组BNP 水平虽然较单胎组增高,但差异无统计学意义(P>0.05)。产后1 天内两组BNP 水平差异有统计学意义(F=1.58,P<0.05),产后第2 天起两组BNP 水平差异无统计学意义。将表1 各组数据纳入制成动态图展现单胎和双胎妊娠状态孕晚期、产时及产后BNP 水平变化趋势(图1),产后第1 天是BNP 水平最高的时间点。
分娩方式亚组分析双胎组均为剖宫产分娩,单胎组有4 人产钳助产,97 人剖宫产,47 人顺产。考虑到分娩方式对血流动力学的影响,分为阴道分娩及剖宫产亚组进行分析(表2,3)。结果显示剖宫产后第1 天两组间BNP 值差异有统计学意义(F=0.53,P<0.05)。单胎组两种分娩方式产后第1 天及第2 天内BNP 值差异有统计学意义。

表2 单胎组阴道分娩及剖宫产产时及产后的BNP 水平Tab 2 BNP levels between vaginal delivery and cesarean delivery in singleton pregnany group(pg/mL,x±s)
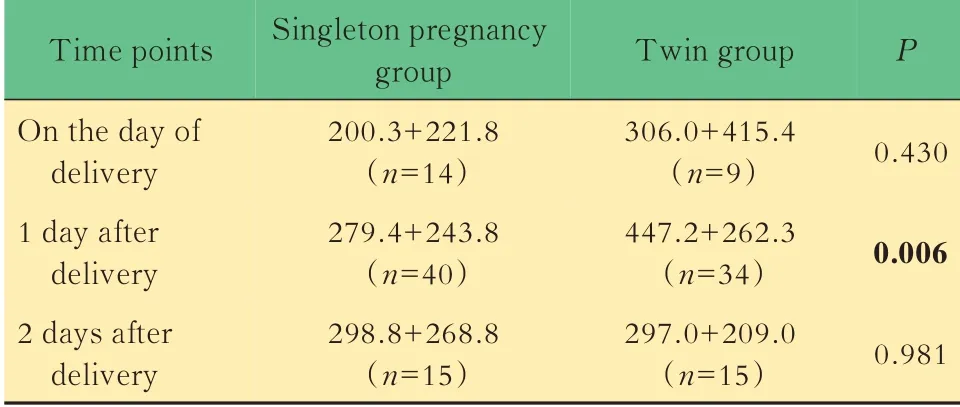
表3 单胎组与双胎剖宫产产时及产后BNP 水平Tab 3 Difference of BNP levels between singleton and twin in cesarean section (pg/mL,x±s)
讨 论
本研究以BNP 作为心脏负荷的观察指标,观察双胎与单胎妊娠模式下心脏负荷的变化。选择孕前、产时及产后阶段,通过严格的入组和排除标准尽量降低组间差异。研究发现双胎组孕晚期与正常单胎组相比心脏负荷未见明显改变,但双胎组产后第1 天BNP 水平显著升高,到产后第2 天恢复到和单胎组一致。矫正分娩方式的影响后,BNP 水平仍然显著增高,说明产后第1 天是双胎妊娠左心室负荷最重的时间段。
BNP 监测在双胎妊娠中具有潜在价值。报道双胎妊娠监测BNP 的文献较少,但有研究显示在孕晚 期和产 褥期BNP 升 高[2]。24 孕周时 双胎孕 妇血清NT-proBNP 水平(pg/mL)与单胎妊娠差异无统计学意义(P=0.071 8),但在35 孕周时显著高于单胎妊娠(P<0.000 1)[3]。本研究未比较24 孕周时两组BNP 水平,两组孕晚期BNP 水平差异无统计学意义。虽然孕期与单胎妊娠组心脏负荷差异无统计学意义,但产时及产后双胎组升幅加快,产后第2天也高于单胎组,但差异无统计学意义。流行病学研究发现,多胎妊娠和妊娠期高血压疾病(特别是子痫前期)是围产期心肌病的持续性和显著性危险因素,分别占所有围产期心肌病的7%~15% 和15%~68%[4]。因此需要警惕,双胎合并子痫前期是围产期心肌病的高危人群[5],双胎妊娠产后第1天是心脏负荷最重的关键时期。
多项研究已证实BNP 作为左心室负荷的观察指标。在非妊娠人群,心衰时心室充盈压升高,心室细胞参与分泌BNP,可以用于诊断左心室功能不全。血浆BNP 浓度与右房压力、平均肺动脉压、肺血管阻力和右心室质量呈正相关[6]。在非妊娠人群,BNP 是无症状的非心力衰竭患者发生心力衰竭以及其他心血管事件的预测因子。妊娠期BNP 水平与非妊娠期的平均水平存在差异,因此并不适用非妊娠期标准评价,双胎组心肺负担更重。本研究数据显示在单胎组产时和产后较孕期增加,而双胎组增加更加明显。本研究设置了严格入选标准及排除标准,但未针对同一孕妇做动态比较,因此不能排除组间差异对最终结果的影响。内科标准心衰参考值以BNP≥400 pg/mL 为慢性心衰。在双胎妊娠产后第1 天平均值就高于400 pg/mL,但本研究未对所有入组孕产妇进行心脏超声的动态随访。
BNP 的测定受多种因素影响,如年龄、性别、体重指数以及遗传因素,肾功能衰竭患者的BNP 水平也会升高。本研究中患者来源和测量方法均采用一致的检测方法。两组年龄差异无统计学意义,由于缺失体重指数,不能分析BNP 与体重指数间的关系。既往研究认为肥胖患者的血浆BNP 和NTproBNP 浓度往往低于非肥胖患者[7]。而孕期双胎及子痫前期人群以肥胖为高危因素。
本研究以BNP 作为监测指标对双胎妊娠模式下心功能的变化进行描述性研究,对临床了解双胎产前、产时及产后的心功能变化有一定帮助。后续研究可结合心超评价BNP 对双胎心功能监测的价值。

