CT引导下经皮冷冻消融治疗胃癌肝转移研究初探
胃癌患者中有4%~14%发生肝转移,并且死亡率较高[1,2]。传统意义上,肝转移的预后被认为较差。外科手术是转移性肝肿瘤标准治疗方法,尤其是在可切除的结直肠癌肝转移患者中,其5年生存率为40%~58%[3,4],而胃癌肝转移(GCLM)患者的5年生存率与之相比较低,为20%~35%,此外,只有20%~50%的患者可以进行手术切除[5,6]。目前,尚无用于GCLM 的标准化治疗方法。由于年龄较大、合并症较多、肝功能不良或存在肝外疾病等因素,大多数患者不能选择外科手术切除[7]。用于治疗GCLM 的临床方式包括全身化疗、肝切除、经皮乙醇注射(PEI)、冷冻消融(CA)、微波消融(MWA)、射频消融(RFA)和激光消融(LA)等,但是这些治疗方法效果不一。经皮冷冻消融是一种新的治疗方法,由于其良好的疗效、较低的并发症发生率等,已广泛应用于许多临床恶性肿瘤的治疗。在转移性肿瘤,尤其是在结直肠癌肝转移中,进行冷冻消融的研究日益增加,并且显示出明显的效果[8]。但是,冷冻消融用于胃癌肝转移的研究目前较少。本研究旨在探讨冷冻消融治疗胃癌肝转移的疗效、可行性及安全性,现报道如下。
1 材料与方法
1.1 一般资料回顾性分析2013年1月~2017年1月于我院就诊的胃癌发生肝转移19 例患者临床资料,共计27 个肝转移病灶,均行CT 引导下冷冻消融治疗。其中男14 例,女5 例,年龄32~85 岁;12例患者有1 个转移灶,6 例患者有2 个转移灶,1 例患者有3 个转移灶。胃切除术中有8 例出现同步肝转移,其余11 例为非同步肝转移。经PET-CT 扫描确认所有19 例患者仅表现为肝转移。转移性肿瘤长径1.2~4.7cm,平均3.1cm,所有病变均得到治疗。纳入标准:通过穿刺活检取得组织病理学依据,确认为肝转移灶;少于3 个肝转移灶;所有患者术前均接受常规血液检查,确认凝血功能无异常;肝功能状态Child-Pugh A 级或B 级,且除外合并术区感染。排除有进行性肝外疾病或肝衰竭迹象的患者。所有患者及家属在手术前签署书面知情同意书。
1.2 经皮冷冻消融治疗方案采用Galil CryoHit 氩氦刀冷冻消融系统,穿刺针规格分别为14G、16G和18G,针头温度可达-120℃~-165℃。整个治疗过程使用Philips 16 排多层螺旋 CT,确定穿刺点及穿刺路径,局部消毒、铺巾、区域浸润麻醉,在CT 引导下,将冷冻针通过最合适的穿刺路径穿刺到病变中。完成穿刺后,调整冷冻消融针与病灶的位置,满意后开始消融,消融时间为15~30min。根据肿瘤的位置、大小和数量选择合适的冷冻针数量、类型和配置。在冷冻消融手术期间,每3~5min 进行一次CT 扫描,以观察冰球的形状以及周围组织的变化。冷冻消融直至冰球延伸到肿瘤边缘以外约1cm。整个过程中密切监测患者的血压、心率和血氧饱和度。
1.3 化疗方案13 例患者采用氟嘧啶作为单一药物或结合铂类药物进行全身化疗。尽管胃癌肝转移患者的治疗中尚未证实冷冻消融后化疗的益处,但由于存在转移的风险,建议所有接受冷冻消融治疗的患者均接受化疗。使用伊立替康2 例,紫杉醇1例,氟嘧啶3 例,氟吡啶亚胺+铂基试剂7 例,其余6 例患者由于不愿或不耐受而未接受辅助化疗。
1.4 疗效评价和随访冷冻消融后每月进行一次增强CT 扫描和实验室检查,以评估治疗效果。技术成功被定义为对病变的精确识别,冰球充分延伸超过病变边缘5~10mm。患者均在冷冻消融后1 个月接受CT 增强扫描,以评估该技术的有效性。手术成功被定义为消融区域无增强,而治疗失败被定义为随访图像上出现结节状或不规则增强。局部肿瘤进展的特征为消融区出现新的强化病变,或该区的大小或界面变形增加。当局部肿瘤进展或出现消融区域外或其他器官的新转移灶时,判定为疾病进展。根据冷冻消融时间至任何原因导致的患者死亡时间对总生存期(OS)进行评估。
采用生活质量(QOL)评分(FACT4.0 版)对患者生活质量进行评估。该问卷包含27 个项目,分为4个子量表:身体健康(PWB)、功能健康(FWB)、社会福利(SWB)、情感福利(EWB)。参与者在冷冻消融治疗前(T0),冷冻消融治疗1 周(T1)、1 个月(T2)、3 个月(T3)和6 个月(T4)时填写问卷。
采用疼痛视觉模拟评分量表对患者进行疼痛评估。疼痛评分为0~10 分,其中0 分表示无疼痛,1~3 分轻微疼痛,4~7 分中等疼痛,8~10 分严重疼痛。在冷冻消融术前和术后1 个月评估疼痛值。
1.5 统计学分析采用SPSS 23.0 软件进行统计分析。使用t检验或非参数检验方法比较冷冻消融治疗前后的定量指标。使用Kaplan Meier 方法估算OS。P<0.05 为差异具有统计学意义。
2 结果
2.1 冷冻消融疗效所有患者在冷冻消融后1 个月进行增强CT 扫描,均达到有效消融,技术有效率为 100%,表明冷冻消融的可行性。CT 图像上测得坏死区域直径2.3~7.2cm,平均3.9cm。其中1 例患者术前、术中、术后CT 图像见图1。
2.2 生存分析在随访期间,有12 例患者(63.2%)死亡,7 例患者(36.8%)随访至今。冷冻消融治疗患者的OS 为5~51 个月,中位OS 为16.0 个月。1年、2年和3年生存率分别为78.9%、43.4%和21.7%,见图2。冷冻消融后局部肿瘤无进展生存期(PFS)为4~24 个月,中位PFS 为8.0 个月,6 个月和12 个月无进展生存率分别为59.2%和23.2%,见图3。 15 例患者在消融部位出现复发性肿瘤或肝脏或其他器官的新病变,其中4 例显示肝内和肝外复发,而11 例仅显示肝内复发。在11 例仅发生肝内复发的患者中,有8 例仅在残余肝脏中复发,而在消融部位未见复发。单纯肝内复发患者可进行重复冷冻消融治疗,出现多种肝外复发的患者接受积极化学疗法、支持治疗等。
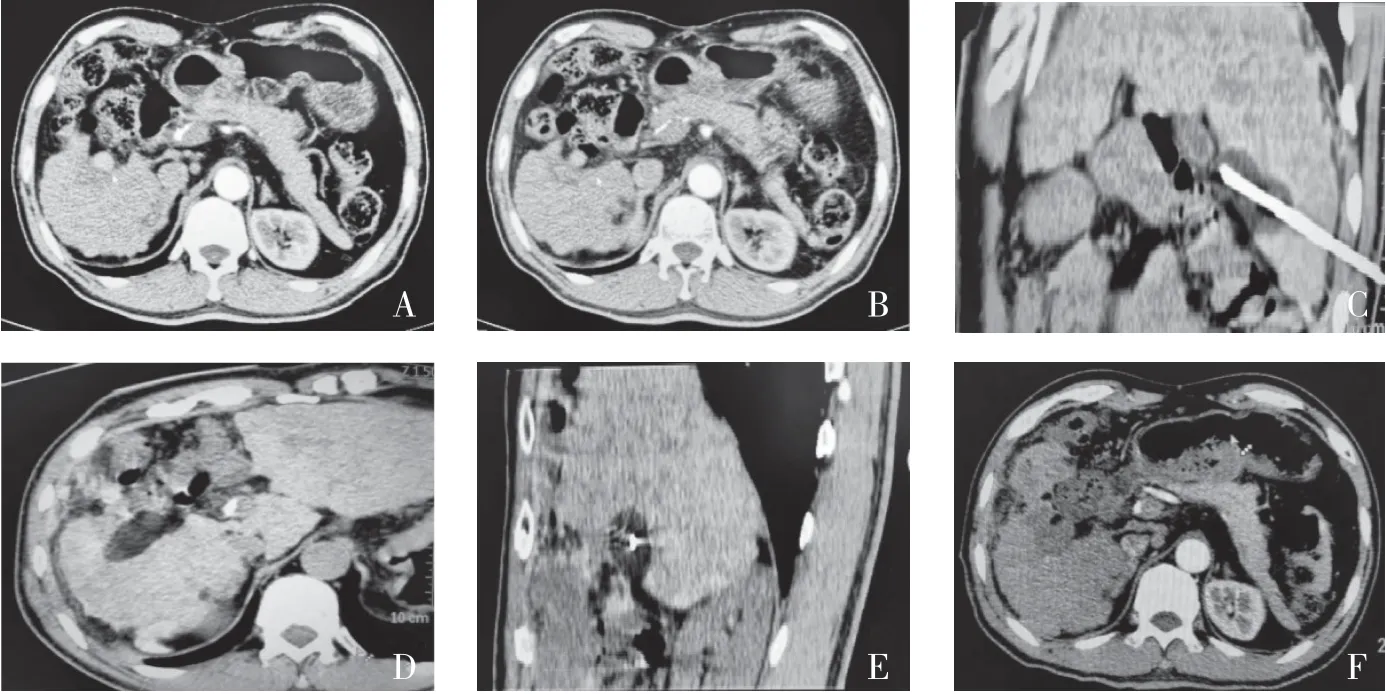
图1 患者冷冻消融术前、术中、术后CT 图像
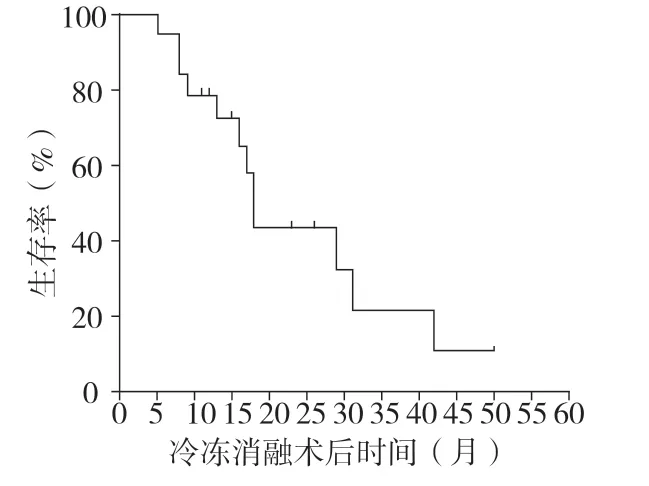
图2 冷冻消融治疗胃癌转移性肝肿瘤的总生存曲线
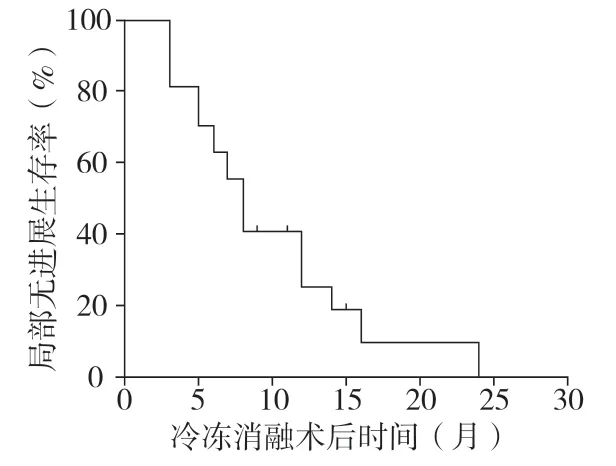
图3 冷冻消融治疗胃癌转移性肝肿瘤局部无进展生存曲线
2.3 生活质量与术前相比,冷冻消融治疗后在T2、T3 和T4 时,总QOL、PWB 和FWB 平均得分提高(P<0.05),而在T1 时则有所下降(P<0.05),见表1。
2.4 疼痛缓解情况冷冻消融术前,有9 例患者出现中度或重度疼痛症状,所有患者均需使用阿片制剂控制疼痛。冷冻消融治疗后1 个月,9 例患者中有7 例患者疼痛得到缓解,最初出现严重疼痛的2例患者在冷冻消融治疗后表现为轻度疼痛;3 例中度疼痛患者术后有轻度疼痛;2 例中度疼痛患者术后疼痛完全缓解。
2.5 并发症10 例(52.6%)因手术操作在治疗后穿刺部位或目标病变处感到疼痛;9 例(47.4%)出现不同程度发热,但体温未超过38.5℃,且均在1 周内自行消退;6 例(31.6%)出现反应性胸膜炎;2 例(10.5%)出现一过性肝功能下降;1 例(5.3%)出现肝周积液,无气胸发生。
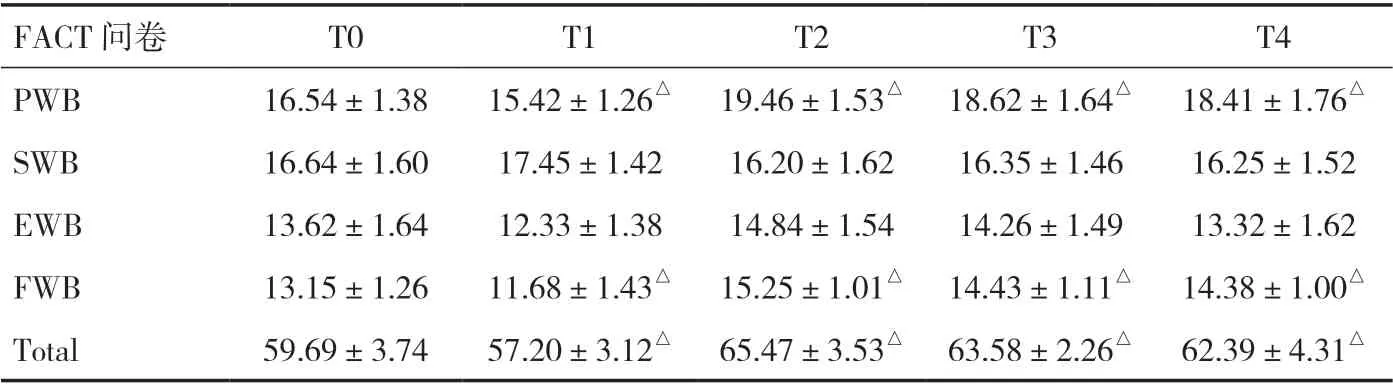
表1 生活质量评估(分)
3 讨论
与结直肠癌相比,尽管胃癌转移灶局限于肝脏,但由于转移途径、生物学特性和侵袭性不同,胃癌肝转移仍被认为是全身性疾病。因此,全身化疗被指定为标准疗法,而不是局部疗法。与广泛接受的大肠癌肝转移局部治疗策略相反,胃癌肝转移的局部治疗很少进行,结果也有所不同[2,9,10]。目前,经皮消融治疗被认为是患者负荷小且肝外疾病稳定的肝转移患者的一种替代治疗。经皮消融治疗包括经皮乙醇注射、冷冻消融、微波消融、射频消融和激光消融等。研究表明,RFA 对GCLM 患者安全有效,中位OS 为10.0~30.7 个月,1年生存率为66.8%~73.4%[11,12]。CT 引导下大剂量近距离放射疗法是一种新的肿瘤疗法,其技术有效率为100%,中位PFS 为(3.5±6.3)个月,并且在(6.1±6.8)个月的随访期间无局部复发,取得了较为满意的效果[13]。
由于不同研究中患者选择标准不一致等,关于PFS、OS 和复发的结果可能不同。Chen 等[14]研究RFA 治疗GCLM 的有效性和安全性,1年、2年、3年和5年生存率分别为70%、11%、5%和3%。在Lee 等[15]的研究中,按照RFA 方法,1年、2年和5年生存率分别为73.7%、34.7%和14.5%;另外,在6 个月、1年和2年时局部肿瘤无进展生存率分别为52.4%、45.8%和34.4%。当前,冷冻消融被认为是治疗不允许切除的肝恶性肿瘤安全有效的选择。然而,有关冷冻消融治疗肝转移的大多数数据来自结直肠癌患者的报道[8],治疗GCLM 的数据有限。在本研究中,接受冷冻消融的19 例患者中位OS 为16.0 个月(5~51 个月),1年、2年和3年生存率分别为78.9%、43.4%和21.7%,肿瘤中位PFS 为8.0 个月(4~24 个月),而在6 个月和12 个月时局部肿瘤无进展生存率分别为59.2%和23.2%。结果表明,就疗效而言,冷冻消融与RFA 相似。然而,在对包括胃癌在内的各种癌症肝转移进行冷冻消融治疗的文献综述后,Bala 等[16]并没有得出相同的结论,认为与未行冷冻消融治疗相比,没有证据支持冷冻消融治疗的有效性。原因可能为Bala 等分析的大多数研究是在20 多年前进行的,冷冻消融目前的技术熟练度及可操作性已经有了极大的改进。此外,在其研究中胃癌患者仅占全部123 例病例的7.3%,大多数患者为结直肠癌病例。因此,Bala 等的结论可能不适用于胃癌患者,有必要进一步研究,特别是前瞻性研究,以确定和验证冷冻消融在GCLM 中的有效性。冷冻消融除临床有效性外还具有其他优势。目前,冷冻消融技术可以通过CT 监视和跟踪整个消融过程,从而使治疗区域更加清晰可辨。重要的是,与其他热消融疗法相比,术中和术后疼痛的低发生率是冷冻消融的一项特殊优点,这使得患者可以在清醒的情况下接受冷冻消融治疗[17~20]。特别是对于一些特殊位置的病灶(肝包膜下、门静脉旁、胆囊旁等),冷冻消融具有其不可替代的优势。此外,越来越多的研究证实,冷冻消融后肿瘤抗原会触发肿瘤特异性免疫反应,从而有助于消除远处转移并预防复发性疾病[21]。
在评估肿瘤负荷、治疗效果和预后时,必须进行QOL 评估。本研究中使用的FACT 问卷是Cella等[22]开发的国际公认的问卷,其可靠性和有效性已得到证实。目前对冷冻消融后肝转移患者生存质量的研究有限,本研究中,与手术前相比,患者在手术后1、3 和6 个月的总体生活质量显著改善,尤其是PWB 和FWB 量表。但是,在冷冻消融后1 周,QOL、PWB 和FWB 略有下降,这可能是由消融后综合征(如疼痛、炎症、水肿和肝功能损害)引起的。因此,有效保护肝功能和选择短效糖皮质激素以减少可能的炎症对于接受冷冻消融的患者十分必要。但是,随着消融后症状的改善和肿瘤负荷的逐渐减小,生活质量也得到相应改善。此外,术前疼痛患者在消融后1 个月获得不同程度的缓解,可能由于肿瘤负荷的减轻。肝转移癌的冷冻消融耐受性良好,本研究中未发生严重并发症。大多数患者表现为自限性症状,如穿刺部位或目标病变处疼痛、不同程度发热、短暂性肝损伤等,均自行恢复或给予及时对症支持治疗而恢复。这些结果可能归因于对术前患者的严格选择,以及影像引导设备的不断进步,使冷冻消融能够展现各种特殊优势,包括侵入性更小、定位和穿刺更精确等。此外,由于技术的进步,探头更小,穿刺损伤进一步减小,确保了手术的安全性。
综上所述,CT 引导下冷冻消融是一种微创技术,并发症较少,其对于GCLM 患者安全、有效,并可以明显改善患者生活质量,因此可以在临床实践中用于GCLM 的姑息治疗。

