莲杆炭对土壤酶活性的影响
方舰 张瑞玲 张子来


摘要:为考察莲杆炭对土壤酶活性的影响,在土壤中添加制备获得的不同热解温度和不同浓度的莲杆炭。通过利用莲杆炭调节土壤中的营养物质,然后对土壤进行检测,观察这些物质含量的变化及对土壤酶活性的影响。主要对过氧化氢酶、pH值、土壤阳离子交换量(CEC)和有机质(SOM)等四个指标来详细的说明。特别是热解温度为650℃,生物炭添加量为100g/kg时,土壤中的理化指标均达到最大值,酶活性也显著增强,达到调节能力达到最大值,为研究土壤的酶活性变化提供了实验依据。
Abstract: To investigate the effect of lotus stem carbon on soil enzyme activity, different pyrolysis temperatures and concentrations of lotus stem carbon were added to the soil. The nutrient content in soil was regulated by the use of lotus stem carbon, and then the content of these substances was measured to observe the change of soil enzyme activity. The four indexes of catalase, pH value, soil cation exchange capacity (CEC) and organic matter (SOM) were described in detail. In particular, when the pyrolysis temperature was 650℃ and the biochar addition was 100g/kg, the physical and chemical indexes in the soil reached the maximum value, and the enzyme activity was significantly enhanced to reach the maximum value of the regulation capacity, providing experimental basis for studying the changes of soil enzyme activity.
关键词:生物炭;理化性质;微生物;土壤过氧化氢酶
Key words: biochar;physical and chemical properties;microorganisms;soil catalase
中图分类号:S154 文献标识码:A 文章编号:1006-4311(2020)23-0214-03
1 概述
生物炭是由作物秸秆、木屑、粪便等废弃生物质,在绝氧条件下经高温热解产生的黑色固态炭质,一般呈碱性[1]。生物炭已被公认为解决土壤问题的一种方法。生物炭可以提高研究土壤的肥力,因為增加土壤有机碳(SOC)含量和阳离子交换能力(CEC)、提高速效磷(AP)会增加该土壤中植物的生长,生物炭可以增强(SOC)的聚集,从而减少C的损失[3]。土壤酶主要来源于土壤中动物、植物根系和微生物的细胞分泌物以及残体的分解物。通过室内培养实验发现,施用生物炭可提高土壤中过氧化氢酶的活性,尤其是高水平添加量具有显著的促进作用,这可能主要与土壤微生物活性的增大以及数量的增加有关。同时,添加生物炭主要通过改善土壤的理化性质,如养分状况、pH值、阳离子交换能力等来促进酶的活性[2,4]。
本研究在土壤中添加制备获得的不同热解温度和不同浓度的莲杆炭。为了解莲杆炭对土壤酶活性的作用提供依据。同时从土壤中添加生物炭后的pH、有机质(SOM)、有效磷(AP)、速效钾(AK)等综合理化性质的方面进行阐述。其中详细讨论莲杆炭添加到土壤中培养后土壤过氧化氢酶、pH、阳离子交换量(CEC)以及土壤有机质(SOM)这四个指标。
2 材料和方法
2.1 生物炭的制备
把莲杆放置实验室内让其自然风干,然后用粉碎机碾碎,研磨后,用100目筛过滤,得到的粉末放入密封袋中,用于热解。将收集到的粉末置于石英坩埚中,填满,分别在450℃、550℃、650℃、750℃热解温度下经中环实验电炉单温区管式炉(SK-G08123K)进行热解。冷却后将得到的炭放入储存在干燥器中备用,分别标记为LSBC450、LSBC550、LSBC650、LSBC750。
2.2 土壤收集
收集天津市西青区独流减河河岸表层土壤(117°3′59"E-117°3′59"E,39°0′5"S-117°3′59"S),清除土壤表面的植物残渣和石块。收集土壤(0-20cm)到的土放入实验室自然风干,再用研磨粉碎,经过100目筛取较细的粉末,放入烧杯中备用。土壤的基本理化性质详见表1。
2.3 试样制备
称取1000g土壤,分别称取20.0、40.0、60.0、100.0以及200.0g/kg四种不同热解温度的莲杆炭,混合均匀后置于平底玻璃筒中,每个处理3次重复操作。将对照组(CK)、莲杆炭组(C,不添加任何土壤)以及实验组(污泥炭与土壤混合)置于密闭培养箱内,环境温度为25℃,四周后检测基本理化性质如表1所示。
2.4 测量指标
土壤pH、土壤有机质、土壤速效钾、土壤全磷、土壤有效磷、土壤阳离子交换量、电导率以及土壤全钾。土壤过氧化氢酶:采用北京Solarbio公司生产的土壤过氧化氢酶(S-CAT)试剂盒对土壤过氧化氢酶进行检测。
2.5 数据处理分析
采用Excel 2010对数据进行处理,用Origin Pro 2018 作图,用SPSS 24.0 进行显著性分析。文中出现的数值均为平均值,统计显著水平为p<0.05。
3 分析与讨论
3.1 莲杆炭在不同热解温度下对其他理化性质的影响
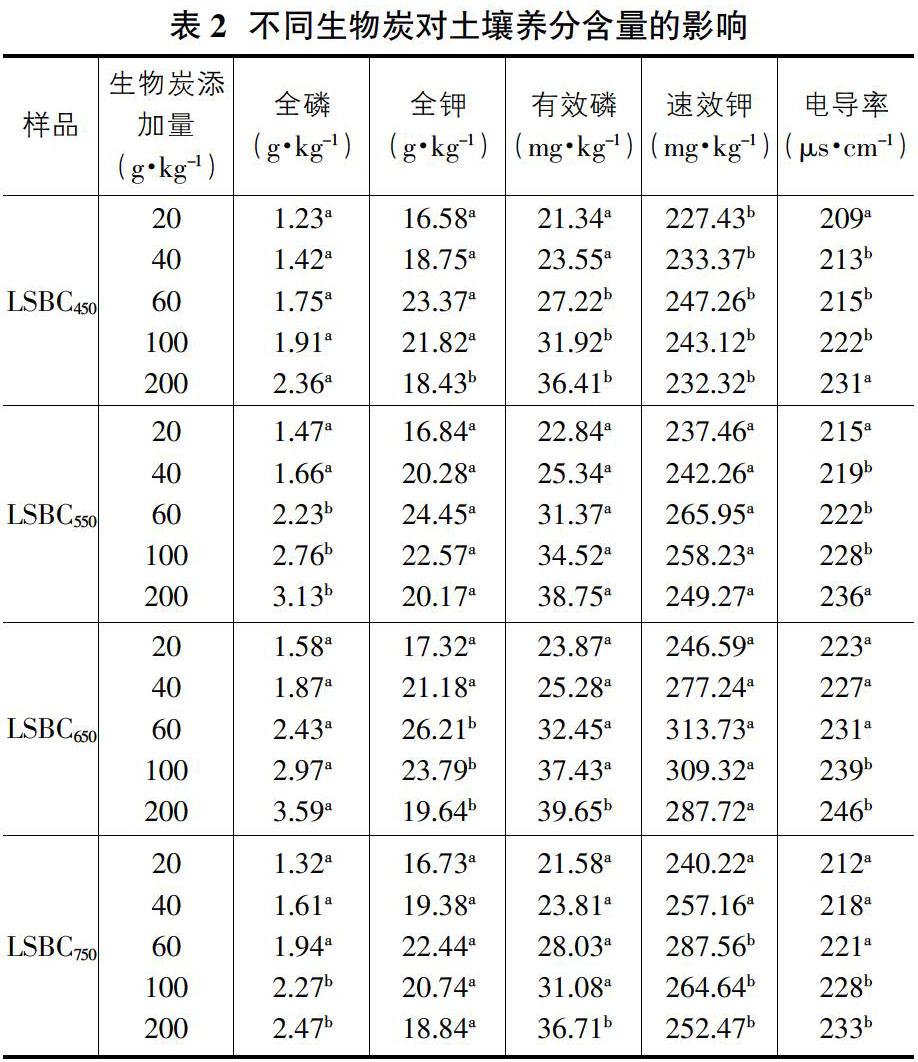
生物炭的施用,通过吸附到其大而多孔的表面,从而降低了养分的浸出损失。这一过程增加了土壤中有效磷和有效钾的浓度,从而增加了植物的生长和产量[7]。通过表2的观察可以发现,添加莲杆炭都使土壤中总磷(TP)、有效磷(AP)、总钾(TK)、速效钾(AK)和电导率等有不同程度的增加。
3.2 不同热解温度的莲杆炭对土壤过氧化氢酶(S-CAT)、pH值、CEC和有机质(SOM)的影响
添加莲杆炭对土壤中过氧化氢酶活性的影响,有早期有抑制作用随后转为促进作用,而且高水平的生物炭添加量对过氧化氢酶的促进作用小于中低水平的添加量,其原因可能是大量生物炭的加入会通过吸附酶分子而对酶促反应结合位点形成保护,从而阻止酶促反应的进行[3,5-6]。其具体作用机理及方式还有待进一步深入研究。由图1(a)可知,通过与CK(对照)组相比,在不同的热解温度条件下,土壤中过氧化氢酶活性有不同程度的促进或抑制作用。同时,生物炭在热解温度(650℃)下的作用效果也是最显著的,这也说明其他热解温度(450℃、550℃和750℃)实际效果不明显。其中在100g/kg达到了32.45U/g,比原土壤中的酶活性20.58U/g增加了11.87U/g。添加不同量的莲杆炭对过氧化氢酶活性有着不同的促进作用。
施用生物炭导致土壤pH值升高的现象,原因是生物炭是碱性的,含有富含碱性基团的矿物碳酸盐[8]。因此,在相同的热解温度下,随着生物炭含量的增加,添加莲杆炭后的土壤pH值会越来越高,但添加莲杆炭的pH值永远不会到达的pH值(C组)。原因是土壤的pH值从一开始是低于莲杆生物炭的pH值。
从图1(b)中,可以观察到,从450℃到750℃,测试土壤的pH值与准备的莲杆炭充分混合后总是pH值低于C组之外,随着莲杆炭的量逐渐增加,控制土壤中莲杆炭经接触反应后pH值逐渐升高,pH值总是会逐渐增加,不会达到最大值然后下降。然而,热解莲杆生物炭温度在650℃时,测试后的pH值达到最大,其中,在200g/kg条件下pH到达了9.07,与原土壤pH相比上升了0.78。从总体上看,温度对土壤pH值的影响不大,不同热解温度下产生的生物炭具有相似的增加控制土壤pH值的趋势。
本试验结果表明,添加莲杆炭使得土壤中的酶活性大部分均高于未添加生物炭处理,表明土壤中的生物炭能够促进土壤中过氧化氢酶的活性。热解温度对土壤酶活性影响较大,不同热解温度下制备的莲杆炭对土壤中的酶活性影响不同,生物炭施入量的加大显著降低了过氧化氢酶活性,这可能是生物炭施入增加了土壤pH,间接影响了土壤酶活性,在提高酶活性的同时也被一些因素限制的原因。
生物炭的添加导致土壤CEC的增加可以通过两种可能解释。首先,生物炭吸附土壤有机质和其他化合物,这种能力随着生物炭氧化程度的增加而增加。生物炭吸附增加电荷密度,从而提高土壤CEC [9-10]。其次,生物炭应用于土壤后逐渐氧化,芳香环被COO-官能团取代,生物炭表面的总负电荷增加,从而提高了土壤的CEC[11]。
在图1(c)中,在温度相同的条件下,不同的莲杆炭添加量也会引起CEC值的波动,通过观察650℃的莲杆炭,当含量达到100g/kg時,CEC值达到最大值,到达了24.332(cmol/kg)而莲杆炭的其他添加量也有促进,但效果没有那么明显。最后,制备莲杆炭确实可以控制土壤的CEC值增加。添加生物炭可提高土壤有机质和溶解性有机质的含量[12],而有机质中含有较多可利用的碳源、氮源等,为土壤微生物的生长提供了更易利用的营养物质,有利于微生物的生长,生物炭对反应底物的吸附也有助于酶促反应的进行而提高土壤酶活性[13]。
根据图1(d),在不同热解温度条件下,与CK(对照组)相比,虽然添加到对照土壤中的莲杆生物炭含量不同,但SOM值仍有较为明显的增加,尤其是100g/kg的莲杆生物炭对于SOM值的增幅最大,最大值为50.811g/kg。在相同的热解温度条件下。例如650℃,测试土壤中的SOM值随添加到土壤中的莲杆炭的含量增加而增加。由图1(d)可知,这意味着100g/kg可以作为本实验的边界线。另一方面,相比其他莲杆炭含量(20、40、60以及200g/kg)而言,100g/kg莲杆炭对土壤的SOM值影响最大。通过将图1(a)与图1(d)对比发现,土壤中的有机质含量变化趋势和土壤中的过氧化氢酶的活性趋势类似,再次说明了有机质与土壤过氧化酶有着重要的联系。
3.3土壤过氧化氢酶(S-CAT)与pH值、CEC和土壤有机质(SOM)等理化性质的相关性
土壤理化性质各因素之间进行相关性分析(表3)。结果显示,pH、有机质和阳离子交换量是土壤过氧化氢酶活性的主要控制因素。
4 结论
研究利用不同热解温度和浓度的莲杆炭对土壤的理化性质的影响。不同浓度、不同热解温度的莲杆炭对土壤处理可以概括如下:①莲杆炭可以将土壤中的土壤过氧化氢酶活性升高,从而改善微生物生长环境的假设。②莲杆炭的添加,改善了土壤有机质(SOM)、阳离子交换量(CEC)、总磷(TP)、有效磷(AP)、总钾(TK)、速效钾(AK)等土壤化学性质,表明生物炭对增强土壤肥力。③同一热解温度下,随着莲杆炭的增加,土壤中的pH、电导率在不断的增大,这是因为土壤中的杂质增多。可以改善土壤的酸碱性,为植物的生长提供生长环境。④在一定范围内,莲杆炭的添加增加了起到了促进作用,但随着量的增大,也会产生抑制。在热解温度为650℃,生物炭添加量为100g/kg时,各种土壤化学性质达到最大值。综上所述,对于莲杆炭的性质和土壤的性质了解,添加莲杆炭有助于改变土壤性质。
参考文献:
[1]Mohammad Ghorbani,Hossein Asadi,Sepideh Abrisham-kesh. Effects of rice husk biochar on selected soil properties and nitrate leaching in loamy sand and clay soil[J]. International Soil and Water Conservation Research 7 (2019) 258-265.
[2]Gul S, Whalen JK, Thomas BW et al. Physicochemical properties and microbial responses in biochar-amended soils: mechanisms and future directions[J]. Agric Ecosyst Environ ,2015,206:46-59.
[3]Liu X, Zhang A, Ji C, Joseph S, et al. Biochars effect on crop productivity and the dependence on experimental conditions-a meta-analysis of literature data[J]. Plant Soil, 2013,373, 583-594.
[4]Zhu X, Chen B, Zhu L, et al. Effects and mechanisms of biochar-microbe interactions in soil improvement and pollution remediation: a review[J]. Environ Pollut , 2017,227:98-115.
[5]Burns RG, DeForest JL, Marxsen J, et al. Soil enzymes in a changing environment: current knowledge and future directions[J].Soil Biol Biochem ,2013,58:216-234.
[6]Henry HAL. Reprint of Bsoil extracellular enzyme dynamics in a changing climate[J]. Soil Biol Biochem,2013, 56:53-59.
[7]Biederman LA, Harpole WS .Biochar and its effects on plant productivity and nutrient cycling: a meta -analysis[J]. GCB Bioenergy ,2013,5:202-214.
[8]Yuan JH, Xu RK. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic ultisol[J]. Soil Use Manag,2011, 27:110-115.
[9]Wang J R, Wan F, Lü Q F, et al. Self-Nitrogen-Doped Porous Biochar Derived from Kapok ( Ceiba Insignis ) Fibers: Effect of Pyrolysis Temperature and High Electrochemical Performance[J]. Journal of Materials Science & Technology, 2018.
[10]Lee JW, Kidder M, Evans BR et al. Characterization of biochars produced from cornstovers for soil amendment[J]. Environ Sci Technol ,2010,44:7970-7974.
[11]Mao JD, Johnson RL, Lehmann J et al. Abundant and stable char residues in soils: implications for soil fertility and carbon sequestration[J]. Environ Sci Technol,2012, 46:9571-9576.
[12]Liqiang Cui, Chuntao Yin, Tianming Chen,et,al. Remediation of organic halogen- contaminated wetland soils using biochar[J]. Science of the Total Environment. 2019:134087.
[13]周震峰,王建超,饒潇潇,等.添加生物炭对土壤酶活性的影响[J].江西农业学报,2015,27(6):110-112.

