温敏型脂质纳米粒的制备及其识别微波消融边界效果
周 黎,郑元义,王志刚,徐金顺
(1.重庆医科大学附属第二医院超声科,重庆 400010;2.重庆医科大学超声影像学研究所,重庆 400010;3.上海交通大学附属第六人民医院超声医学科,上海 200233;4.四川大学华西医院超声科,四川 成都 610041)
微波消融为局部热消融技术之一,能在相对较短时间内使组织温度升高而发生凝固变性坏死,最终灭活肿瘤细胞或根除肿瘤。经皮微波消融是安全、微创、疗效确切的非手术治疗肿瘤方法[1-2],但消融过程中肿瘤组织形成的气化区易引起消融漏空,导致肿瘤残留,且可能对毗邻正常组织产生过热损伤,消融后肿瘤复发率仍较高。为确保热消融临床治疗效果,实现一次性临床灭活肿瘤,明确肿瘤消融安全边界是其中关键。超声造影对于动态识别肿瘤坏死区和非坏死区、即时评价消融治疗效果、术后评估组织凝固坏死及肿瘤残留情况等具有重要临床价值[3-5]。本研究拟制备包裹液态全氟化碳的温敏型脂质纳米粒(heat-sensitive lipid nanoparticle, HLNP)超声造影剂,并观察其评估微波消融边界的效果。
1 材料与方法
1.1 主要材料与设备 主要材料包括二硬脂酰磷脂酰乙醇胺(distearoyl-phosphatidylethanolamine, DSPE)、二棕榈酰磷脂酰甘油(diphosphatidylglycerol, DPPG)、二棕榈酰磷脂酰胆碱(dipalmitoylphosphatidylcholine, DPPC)、全氟戊烷(perfluoropentane,PFP)、胆固醇、氯仿(CHCl3)、pH为7.4的磷酸盐缓冲液(phosphate buffer solution, PBS)及琼脂糖粉。所用设备包括多功能微波治疗仪(南京亿高公司,ECO-100,功率可调10~80 W),冷循环微波针(EO100C 2450 MHz,18G),激光粒径测量仪(Malvern公司),Esaote MyLab90超声诊断仪。
1.2 制备HLNP 将DSPE、DPPG、DPPC和胆固醇的混合物10 mg溶于含有5 ml氯仿的烧杯中,用封口膜封口,磁力搅拌至透明溶液,利用旋转蒸发器旋蒸形成脂质薄膜,而后加入2 ml PBS水合至薄膜完全溶解;以超声波破碎仪在冰浴条件下乳化溶液,并在乳化过程中缓慢滴注200l PFP,最后经过离心洗涤形成包裹PFP的HLNP,贮存于4℃冰箱内。在光学显微镜下观察纳米粒大小、分布及外观等情况,采用激光粒径仪测量其粒径。
1.3 HLNP体外热相变实验 用去离子10倍水稀释HLNP,取其中1滴置于载玻片上,盖上盖玻片放入加热板中持续加热;以倒置显微镜实时观察HLNP热相变进程,记录HLNP开始出现热相变时的温度值。
1.4 微波加热含HLNP凝胶模型实验 按1%V/V将琼脂糖粉溶于双蒸水,加热至琼脂糖完全溶解后冷却,制成琼脂糖凝胶孔洞模型。以含HLNP凝胶模型为实验组,单纯脂质悬液凝胶模型为对照组,于超声实时引导下将冷循环微波消融针沿孔洞垂直方向穿入凝胶模型内,微波针尖位置作为0点,在距离针尖2.5、3.5、4.5、5.5 cm的4个孔洞中分别加入等量HLNP,以微波治疗仪(消融功率设定为60 W,消融时间为3 min)加热凝胶模型,同时利用超声诊断仪实时观察凝胶孔洞模型中HLNP的超声回声变化情况,得到加热前后凝胶模型中纳米粒的二维超声声像图。
1.5 HLNP评估微波消融离体牛肝边界效果观察 将复温、脱气后的新鲜离体牛肝切成6 cm×3 cm×3 cm块状备用。于超声引导下将冷循环微波刀沿侧面插入牛肝组织,利用超声诊断仪实时定位并锚记穿刺点,确定纳米粒进针部位,拟定微波消融中心为0点,在距消融中心2.5 cm处沿垂直于肝表面方向局部注射纳米粒,并以60 W微波消融牛肝3 min,超声实时观察离体牛肝与纳米粒在微波消融作用下的声像图变化。而后切开牛肝,观察注入HLNP处及微波消融处牛肝大体变化,并对牛肝组织进行HE染色,观察其病理学改变。对照组以脂质悬液代替HLNP。
2 结果
2.1 HLNP一般理化特性 纳米粒外观呈乳白色混悬液,光学显微镜下纳米粒大小均一,分布较均匀,分散度较好(图1)。HLNP可于4℃条件下保持稳定状态3天,平均粒径(507.90±101.70)nm(图2)。

图1 光镜下观察包裹PFP的HLNP(×400) 图2 HLNP粒径分布图 (强度指某粒径纳米粒所占体积百分比)
2.2 体外HLNP热相变 加热板温度达到45℃时开始出现纳米粒相变所产生的微气泡,且微气泡直径和数量逐渐增多,加热至50℃ 1 min后产生大量气泡。见图3。

图3 光镜下观察HLNP热相变 A.加热45℃时HLNP开始出现热相变(×400);B.50℃加热1 min后产生大量气泡(×400)
2.3 超声观察微波加热凝胶模型 微波加热前,二维超声显示HLNP组和对照组均为以无回声为主, 伴周围环状稍高回声。微波消融针加热后,HLNP组距离微波消融针较近2个孔洞较辐照前回声强度明显增强,呈密集高回声,距离微波消融针较远2个孔洞较辐照前回声强度也有所增强,周围呈明显高回声;对照组4个孔洞超声回声强度较辐照前未见明显改变。见图4。

图4 HLNP组凝胶模型及对照组体外超声显像 A、B.HLNP组微波加热前(A)及加热后(B)二维超声声像图;C、D.对照组微波加热前(C)及加热后(D)二维超声声像图;E.微波加热含HLNP凝胶模型示意图
2.4 微波消融含HLNP离体牛肝 随着温度升高,消融区牛肝产生明显气化区,注入HLNP纳米粒处牛肝由弱回声逐渐变为高回声,最终表现为强回声后方伴声影,形成明显气化区,切开牛肝组织肉眼观察发现该处肝组织由红色变为白色。对照组仅消融区域牛肝产生气化区,注入脂质悬液处牛肝回声及大体组织表现未见明显变化(图5)。对HLNP组变为白色区域组织行HE染色,光学显微镜下见牛肝细胞出现点状坏死及脂肪变性(图6)。

图5 HLNP组和对照组微波消融离体牛肝效果 A~C.HLNP组微波消融离体牛肝前(A)、消融过程中(B)及消融后(C)超声声像图;D.HLNP组微波消融牛肝及注入HLNP处牛肝大体变化;E~G.对照组微波消融离体牛肝前(E)、消融过程中(F)及消融后(G)超声声像图;H.微波消融对照组牛肝及注入脂质悬液处牛肝大体变化 (红圈示消融位置)
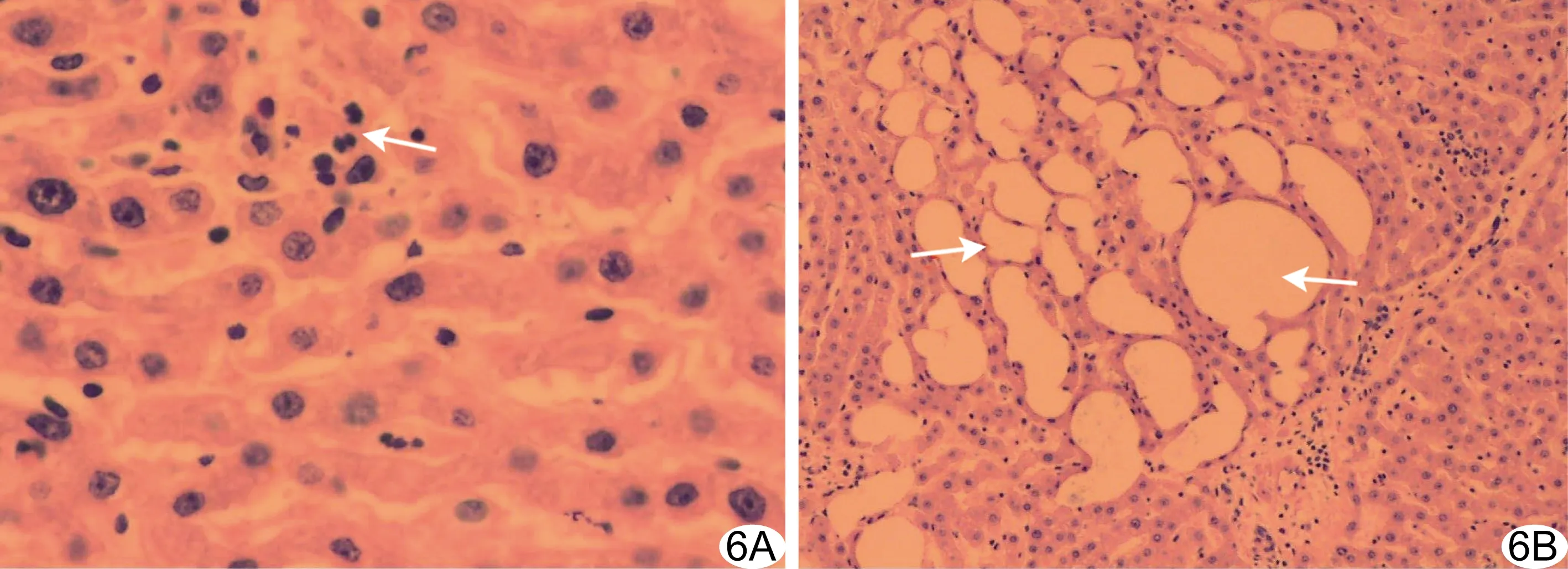
图6 HLNP组微波消融后牛肝组织病理图示肝细胞出现点状坏死(A, HE,×200,箭)及脂肪变性(B,HE,×100,箭)
3 讨论
肿瘤局部热消融技术包括射频消融、微波消融、激光治疗及高强度聚焦超声(high intensity focus ultrasound,HIFU)等[6],主要原理是利用多种形式的物理方法将组织加热到一定温度,使其发生凝固性坏死,最终达到彻底杀灭癌细胞的目的;其中微波消融技术因升温速度快、加热效率高、消融时间较短且消融范围大及凝固性坏死彻底等优点而展现出较大优势[7-8]。临床较常使用的微波频率为2 450 MHz,消融能量较高,易于集中,但消融深度不足,且肿瘤形态不规则时,微波消融热能分布不甚均匀;另外,肿瘤周围的“血池效应”亦影响微波消融热场的分布[9],使邻近血管的肿瘤组织可能出现温度过冷区,未达消融温度而不能发生凝固性坏死,导致癌细胞残留。因此,如何完全消融肿瘤,同时避免损伤邻近胆囊、胆管、膈肌、肾脏或血管等重要脏器,是保证热消融治疗效果的关键,也是评价疗效时备受关注的问题。
本实验所用PFP属于液态全氟化碳化合物中的一种,其在大气压下的沸点是29℃,在加热、超声、激光等作用下易受到激发而产生液气相转变[10-11]。本实验中HLNP在加热板作用下产生大量气泡,间接证实HLNP能发生液气相转变。另外,在微波热效应作用下,距离微波消融中心越近的凝胶孔洞模型超声显影效果越明显,而对照组回声未见明显改变,说明纳米粒能通过微波热能传递达到相变温度发生液气相转变,且凝胶孔洞中纳米粒超声增强显像特征可作为评估微波消融边界的潜在指标,为离体牛肝实验奠定了基础。
微波消融离体牛肝实验结果显示,利用60 W、180 s的微波消融参数所产生的凝固灶纵径约为3 cm,故在距离消融凝固灶纵径边界约1 cm处牛肝内注入纳米粒,模拟肿块微波消融凝固灶与毗邻重要组织脏器的界限,且避开微波消融产生的气化区,以利于实时观察邻近重要组织器官一侧的离体牛肝注入纳米粒后在微波消融作用下产生的效果。既往有学者[12]采用聚乳酸-羟基乙酸共聚物(poly-lactic-co-glycolic acid,PLGA)壳材包裹液态全氟化碳制备的纳米粒可通过加热发生液气相变,并可通过超声实时显像确认肿瘤消融边界。已有研究[13]证实包裹PFP的纳米粒能在微波消融作用下发生相变,同时增强微波消融效果。本实验通过超声实时监测发现距消融凝固灶边缘约1 cm处注入HLNP的牛肝经过微波消融产生明显气化区,超声可见该处回声由弱逐渐增强的变化过程;牛肝组织大体颜色由红色变为白色,且光镜下观察发现该处牛肝细胞有明显点状坏死和脂肪变性。上述结果表明,HLNP受到微波热效应传递的影响后发生液气相变,使得消融区与邻近正常组织之间的对比度增加,在微波消融气化区周围注入纳米粒的牛肝处形成明显气化区,有助于通过观察超声变化和大体变化,以识别微波消融灶与周围组织的界限;注入纳米粒处牛肝超声回声明显增强提示微波消融达到安全边界,有利于避免损伤邻近组织,最大程度地消融肿瘤,减少肿瘤残留和复发;同时可根据肿瘤与周围组织脏器的距离设定纳米粒与微波消融气化区的距离。既往文献[14]报道,正常组织细胞的温度安全界限为(45±1)℃,本研究中HLNP的相变温度与之相近,提示HLNP不仅有助于评估肿瘤消融边界,还能使微波消融在最大限度杀伤肿瘤组织的同时保护周围组织脏器不受损伤,尤其对于特殊位置的肿瘤,如邻近肝门、胆管、下腔静脉等重要血管、脏器者。
综上所述,HLNP有望成为用于评估微波消融边界的热敏剂,结合超声成像实时监控微波消融效果能提高微波消融的可控性和安全性。

