少弱精症大鼠模型血清激素水平及睾丸形态学变化的研究
张盼盼,陈胜国,薛志琴, 美合日古丽·萨塔尔, 潘晓楠, 童卓云
(新疆医科大学基础医学院人体解剖学教研室,新疆 乌鲁木齐)
0 引言
睾酮(testosterone,T)作为最重要的雄激素,95%由睾丸间质细胞(Leydig 细胞)合成分泌,高浓度的T 扩散进入精曲小管,保证精子的正常产生,若其分泌异常,可引发少弱精症[1]。环境雌激素(environmental estrogens,EEs)可通过多种途径抑制睾酮,而冷刺激亦可导致哺乳类动物内分泌水平的紊乱[2]。本研究在前期研究报道的基础上,采用芫荽实环境雌激素样复合饲料联合冷刺激进行干预建立少弱精症大鼠模型,探讨环境雌激素联合冷刺激对该大鼠模型血清性激素水平及睾丸形态学的影响。
1 材料和方法
1.1 实验动物
性成熟雄性SD 大鼠36 只,平均体重(220±10)g,由新疆医科大学实验动物中心提供。
1.2 主要仪器与试剂
冷凝机、DRS-09A 型超声波加湿器(杭州多乐信电器有限公司)、BS-1150 型电子天平(北京赛多科斯天平有限公司)、水合氯醛(索来宝公司,批号:No.327D021)、T、E放免试剂盒(北京北方生物技术有限公司)。
1.3 实验方法
1.3.1 实验分组与动物模型的建立
随机取12 只正常雄性大鼠为正常对照组(N 组),余24 只 为 造 模 组(M 组)。N 组 大 鼠 常 规 饲 养,温 度为(25±2)℃,湿度为(55±5)%。造模组通过芫荽实雌激素样复合饲料+ 冷刺激进行干预,饲养条件为:温度(10±2)℃、湿度(75±5)%,干预时间为每天9:00 至19:00。24 w 后,根据文献方法[2]筛选出少弱精症模型,设为M1组。
1.3.2 取材
建模24 w 后,7%水合氯醛(5 ml/kg)腹腔注射麻醉大鼠,腹主动脉采血,离心取上清。取双侧睾丸,一侧睾丸入4%多聚甲醛,固定1 w 后行常规石蜡包埋、切片备用,将体积小于1 mm3的组织,用4%戊二醛和1%锇酸双固定。
1.3.3 血清激素水平检测
按照大鼠T、E2放免试剂盒说明书进行检测。
1.3.4 睾丸组织形态学观察
将甲醛固定的睾丸组织进行常规脱水、石蜡包埋,切片厚4 μm,常规苏木精-伊红 ( hematoxylin-eosin,HE)染色,中性树胶封片后,光镜下观察。将戊二醛和锇酸双固定的睾丸组织丙酮梯度脱水,Epon 环氧树脂包埋切片,铅铀染色(由新疆医科大学电镜室制作),JEOLJEM1230透视电镜下观察。
1.4 统计学分析
采用SPSS22.0 进行统计分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素ANOVA 分析,两两比较采用LSD 法进行检验,计数资料以百分比(%)表示,组间率的比较采用卡方检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 血清激素水平检测结果
M1组较N 组T 水平显著降低,E2水平显著升高,差异有统计学意义(P<0.05)(表1)。
表1 血清T、E2 水平变化(±s)

表1 血清T、E2 水平变化(±s)
注:与N 组比较,*P<0.05
指标 N 组 M1 组T(ng/dL) 1.58±0.64 0.45±0.13*E2(uIU/ml) 31.67±5.63 71.34±6.24*
2.2 睾丸形态学观察结果
正常组结构完好,模型组可见生精小管明显变形,各级生精细胞数量明显减少,间质减少;超微结构显示,生精细胞数量减少且排列紊乱,可见有精原细胞、精母细胞核固缩,精子细胞界限模糊不清(图1)。
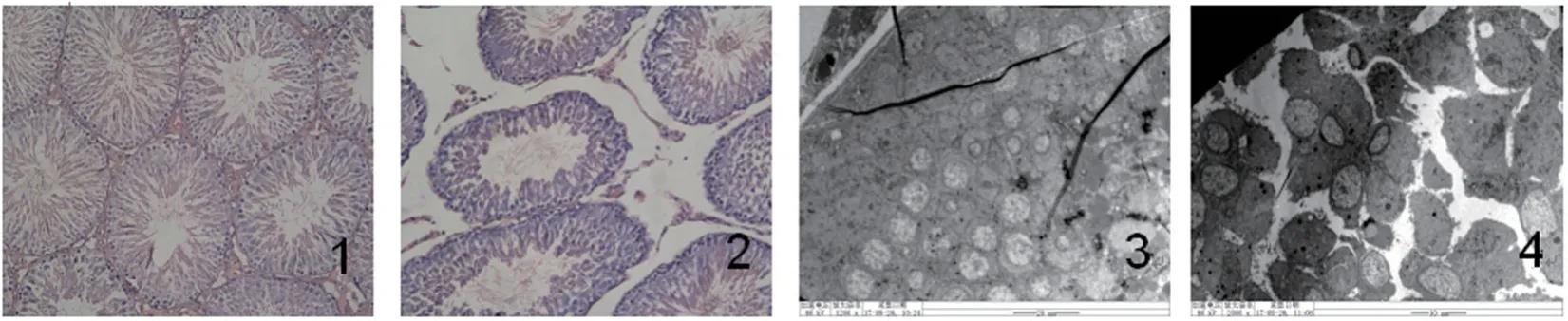
图1 各组大鼠睾丸光镜、电镜结果
3 讨论
睾酮合成途径非常复杂,由多种酶参与催化,且受到激素、温度、环境等多种因素调节。
精子生成于睾丸的曲细精管,曲细精管间的疏松结缔组织称为睾丸间质,睾丸间质中的间质细胞(Leydig cell),从青春期开始,受垂体前叶嗜碱性细胞分泌的间质细胞刺激素的作用,能合成分泌雄性激素,可促进精子的发生和男性生殖器官发育,以及维持男性正常的第二性征和性功能[3]。
有学者通过神经肽W 刺激睾丸Leydig 细胞,发现睾丸Leydig 细胞数量明显增加,T 的分泌也随之增加[4];另有学者J Li[5]等通过连续灌胃环磷酰胺建立大鼠少精子症模型,发现环磷酰胺组大鼠睾丸Leydig 细胞数量减少,精子数量、活率、活力及睾丸重量均显著降低,精子畸形率显著升高。而本实验通过环境雌激素联合慢性冷刺激所建立的少弱精症大鼠模型中, HE 染色及电镜结果均显示Leydig 细胞数量亦明显减少,和上述结果一致[6]。
综上所述,我们认为Leydig 细胞数量的减少是导致该模型睾酮水平下降的直接因素,故睾丸形态学结构的改变可能是少弱精症发生的组织病理学基础,但其具体机制仍需进一步研究[7,8]。

