植物中Remorin蛋白的研究进展
胡小倩 张颖翌 李鑫 闫海芳
(东北林业大学生命科学学院 东北盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
Remorin蛋白是一种与质膜/脂筏相连定位在膜微区的植物特异性寡聚丝状家族蛋白[1]。Remorin蛋白首次在番茄的叶片中发现,其大小约为34 kD,最初被命名为pp34[2],后因Remorin蛋白具有很强的亲水性和定位于质膜(Plasma membrane,PM)的特点,将其命名为Remorin(remora是一种依附在其他大型鱼类表面生存的鱼类)[3]。Remorin蛋白是一个多基因编码的多功能蛋白家族,在拟南芥、水稻、小麦和毛果杨中分别有16、19、20和8个Remorin基因[4]。拟南芥的16个Remorin基因都分布在拟南芥的第5染色体上,而小麦的Remorin基因则位于除第3染色体外的所有染色体中[4-5]。
1 Remorin蛋白的定位及表达
研究Remorin蛋白在番茄和马铃薯(Solanum tuberosum)中的组织定位发现,在叶、枝、茎、子叶、雄花、雌花和根中均存在Remorin蛋白,且在分裂能力较强的部位具有较强的Remorin蛋白信号。其中顶端分生组织、维管组织的韧皮部、叶原基和叶腋花芽处也具有显著表达[6-7]。Remorin基因的表达在叶子的分支、开裂、成熟和衰老的组织中显著增加,且在成熟的分枝胞间连丝部位的表达更突出[8]。说明Remorin蛋白广泛存在于植物各个组织器官,且在分裂能力较强的部位和较老的营养组织中更丰富。亚细胞定位研究发现,Remorin蛋白定位于质膜(PM),可能与运动蛋白(Movement proteins,MP)直接相互作用于质膜和胞间连丝周围[7-9]。
2 Remorin蛋白的结构特征
Remorin蛋白在结构上具有特异的C端和N端 结 构(Pfam domain Remorin-C:PF03763;Pfam domain Remorin-N:PF03766)[4]。Remorin-C端区域高度保守,相对比较稳定,有利于该蛋白锚定到质膜上,被认为是Remorin蛋白家族的标志性区域,可用来验证潜在的家族成员[1]。Remorins-N端区域序列变异性较高,导致该蛋白结构和功能存在较大差异[6]。Remorin蛋白C端具有保守的coiledcoild结构[3],是假定的膜锚定基序,具有疏水性。Remorin-C末端结构域的coiled-coild区域(残基117-152),可以调节Remorin蛋白寡聚化[10-12],还可能参与调节Remorin蛋白的空间结构[13]。此外,Remorin蛋白中还具有保守的富含脯氨酸的区域[3],但整个蛋白缺乏跨膜结构域,整体呈现亲水性[14]。Remorin蛋白C末端中的特定短序列介导Remorin蛋白与PM的结合,该短序列称为REM-CA(REMORIN C-terminal Anchor)[1,11]。REM-CA是 低 聚 反 应 的必要区域,直接参与其他蛋白的相互作用[12,15]。Remorin蛋白家族中约有65%的成员富含半胱氨酸,其中约一半的含有半胱氨酸的Remorin蛋白C末端四肽序列属于-CaaX的模式(“a”表示脂肪族氨基酸和“X”任意氨基酸),这是异戊二烯化的潜在位点,该修饰通常发生在植物Remorin蛋白中,与膜的相互作用有关[6,16]。
Remorin蛋白N端部分氨基酸序列组成和长度变化显著[6],从而决定了Remorin蛋白具有复杂的功能。N端无序区是指在正常生理条件下,不存在有序二级结构的蛋白质区域[15],其特征是交互作用域本身可能很小,但是交互作用表面区域却很大[17]。与有序蛋白区域相比,Remorin蛋白无序区域插入和删除率更高,且极易发生磷酸化修饰[18]。蛋白磷酸化是蛋白中最丰富的翻译后修饰,是真核细胞信号转导的关键调控步骤[19-20],它参与调控植物代谢、细胞周期、发育、激素信号和病原感知等多种生物过程[21-22]。植物需要有效的涉及多种酶反应的信号转导级联以适应不断变化的环境条件,从而影响信号转导[23-24]。Remorin蛋白可作为信号转导级联的新组分[25],参与植物先天免疫信号转导,是内在无序蛋白影响信号转导的突出例子[15]。
蛋白质不仅可以通过对信号蛋白整体进行修饰发挥其生物学功能,还可以通过对蛋白的无序区域进行修饰,使无序区域发生紊乱从而形成信号蛋白,发挥生物学功能[26]。植物中Remorin蛋白的N端无序区域可作为蛋白质之间相互作用的信号元件,以Remorin蛋白家族中的AtREM1.3和StREM1.3为例(图1),拟南芥中的AtREM1.3的C端可进行相对稳定的同型寡聚化,高度丰富的N端区域则促进了寡聚化,AtREM1.3蛋白中的无序的N末端区域介导蛋白质-蛋白质之间的相互作用。此外,AtREM1.3与4种同种型α蛋白家族的输入蛋白之间存在稳定的相互作用[11]。在马铃薯中,StREM1.3通过一个紧密的发夹结构和一个相应的REM-CA结构,实现Remorin蛋白与膜的结合[11]。C端的半胱氨酸残基有助于Remorin在PM上定位和翻译后的脂质修饰(包括:Ser-66的磷酸化,无序的N末端区域减少与α蛋白家族相互作用的强度降低)[27]。因此,PM上的Remorin-N末端区域可以构成一个监管区域,稳定其相互作用[26]。
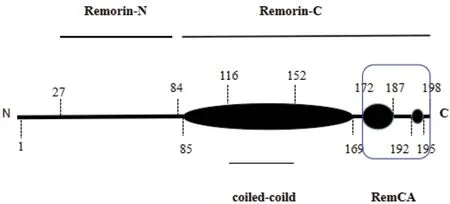
图1 StREM1.3中预测的二级结构和蛋白质结构域
3 Remorin蛋白的功能
Remorin蛋白可作为PM和膜微区结构域的标记蛋白[28],质膜微区由不同脂质、膜驻留蛋白和皮质细胞骨架之间的动态结构组成[29],PM是真核细胞的重要细胞器,主要依赖于膜蛋白发挥其功能[30]。Remorin蛋白在体外形成寡聚丝状结构,可能是植物细胞骨架和膜骨架的结构元件[6]。Remorin蛋白作为一个单独的在细胞内外起着运输及转导作用的蛋白,在内吞作用、抗病、细胞的能动性和极性[31]、能量转化、离子流和运输等方面发挥重要作用[32]。同时Remorin蛋白还参与植物生长、发育、信号转导、生物和非生物胁迫及植物免疫等过程[33]。
3.1 Remorin蛋白在果实发育和细胞成熟中的作用
在果实发育过程中,Remorin蛋白可能通过与受体激酶等信号蛋白直接作用从而促进细胞信号转导,参与调控作用,如Remorin蛋白参与菊苣(Cichorium intybus)中细胞去分化,导致菊苣体细胞胚胎形成(Somatic embryogenesis,SE)[34]。阿拉伯半乳聚糖蛋白AGP(DT212818)和REM(DT211027)均与细胞壁活性相关,编码细胞壁蛋白,细胞壁活性是细胞胚胎发育过程的基础。用β-D-葡萄糖基Yariv试剂(β-GlcY)处理菊苣,可固定周质空间中低聚半乳糖醛酸(Oligogalacturonic acids,OGA)和多聚半乳糖醛酸(Polygalacturonic acids,PGA),使菊苣中的REM下调,阻断了SE的诱导。SE诱导期间REM和AGP表达均上调,表明细胞壁重组可能在SE中发挥重要作用,AGP可能有助于果胶物质的转运或共价连接,REM参与OGA / PGA结合和信号传导[3,34]。
LONG PANICLE1(LP1)基 因 座 编 码 含 有Remorin-C末端的未知功能的Remorin蛋白,单核苷酸多态性(Single nucleotide polymorphism,SNP)会导致氨基酸的改变从而影响LP1功能,SNP1导致水稻短穗功能性突变,影响植物生长发育[36]。对103个水稻品种中LP1进行测序分析,发现在LP1的第3和第5个外显子中的2个SNPs突变可导致Remorin蛋白氨基酸序列的改变,其穗长(PL)也出现明显的差异,表明SNPs与穗长有关[35]。LP1编码的Remorin蛋白在多种同源物种的发育过程中均发挥作用,在今后的育种工作中,Remorin蛋白可用于改善水稻的穗长[36]。
Remorin蛋 白 是S-酰 基 化 蛋 白 之 一[37],Remorin蛋白的酰基化反应多由驻留蛋白酰基转移酶(PATs)催化发生[38]。半胱氨酸残基的S-酰基化(前称棕榈酰化)可发生在整个Remorin蛋白中,S-酰基化不仅有助于蛋白质与膜的相互作用,还有助于调节蛋白质与蛋白质之间的相互作用[39]。S-酰基化与其他脂质修饰不同,S-酰基化是可逆的,这一特性决定了蛋白质复合物存在动态调节机制。S-酰基化有助于驻留蛋白的膜微区定位,对于SYMREM1(SYMBI-OTIC Remorin1)靶向PM必不可少[39]。水稻GSD1(Grain setting defect1)编码一个Remorin蛋白,GSD1特异性定位于植物韧皮部伴生细胞的质膜(PM)和胞间连丝(Plasmodesmata,PD)[40]。GSD1编码的Remorin蛋白由S-酰化介导附着在PM上,过表达GSD1,导致Remorin蛋白增多,叶片中碳水化合物积累,可溶性糖含量降低,水稻粒度减少[41]。
根瘤菌和大豆共生固氮是大豆中氮的主要来源,只有在大豆和根瘤菌的共生体得到良好生长发育情况下,才能满足大豆对氮的需求[42]。大豆中的SYMREM表达量增加,受体激酶DMI2(DOES NOT MAKE INFECTIONS 2)会引发钙刺激反应(Calcium-spiking response),从而解码激酶DMI3,激活特定的转录因子[43],在结节形成过程中表达上调,导致细菌从细胞中释放出来[44],可通过特异性敲除SYMREM或者DMI2阻止细菌的释放[45-46]。SYMREM1蛋白和大豆的植物特定蛋白家族GmFWL1(FW2-2-like1)相互作用于膜微区,可作为豆科植物结瘤的调节剂。在大豆中,GmFWL1在根毛细胞中特异性地表达,沉默GmFWL1,可减少SYMREM1与GmFWL1的相互作用,从而促进大豆结瘤[12,47],从而获得高产大豆(图2)。
Remorin蛋白与细胞分裂和细胞成熟相关,在杂交杨树(P.davidianaDode×P.bolleanaLauche)中,PdREM特异性表达于美洲黑杨(P.deltoides)的叶芽和韧皮部,PdREM过表达延缓了杨树的生长,PdREM可能对植物发育会产生负调控作用,杨树高度、茎、叶片数量、木质部和韧皮部区域的大小随着PdREM的下调而增加,同时该基因影响细胞壁和微纤维角的生物合成相关基因的表达[48]。此外,反义PdREM转基因杨树具有较少的微纤维角,表明PdREM可能有助于提高杨树的板材强度和优化木材质量,为今后研究木材形成和木材质量的改善奠定了功能基因组学基础[48]。
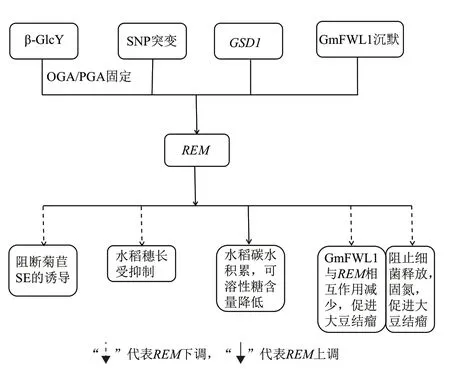
图2 REM参与调控植物生长发育
3.2 Remorin蛋白与植物激素间的相互作用
用不同的植物激素处理完全扩展的成熟桑叶,研究Remorin(MiREM)在不同的激素处理后的表达。未经处理的叶片中,MiREM仅有本底水平的表达,吲哚-3-乙酸(Indole-3-acetic acid,IAA)处理后MiREM少量表达,油菜素类固醇(Brassinosteroids,BRs)处理后MiREM表达明显增加,水杨酸处理后MiREM则大量表达。MiREM在这些植物激素处理后表达增加,意味着Remorin可能有助于植物在不利的环境下生长[7]。
通过诱导与番茄果实成熟相关的关键基因REMORIN1(SlREM1)的表达,可以促进乙烯和番茄红素的生物合成,SlREM1可与乙烯生物合成蛋白(SlSAM1)相互作用以调节乙烯的合成,最终被泛素介导的蛋白水解酶降解[48]。1-氨基环丙烷-1-羧酸合酶(ACS)和1-氨基环丙烷-1-羧酸氧化酶(ACO)也是乙烯生物合成调节的关键酶[49],SlREM1与ACO1和ACS2相互作用于质膜,参与乙烯的生物合成[4]。SlREM1在番茄中过表达刺激果实成熟,过表达植株的乙烯产量与野生型相比明显增加,番茄红素的积累也明显高于野生型。SlREM1通过影响乙烯和番茄红素的生物合成,正向调节果实成熟,并影响番茄果实对真菌病原体的抵抗力[30,48]。
脱落酸(Abscisic acid,ABA)诱导的Remorin蛋白直接与关键的BRs信号相互作用,以减弱BRs响应,从而表明BRs与ABA具有拮抗作用。水稻中的OsREM4.1蛋白定位于质膜,与OsBRI1-OsSERK1(BRASSINOSTE ROID INSENSITIVE 1;SOMATIC EMBRYOGENESIS RECEPTOR KINASE)复 合 物形成有关。随着ABA的增加,ABA响应转录因子OsbZIP23被激活,OsREM4.1表达增加,OsREM4.1蛋白与OsSERK1相互作用并干扰OsBRI1-OsSERK1复合物的形成,抑制BRs信号转导;随着BR的增加,BR与OsBRI1的细胞外结构域结合,从而激活细胞外OsBRI1结构域激酶用于磷酸化OsREM4.1,磷酸化的OsREM4.1对OsSERK1具有较低的结合亲和力,导致OsREM4.1与OsSERK1解离[50]。因此,OsSERK1能够与OsBRI1相互作用形成OsBRI1-OsSERK1受体激酶复合物,然后激活BR信号级联反应[31]。从而影响植物细胞伸长与细胞分裂、微管分化、生殖生长及开花、形态建成等,增强植物对生物与非生物胁迫的耐受性、增加作物产量[50-51](图3)。
3.3 Remorin蛋白参与植物对环境压力的应激反应
植物生长的自然环境由一系列的生物胁迫和非生物胁迫共同组成。生物胁迫是由其他生物所施加的,如虫害和病菌。非生物胁迫主要包括:干旱、洪涝、盐碱、矿物质缺乏及不利的pH等,植物对这些胁迫的反应很复杂。
对桑叶进行胁迫处理,盐或渗透胁迫诱导MiREM基因的表达。在干旱敏感品种中,MiREM的表达水平相对耐旱品种基因表达量高,耐盐栽培品种中MiREM转录水平较低。MiREM响应盐和水胁迫而受到差异调节,并且可能参与应激信号以适应胁迫[7]。将野生型和转基因桑树成熟叶片进行干旱处理,过量表达MiREM的转基因植物叶片比相应的野生型植物叶片萎蔫程度更轻,表明增加MiREM的表达可以提高相关转基因植物的耐旱性[7]。

图3 REM参与植物激素间的相互调节
谷子(Setaria italica)中有11个Remorin家族基因,其中SiREM6(SiARDP的靶基因)在高盐、低温和脱落酸处理后表达均增加,但不受干旱胁迫的影响。过表达SiREM6提高了拟南芥在萌发和幼苗期的高盐耐受性。SiREM6启动子含有两个脱水反应元件(Dehydration-responsive element,DRE)和一个ABA反应元件(ABRE)。SiARDP(DRE结合转录因子)特异性结合SiREM6启动子中的2个DRE元件,表明SiREM6在高盐胁迫耐受性中起关键作用[52]。
南极毛草(Deschampsia antarctica)中的DaCBF7(D. antarctica C-repeat binding factor 7)主要定位于细胞核,并与胞嘧啶重复/脱水反应元件(CRT/DRE)核心序列(ACCGAC)相互作用。在水稻中,过表达DaCBF7,REMORIN的表达上调,转基因水稻对冷胁迫的耐受性显著提高,REMORIN启动子含有CRT/DRE或低温响应元件,增强水稻对冷胁迫的耐受性[5]。同样在低温处理的小麦中,TaREM基因中 的TaREM4.1、TaREM 4.2和TaREM 4.3表 达 量增加,提高了小麦对低温的耐受性[53],且Remorin蛋白在小麦和水稻中具有相似的冷胁迫应答机制[5,53]。芒果(Mangifera indica)果实中含有芸苔素内酯(brassinolide,BL),对5℃的冷胁迫具有较高的耐受性。BL处理后,Remorin蛋白、脱落酸应激成熟蛋白、II型SK2脱水蛋白和温度诱导的脂质转运蛋白表达量均上调。而且经过BL处理后的PM脂质表现出较低的相变温度和较高的温度不饱和度,温度低时流动性降低。在芒果果实PM中的Remorin蛋白和脂质参与BL介导的对冷胁迫应激反应,所以Remorin在调节果实对冷胁迫的防御中起重要作用[54]。
3.4 Remorin蛋白提高植物的抗病性
定 量 抗 病 性(Quantitative disease resistance,QDR)对作物栽培品种的发展具有重要意义。北方 叶 枯 病(Northern leaf blight,NLB)由 真 菌Setosphaeria turcica引起,斯图尔特枯萎病由细菌Pantoea引起,普通的锈病由真菌Puccinia sorghi引起。在玉米中,上述3种病原菌感染的叶病的基因座(QTL)重叠区域,存在4个基因表达和突变:一个与F-box基因同源的基因、一个Remorin基因(ZmREM6.3)、一个破伤风蛋白基因和一个未知功能的基因,其中F-box同源基因和ZmREM6.3与叶病的相关性较高。对F-box同源基因、破伤风蛋白基因和ZmREM6.3的突变体分别进行测试,发现了NLB更容易受到REMORIN突变的影响,表明ZmREM6.3在植物抗病性中至关重要[54]。不同的Remorin蛋白在控制病毒易感性方面可能具有不同的作用,这与病毒种类有关[55]。
Remorin蛋白是植物特异性膜相关蛋白,在植物-病原体的相互作用中也起到至关重要的作用。烟草NbREM1受S-酰化修饰的调节,NbREM1主要通过调节自噬途径发生降解,RSV可以通过限制病毒在细胞间的转运干扰甚至中断NbREM1的S-酰化,影响其靶向质膜微区,并由此产生非靶向NbREM1的积累从而受到自噬降解,导致NbREM1下调[56]。RSV编码的运动蛋白NSvc4也可以干扰OsREM1.4的S-酰化,OsREM1.4与NbREM1同源,形成Remorin介导的RSV防御水稻,Remorin蛋白水平下调,S-酰化是常见的用于抑制RSV的感染的方法[57]。
马铃薯病毒(Potato virusX,PVX)是十大最重要的植物病毒之一[58],Remorin家族基因中的StREM1.3位于PM微区,对PVX增殖有拮抗作用[14]。PVX的三联基因阻断蛋白(Triple Gene Block 1 protein,TGBp1)是抑制RNA沉默防御的病毒成分[59],TGBp1是目前发现的第一个RNA沉默病毒抑制剂(VSR)[9]。TGBp1能够从一个细胞运到另一个细胞,通过靶向PD对孔径进行调节,表现较强的沉默抑制作用[14]。植物PVX感应诱导膜结合的钙依赖性蛋白激酶的激活,从而使REM1.3磷酸化,特异性激活两种PVX蛋白,即CP和TGBp1[60]。REM在TGBp1限制PD渗透率的能力方面发挥了作用,并可直接与病毒运动蛋白TGBp1结合,损害TGBp1和烟草花叶病毒(Tobacco Mosaic Virus,TMV)MP,增加胞间连丝通透性的能力[55],TGBp1在REM存在的情况下打开PD的能力受到了抑制,干扰了马铃薯病毒X(PVX)细胞间的运动[9]。
4 展望
近年来,Remorin蛋白与质膜微区相连,参与许多重要的细胞生理活动,具有十分广泛的生理功能。Remorin蛋白参与了植物细胞去分化、体细胞胚胎形成、作物成熟、产量、木材质量以及抗逆和激素应答等信号转导过程。然而在这些信号转导中Remorin蛋白的作用机制、信号途径和调控机理等科学问题仍不清楚,需大量的研究去探索。随着生物技术的不断发展,更多Remorin蛋白将会被研究,同时运用分子生物学技术、功能基因组学、遗传、生化等方法进一步证实新Remorin蛋白功能,将为理解Remorin蛋白参与植物发育和抗逆胁迫的作用机制提供新思路,有利于培育具有高产、优质和高抗逆性状的优良作物,为育种研究提供新思路、开拓新前景。

