急性大面积脑梗死脑电图δ/α功率比值与中线结构移位的相关性研究
张哲,刘大成,刘婧伊,田佳,2,濮月华,刘丽萍
急性大面积脑梗死是由一侧颈内动脉或大脑中动脉闭塞引起,梗死体积占大脑中动脉流域的2/3或以上的神经危重疾病。大面积脑梗死后梗死区可能形成占位效应的脑水肿,引起中线结构移位、患者意识水平下降,最终导致脑疝甚至死亡[1]。在发病早期密切监测患者意识水平和神经体征变化,通过神经影像学手段观察中线结构移位,是该病诊治的关键。
定量脑电图(quantitative electroencephalography,qEEG)是通过计算脑电图(electroencephalography,EEG)的频带功率及其衍生参数,可用于评估神经危重症患者的意识水平。Claassen等[2]发现,EEG后头部α功率反映更清楚的意识水平。在多种qEEG参数中,δ/α功率比值(δ/α power ratio,DAR)最为常用[3-7]。对于大面积脑梗死患者,qEEG能否用于反映引起意识水平改变的大脑中线结构移位,是否比常规临床量表更敏感,尚缺少研究。本研究目的为评估急性大面积脑梗死DAR和中线结构移位之间的相关性,并探索反映中线结构移位变化的最敏感的DAR变化区域。
1 研究对象和方法
1.1 研究对象 本研究为回顾性研究,选择2017年9月-2019年5月在首都医科大学附属北京天坛医院神经重症监护病房接受治疗、完成常规或长程EEG监测的大面积脑梗死患者。入组标准:①年龄≥18岁;②头颅CT或MRI显示脑梗死体积累及大脑中动脉流域2/3或以上;③EEG在发病后7 d内完成,EEG检查前后4 h内有头颅CT或MRI检查及NIHSS评分和GCS评分的临床记录。排除标准:①大面积梗死病灶对侧大脑半球有新发或陈旧梗死病灶;②脑死亡;③在EEG开始前或结束后4 h内,未完善头颅CT或MRI检查;④使用镇静或抗癫痫药物;⑤已接受去骨瓣手术;⑥既往癫痫病史。本研究由首都医科大学附属北京天坛医院伦理委员会批准(伦理审查编号:KYSQ 2020-100-01)。
1.2 临床资料收集与中线结构移位测量 回顾性收集入组患者的人口学资料及临床、影像信息,包括性别、年龄、发病时间、主要治疗方式、CT或MRI所示梗死侧别、CTA或MRA所示血管闭塞部位、高血压、糖尿病、脂代谢紊乱、心房颤动病史,吸烟史,以及EEG记录期间NIHSS评分和GCS评分。
根据Pullicino等[8]的方法,1名独立于EEG分析的神经内科医师测量中线结构的水平移位。选取基底节-内囊水平的非对比增强CT或MRI 的T1WI序列轴位图像,沿冠状方向绘制1条通过透明隔、两端止于颅骨内板的直线,透明隔将此直线分为2段,中线结构移位=2段直线长度(mm)差值/2。对于接受常规EEG监测的患者,选择EEG监测4 h内的CT或MRI测量;对于接受长程EEG监测的患者,将EEG开始前4 h内和结束后4 h内的CT或MRI资料一并纳入分析。
1.3 定量脑电图数据获取和分析 使用美国Nicolet脑电监测系统(美国Natus医学公司)完成常规(时长<8 h,通常1 h)或长程EEG监测(时长≥8 h)。按照国际10/20系统安放Ag/AgCl电极。采集参数设置为采样率250 Hz,高通滤波0.5 Hz、低通滤波70 Hz、陷波滤波50 Hz。在EEG记录期间,患者会被医护人员间断刺激(至少1次/时),给予的刺激包括听觉和(或)伤害性刺激、神经科查体、被动活动、喂食、吸痰操作等。在EEG监测同时,记录NIHSS评分和GCS评分。通过EEG原始图像和同期视频记录识别并剔除EEG伪差。选择距CT或MRI扫描最近、无伪差、长度为30 min的一段EEG做定量分析;常规EEG只选取一段EEG纳入分析,长程EEG在前后半程分别选取一段EEG纳入分析。
使用快速傅里叶变换,分别计算δ频带(0.5~4 Hz)、α频带(8~13 Hz)功率,根据DAR=δ频带功率/α频带功率,计算DAR。首先将各导取平均导联,分别计算梗死侧与健侧半球的DAR平均值。再取双极纵联(double banana),以F3/4-C3/4、T3/4-P3/4和P3/4-O1/2导联分别代表前、中、后头部区域,计算各自的DAR。
1.4 分组和比较 根据中线结构移位≥5 mm和<5 mm,≥10 mm和<10 mm分组,比较组间不同EEG区域和半球的DAR,以及NIHSS评分、GCS评分是否存在组间差异。
1.5 统计学方法 使用StataMP 16软件(美国Stata公司)完成。计量资料符合正态分布,用表示,使用Spearman秩相关系数评价各变量与中线结构移位的相关性,使用Wilcoxon秩和检验统计各变量的组间差异。选择在中线结构移位≥5 mm、≥10 mm时差异均有统计学意义的qEEG变量,与NIHSS评分、GCS评分一起进行ROC曲线分析,计算判断中线结构移位≥5 mm、≥10 mm的界值及其敏感度、特异度。由于共有10项变量纳入分析,需应用Bonferroni校正以降低Ⅱ类错误,以P<0.005为差异有统计学意义。
2 结果
2.1 一般资料 研究共纳入29例患者,其中9例患者进行了长程EEG检测,20例患者进行了常规EEG检测,共计38段EEG及其对应的头颅影像、NIHSS评分和GCS评分纳入分析,头颅影像所示中线结构移位距离0~20 mm,平均6.34±5.16 mm。入组患者年龄范围43~86岁,男性∶女性为20∶9。患者的人口学、临床和影像信息见表1。
2.2 脑电图特点 EEG监测平均在卒中发病后2.55±1.69 d启动,检测时长1~36 h,平均监测时长10.36±9.92 h。EEG监测与神经影像扫描间隔20 min至4 h,平均间隔2.44±1.13 h。所有EEG均未见非惊厥性癫痫发作图形,2例(6.90%)患者观察到偏侧性节律性δ活动。对于中线移位>5 mm的患者,可观察到健侧慢波活动增加(图1)。

表1 患者基本信息和临床资料
2.3 相关性分析和分组比较 梗死侧半球DAR、梗死侧前头部DAR、健侧半球DAR、健侧前头部DAR、健侧中间部DAR、健侧后头部DAR与中线结构位移均呈正相关,GCS评分与中线结构位移呈负相关(表2)。
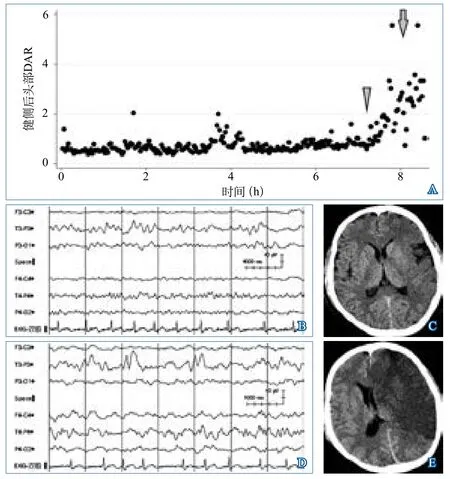
图1 大面积脑梗死qEEG与中线结构移位关系的典型病例
根据中线结构移位是否≥5 mm将数据分为2组,仅健侧后头部DAR的差异有统计学意义(6.48±5.70vs2.09±1.47,P=0.0043)。根据中线移位是否≥10mm的分组差异比较中,健侧半球、前、中、后头部DAR以及患侧半球、前头部DAR、GCS评分差异均有统计学意义(表3)。
2.4 ROC曲线分析 由于仅健侧后头部DAR同时在中线结构移位是否≥5 mm和≥10 mm分组比较中差异有统计学意义,所以将健侧后头部DAR和NIHSS评分、GCS评分进行ROC曲线分析,绘制ROC曲线(图2)。健侧后头部DAR界值分别取≥2.326、≥2.569时,判断中线结构移位≥5 mm、≥10 mm的曲线下面积(area under the curve,AUC)分别为0.7699和0.8848,均高于NIHSS评分和GCS评分(表4)。
3 讨论
本研究通过不同部位的EEG定量参数、常用的临床功能量表(NIHSS、GCS)评分与大面积脑梗死中线结构移位的相关性分析、组间比较和ROC分析,明确仅有健侧后头部DAR是反映中线结构移位的良好指标。研究结果表明,qEEG参数比临床评估更加敏感,适用于辅助大面积脑梗死的临床决策。
在本研究中,健侧后头部DAR在中线结构移位≥5 mm组和≥10 mm组中均显著升高,健侧半球、前、中、后头部以及患侧半球、前头部DAR仅在移位≥10 mm组中显著升高。说明随中线结构移位加重,脑电慢活动的范围逐渐扩展,但只有健侧后头部DAR能够在中线结构移位早期出现变化,此时GCS评分、NIHSS评分均尚未出现差别。通过ROC分析,进一步证实健侧后头部DAR是提示中线结构移位最敏感的指标。DAR能反映脑中线结构移位的可能的机制为:后头部α节律作为背景节律,本身可以随着意识水平下降,逐渐演变为慢波活动[2];随着脑组织受压、脑血流量下降,正常的神经元代谢受到阻碍,依次出现β频带活动消失、背景频率减慢至θ~δ频带,最终可演变为电静息[9];梗死侧由于大脑组织严重受损,EEG表现为慢波活动甚至电压衰减,无法反映中线结构移位、意识水平下降、神经元代谢异常等变化,而健侧后头部脑电节律的演变反映了这一变化趋势。同时,本研究还发现健侧后头部DAR提示中线结构移位的敏感度高于常用的GCS评分和NIHSS评分。这得益于EEG具有可连续监测、时间分辨率高的特点,能够及时发现神经电活动的异常,从而反映脑组织的病理生理变化。在临床实践中,临床评估不可能连续、密集进行,客观上存在病情恶化发现可能不及时的问题,因此对幕上大面积脑梗死的患者进行EEG监测,有助于及时发现病情变化。
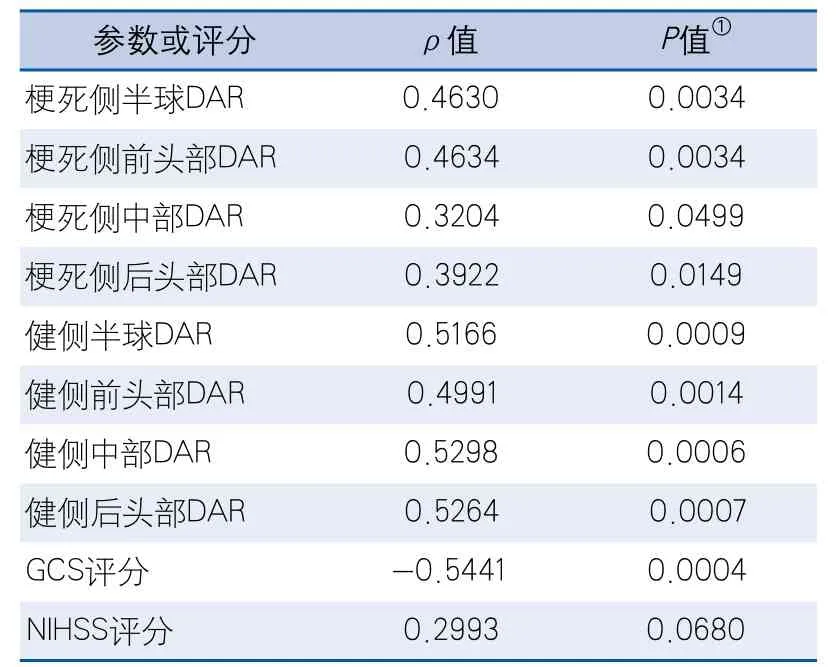
表2 不同部位DAR和临床评分与中线结构移位的相关性
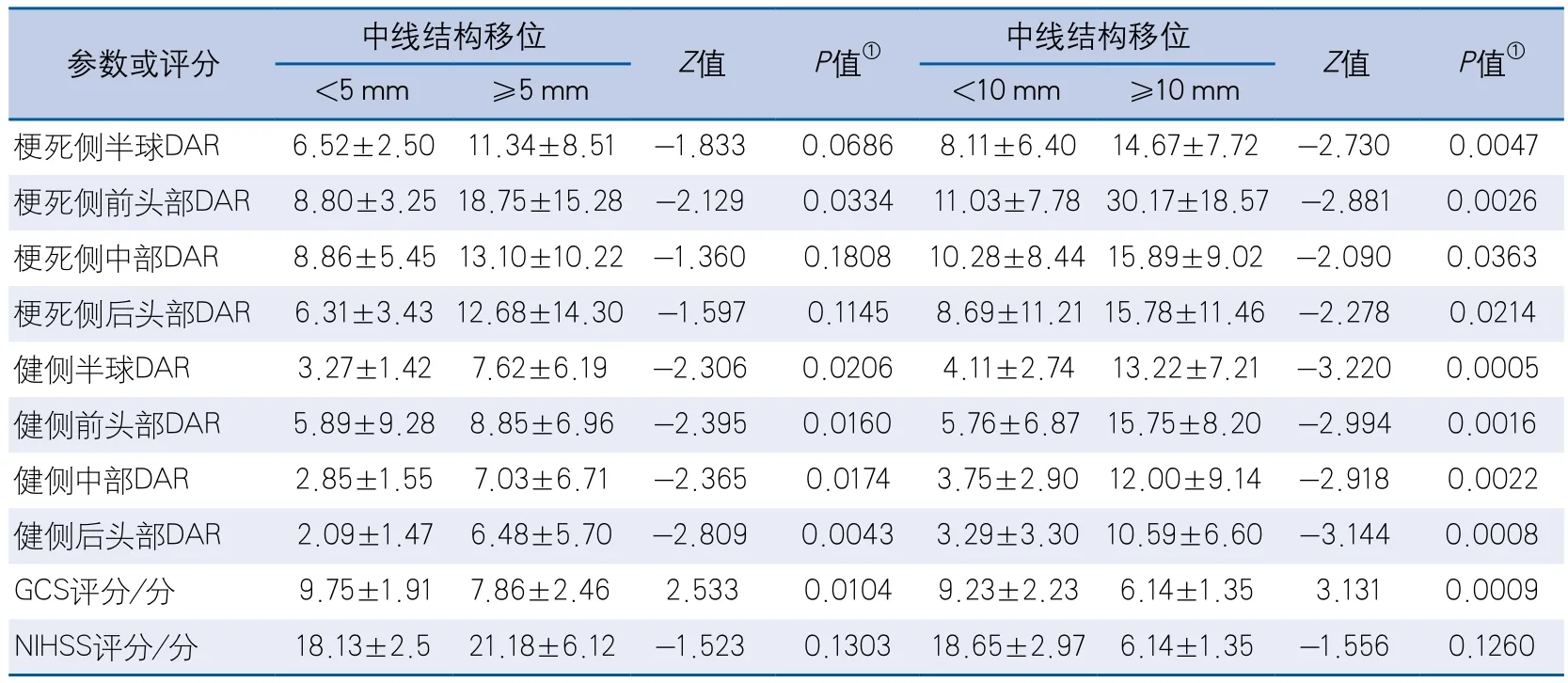
表3 不同部位DAR和临床评分的分组差异比较

表4 健侧后头部DAR和临床评分预测中线结构移位的ROC曲线分析
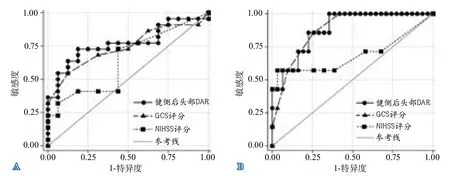
图2 健侧后头部DAR和临床评分判断中线结构移位的ROC曲线
大面积脑梗死是一类具有高致死率的神经危重疾病,也称恶性大脑中动脉梗死,经常发生高颅压甚至脑疝,去骨瓣减压手术可以降低病死率,但是手术时机存在争议。美国神经重症学会推荐在发病后24~48 h、脑疝发生前进行[10]。Akins等[11]的研究表明,通过密切的神经功能检查和神经影像学评估,可以减少60%的去骨瓣手术,而不增加死亡率。徐锋等[12]推荐的手术指征为中线结构位移≥5 mm。在临床实践中,EEG具有可在床旁连续监测的优势。根据本研究的结果,临床医师可重点关注大面积脑梗死患者健侧后头部DAR的演变趋势,判断中线结构变化,决定去骨瓣减压术的时机。
本研究关注EEG定量参数与大面积脑梗死中线结构移位之间的相关性,在国内外其他研究中较少出现。国内外既往研究主要通过EEG视觉判读,利用EEG的不同频带的分布特征,在大面积脑梗死发病早期预测恶性病程。Burghaus等[13]分析25例大面积脑梗死患者的EEG,发现病灶区域δ活动消失,出现θ和快β活动提示良好预后,梗死侧半球出现全面性慢波活动提示恶性病程。杨庆林等[14]的研究表明,EEG发现无δ波的区域性衰减可在病程早期特异性地提示大面积脑梗死,并且与脑疝等不良预后相关。Shreve等[15]使用256导高密度电极阵列EEG,发现在发病数小时内,梗死体积与两侧大脑半球的α/δ功率比值显著负相关,作者据此认为EEG有助于在发病早期识别大面积脑梗死。Jiang等[16]通过前瞻性纳入50例大面积脑梗死患者,发现健侧θ功率能够预测出院时和6个月死亡,值得注意的是,该研究同样证实qEEG参数较GCS评分的预测准确性更高。
本研究为回顾性横断面研究,存在一些难以避免的缺陷:①入排标准较为严格,最终纳入分析的病例数量偏少,减弱了统计效力;②神经影像扫描距EEG检查存在时间间隔,在此期间,EEG理论上仍可能发生变化;③多数患者仅完成常规EEG检查,因此无法研究同一患者EEG随中线结构移位增加的变化趋势;④考虑到过多的变量数影响统计效力,仅选择qEEG分析最为常用的DAR,未研究除DAR以外的参数。
综上所述,健侧后头部DAR与大面积脑梗死中线结构移位相关。在估测中线结构移位方面,健侧后头部DAR比GCS评分、NIHSS评分更加敏感。临床医师可利用EEG监测大面积脑梗死患者的神经功能,并且应重点关注健侧后头部脑电的演变,以辅助临床决策。未来应建立前瞻性队列,通过长程EEG监测,探索大面积脑梗死的EEG变化趋势与中线结构移位之间的关系。
【点睛】通过对急性大面积脑梗死患者EEG的回顾性分析发现健侧后头部qEEG指标DAR可以反映患者中线结构移位,该指标优于NIHSS评分和GCS评分。
——书写要点(三)

