Ala-Gln双肽肠外营养对胃肠道肿瘤化疗患者相关免疫学及负氮平衡的影响研究
王晓兰,杨 勇,蒲汪洋, 潘 杰
苏州大学附属第二医院 1.药剂科;2.检验科;3.肿瘤科,江苏 苏州 215000
肠外营养是临床常用营养方案之一,其营养要素有热量、维生素、微量元素、电解质及必需或非必需的氨基酸等[1]。丙氨酰-谷氨酰胺(Alanyl-Glutamine,Ala-Gln)是非必要氨基酸的一种,本品是临床常用的肠外营养制剂,多用于有谷氨酰胺需求的患者[2]。Ala-Gln可为肠黏膜上皮提供能源,肠外营养剂内加入Ala-Gln可有效降低化疗药物对肠道黏膜的损伤。Ala-Gln作为功能性物质,其还与肠道免疫功能密切相关,肠内营养在缺乏Ala-Gln的情况下,局部淋巴小结内的T、B细胞表达水平将下降,并因此引发肠道黏膜萎缩[3-4]。为观察Ala-Gln双肽肠外营养在胃肠道肿瘤化疗患者中的应用效果,及对患者免疫学指标和负氮平衡的影响,本文选取120例需进行肠外营养的胃肠道肿瘤患者进行了如下研究。
1 资料与方法
1.1 一般资料选取2013年5月至2016年5月在我院接受化疗且进行肠外营养的胃肠道肿瘤患者为研究对象。纳入标准:(1)年龄≥18周岁;(2)病理诊断确诊为胃肠道肿瘤者;(3)无其他严重基础疾病者;排除标准:(1)临床资料不全者;(2)合并其他消化系统疾病者;(3)合并慢性消耗性疾病者。根据标准共纳入病例数120例,其中常规肠外营养组(对照组)60例,男35例,女25例,年龄(69.34±4.08)岁(52~84岁);Ala-Gln双肽肠外营养组(观察组)60例,男30例,女30例,年龄(70.01±5.11岁)(55~80岁)。两组患者年龄、性别等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会评审通过,且患者均知情同意。
1.2 研究方法两组患者均行5-FU+CF化疗方案,并于化疗1~7 d后给予患者肠外营养,营养制剂内容为:热卡90.0 kJ/kg(60%碳水化合物+40%脂肪),氮量0.2 g/kg,电解质根据患者具体需求而定,1次/d[5]。观察组在此基础上加入0.5 g/kg Ala-Gln双肽(西安万隆制药有限公司,国药准字H20045975)。
1.3 评价指标选用生化分析仪(罗氏,Cobas 8000 c702)观察两组患者治疗前后营养指标(PALB、TRF、ALB)表达水平。同时于肠外营养治疗前后抽取患者肘静脉血3 ml,选用中佳(KDC-044)离心机进行,离心率为3 500 r/min,离心半径=8 cm,离心时间15 min,收集上清选用免疫散射比浊法检测患者免疫功能(IgG、IgA、IgM)表达水平,试剂盒由中山标佳生物科技有限公司提供。同时收集肠外营养治疗前后患者24 h尿液,选用生化分析仪检测患者尿素氮水平,并计算负氮平衡。负氮平衡=摄入氮量(g/d)-[24 h尿素氮(g/d)+3]。

2 结果
2.1 两组患者治疗前后营养指标的比较两组患者治疗前营养指标比较,差异无统计学意义(P>0.05),治疗7 d后,观察组患者的PALB、TRF、ALB水平高于对照组患者(t=-11.043、-18.636、-7.331,P<0.001,见表1)。

表1 两组患者治疗前后营养指标的比较
2.2 两组患者治疗前后免疫指标水平的比较两组患者治疗前免疫指标比较,差异无统计学意义(P>0.05);治疗7 d后,观察组患者的IgG、IgA、IgM水平高于对照组患者(t=-6.966、-6.886、-4.155,P<0.001,见表2)。
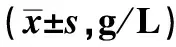
表2 两组患者治疗前后炎症因子水平的比较
2.3 两组患者治疗前后负氮平衡指标的比较两组患者治疗前负氮水平比较,差异无统计学意义(P>0.05);治疗7 d后,观察组患者的负氮水平低于对照组患者(t=16.407,P<0.001,见表3)。
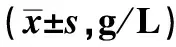
表3 两组患者治疗前后负氮平衡指标的比较
3 讨论
早期研究认为,肿瘤患者增加营养将增强患者癌细胞生长、扩散能力,但如患者营养不足则可能导致患者营养不良,并损伤患者机体素质及免疫功能,诱使患者术后恢复缓慢,这使得肿瘤患者的营养治疗处于两难境地[6]。但近些年的研究发现,对于肿瘤患者,如不给予营养治疗,患者最先出现损伤的往往是健康的细胞、组织及器官[7]。同时有效的营养治疗还将增强肿瘤患者机体素质,提高其免疫功能,这对加速患者术后恢复,增强机体免疫对癌细胞的杀伤具有重要意义。
胃肠道肿瘤患者生理表现有全身葡萄糖更新速度提高;细胞因子生成率上升;肌肉蛋白合成量下降,但全身、肝脏蛋白合成量升高;出现负氮平衡现象等[8]。针对性干预治疗后,胃肠道肿瘤患者机体素质及代谢能力将增强,其葡萄糖利用率下降并大幅分解机体蛋白质,以降低机体消耗,患者蛋白质生成率低于分解率;同时如外源蛋白质供应不足,患者肌肉、血浆及其他组织内的蛋白质基质将被分解,用以提供肝脏生成急性相关蛋白,并因此增加患者尿氮排出量[9]。大量的肌肉及其他组织蛋白丢失将导致患者机体营养不良,并加剧负氮平衡状态[10]。Gln是人体内含量最高的氨基酸,对人体生理代谢维持具有重要作用[11]。Gln还是天冬酰胺、赖氨酸等的前提物质,同时也是蛋白质及谷胱甘肽合成的关键介质。此外,Gln还是尿素生成、运输及排泄的重要参与因子[12]。健康状态下,人体Gln表达稳定,并无Gln缺乏现象,但当人体出现创伤、感染、荷瘤等症状后,大量的Gln将被消耗,Gln合成/消耗平衡将被打破,患者将出现Gln缺乏现象并引发一系列病理生理改变[13]。本研究在胃肠道肿瘤患者化疗后进行Ala-Gln双肽肠外营养干预后,观察组患者的PALB、TRF、ALB水平高于对照组患者,并且患者的负氮水平低于对照组患者,表明Ala-Gln双肽肠外营养在改善肠胃肠道肿瘤患者化疗后营养状态,改善负氮平衡上具有显著价值。
补体及抗体是人体内对肿瘤起到杀伤能力的主要免疫因子,其机制可能为:(1)补体及抗体均可有效地调节细胞黏附能力,增强巨噬细胞的吞噬功能[14];(2)抗体与肿瘤细胞结合后,补体可通过经典途径激活,并促使肿瘤细胞溶解;(3)抗体可对肿瘤细胞膜表层结构进行调整,并以此改变肿瘤细胞的黏附能力,抑制其分化、转移[15]。而IgG、IgA、IgM是血清抗体的重要因子,对胃肠道肿瘤癌细胞杀伤具有重要作用。本组研究中,治疗7 d后,观察组患者的IgG、IgA、IgM水平高于对照组患者,表明Ala-Gln双肽肠外营养在增强肠胃道肿瘤患者免疫功能上具有显著价值,优于常规肠外营养方案。其原因可能与Gln是T淋巴细胞的重要能源物质有关。
本研究通过对比试验发现,Ala-Gln双肽肠外营养可有效补充胃肠道肿瘤化疗患者的Gln,并改善患者营养状态及负氮平衡,增强患者免疫功能。但由于本研究基础条件有限,研究所纳入的样本数量较小,取样地域也较狭窄,研究还存在一定不足。
综上所述,Ala-Gln双肽肠外营养是一种高效的胃肠道肿瘤肠外营养方案,其在改善胃肠道肿瘤化疗患者营养状况和负氮平衡,增强患者免疫功能上具有显著价值,值得临床推广应用。

