九香虫溶菌酶CcLys2的基因克隆与生物信息学分析
齐小浪 杜娟 李尚伟


摘 要:九香虫Coridius chinensis是一种药食两用的资源昆虫,溶菌酶是一种能水解细菌中黏多糖的胞壁质酶。本研究克隆了一种九香虫溶菌酶基因CcLys2,其cDNA长1096 bp,包含一个长672 bp的开放阅读框,编码223个氨基酸(aa)。九香虫溶菌酶蛋白CcLys2的N端包含一段由13 aa组成的信号肽,成熟CcLys2是一种分子量为23.34 kDa的分泌型亲水蛋白。成熟CcLys2形成7个α-螺旋和2个β-折叠片的三维分子结构,并由4个二硫键稳定其构象。同源性和聚类分析表明,CcLys2与来自斯氏珀蝽Plautia stali的C-型溶菌酶的亲缘关系最近。生物信息学分析结显示,CcLys2很可能属于具有消化作用的C-型溶菌酶。本研究为今后进一步阐明CcLys2基因的功能及开发新型抗菌药物奠定基础。
关键词:九香虫;溶菌酶;基因克隆;特征分析
中图分类号:R282文献标识码:A
文章编号:1008-0457(2020)03-0011-06 国际DOI编码:10.15958/j.cnki.sdnyswxb.2020.03.002
Gene Cloning and Bioinformatics Analysis of Lysozyme CcLys2 from Coridius chinensis
QI Xiaolang, DU Juan, LI Shangwei.*
(Provincial Key Laboratory for Agricultural Pest Management of Mountainous Regions, Institute of Entomology, Guizhou University, Guiyang, Guizhou 550025, China)
Abstract:Coridius chinensi is an important resource insect as medicine and food. Lysozyme, also known as muramidase or N-acetylmuramide glycanhydrolase, can hydrolyze mucopolysaccharide in bacteria. In this study, a lysozyme gene, named CcLys2,was cloned from C. chinensis. The cDNA of CcLys2 is 1,096 bp in length and contains an open reading frame (ORF) of 672 bp that encodes 223 amino acids (aa). The CcLys2 zymoprotein contains a signal peptide composed of 13 aa at N-terminus. The mature CcLys2 is a secretory hydrophilic protein with a molecular weight of 23.34 kDa, and forms a three-dimensional molecular structure of 7 α-helixes and 2 β-pleated sheets with 4 disulfide bonds to stabilize the conformation. Homology and cluster analyses show CcLys2 possesss the closest relationship with C-type lysozyme from Plautia stali. Bioinformatics analysis show that CcLys2 probably belongs to digestive C-type lysozyme. This study lays a foundation for further elucidating the function of the CcLys2 gene and developing new antimicrobials in the future.
Keywords:Coridius chinensis; lysozyme; gene cloning; characteristic analysis
多细胞生物常遇到病原生物的侵染,尽管昆虫缺乏经典意义上的适应性免疫系统,但它们也拥有强大的抗感染手段,如吞噬细菌和包裹寄生虫的能力,这些反应包括激活胞外蛋白酶级联、黑化反应及诱导抗菌肽基因表达[1]。溶菌酶(lysozyme)是先天免疫的重要成员之一,作为一种N-乙酰胞壁质聚糖水解酶,其在生物作用上因种类差异主要有抗菌防御及消化酶的功能[2]。C-型溶菌酶(1,4-β-N-乙酰胞壁酰胺酶)是一种分泌型溶菌酶,多分布于节肢动物、鱼类、鸟类及哺乳动物体内,是至今所有溶菌酶中研究得最为广泛和深入的一类酶. [3]。肽聚糖和壳聚糖是细菌细胞壁的主要成分,而β-1,4-糖苷键是穩定肽聚糖和壳聚糖的重要结构,C-型溶菌酶通过特异性裂解β-1,4-糖苷键,破坏病原菌细胞壁而具有溶菌活性,保守的天光氨酸和谷氨酸是发挥C型溶菌酶溶菌活性所必需的功能结构位点. [4-5]。
九香虫Coridius chinensis是一种以葫芦科植物汁液为食的半翅目兜蝽科昆虫,主要分布于我国的沿海、中部及西南地区[6]。九香虫是一种药食两用昆虫,临床上具有理气止痛、温中助阳等药用功效。该虫味道及营养价值俱佳,可作为一种保健食品,贵州道真等地都有食用九香虫的习惯,是临床上和保健食品中具有极大开发利用价值的资源昆虫[7-8]。九香虫具有较强的免疫防护能力,其在野外被外源异物侵染死亡的情况较为罕见,提示九香虫有着较为完善的免疫系统。研究发现,九香虫血淋巴中的某些蛋白对细菌和癌细胞都具有抑制或杀伤作用,吴玛莉[9]等从九香虫血淋巴中提取的多肽对大肠杆菌和金黄色葡萄球菌都具有抑制效果;李尚伟等[10]通过质谱法从九香虫血淋巴分离得到的CcAMP1对G.+及G.-均具有明显的抑菌作用;九香虫血淋巴能显著抑制胃癌细胞 SGC-7901生长,通过进一步提纯发现该虫血淋巴的蛋白提取物对SGC-7901亦具有显著的生长抑制活性[11-12]。目前C-型溶菌酶的研究主要集中在脊椎动物及蝇类中,而半翅目昆虫C-型溶菌酶的研究相对较少。该研究从九香虫转录组数据库中筛选出一种溶菌酶基因命名为CcLys2,利用反转录PCR(reverse transcription-PCR, RT-PCR)克隆验证了该基因的序列,并用生物信息学软件和方法对其进行生物信息学分析。该研究为C-型溶菌酶家族再添加一个新成员,为进一步研究CcLys2基因的功能及九香虫资源的开发利用奠定基础。
1 材料与方法
1.1 材料来源
九香虫成虫采集于贵州省贵阳市花溪区,以人工种植的南瓜杆茎饲喂于人工气候箱内,饲养条件为:温度(25±2)℃,湿度(68±5%),光周期14L:10D。
1.2 总RNA提取及第一链cDNA制备
根据HP Total RNA Kit(Omega Bio-Tek, GA, USA)说明书提取九香虫总RNA,采用1%琼脂糖凝胶电泳检测总RNA的完整性,使用NanoDrop 2000紫外分光光度计(Thermo Fisher, MA, USA)检测其纯度和浓度,检测合格的RNA于-80℃保存备用。第一链cDNA的制备根据RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher, MA, USA)说明书进行操作,于-20℃冰箱保存备用。
1.3 CcLys2基因克隆
基于从九香虫转录组数据库中筛选出的一条溶菌酶基因的部分序列,用NCBI的Primer-BLAST设计特异性引物(CL-F: ATGTTGCTGCTCTTCCTCCT; CL-R: CTGACTGACCACACCAAGATTC),并送至生工生物工程(上海)股份有限公司进行合成。在T100 PCR仪(Bio-Rad, CA, USA)上进行目的基因扩增,反应体系为50μL: 25μL2×TsingKe Master Mix(北京擎科生物公司),2μL cDNA模板,上/下游引物(10 μM)各1μL,补加21μL灭菌超纯水。反应条件:94℃预变性3min; 94℃变性30s, 55℃退火30s, 72℃延伸40s, 30个循环;72℃延伸10min。PCR产物经电泳检测后,回收纯化目的基因,连接到pMD18-T载体并转化大肠杆菌DH5α感受态细胞,涂布于含氨苄青霉素的LB培养基上,37℃过夜培养。挑取重组子进行菌落PCR鉴定,送阳性克隆至生工生物工程(上海)有限公司进行测序,将所测序列与转录组数据库中溶菌酶基因序列进行比对验证。
1.4 生物信息学分析
CcLys2基因的编码区用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)进行预测,采用SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,用ProtParam (https://web.expasy.org/protparam/) 对酶蛋白进行分子量和等电点预测。用NetOGlyc 4.0Server (http://www.cbs.dtu.dk/services/NetOGlyc/) 和NetNGlyc 1.0Server(http://www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位,DiANNA 1.1web server(http://clavius.bc.edu/~clotelab/DiANNA/)预测二硫键,KinasePhos(http://kinasephos.mbc.nctu.edu.tw/)预测磷酸化位点,PSORT II Prediction(https://psort.hgc.jp/form2.html)预测亚细胞定位。用InterPro(http://www.ebi.ac.uk/interpro)分析酶蛋白的结构域。用DNAMAN 9(Lynnon Biosoft, CA, USA)将CcLys2氨基酸序列与其他13种昆虫溶菌酶氨基酸序列进行比对,并用MEGA X构建溶菌酶的邻接树(NJ法),重复运行1000次,节点上的数值表示自举检验值。表2为氨基酸序列比对和构建进化树的溶菌酶来源物种及相应的GenBank登录号。用PredictProtein(https://www.predictprotein.org/)预测成熟CcLys2的二级结构,使用 SWISS-MODEL (https://swissmodel.expasy.org/)的同源建模方法预测其三维结构,用PyMOL2.3(Schrodinger, New York, USA)绘制其分子结构图。
2 结果与分析
2.1 CcLys2的cDNA克隆
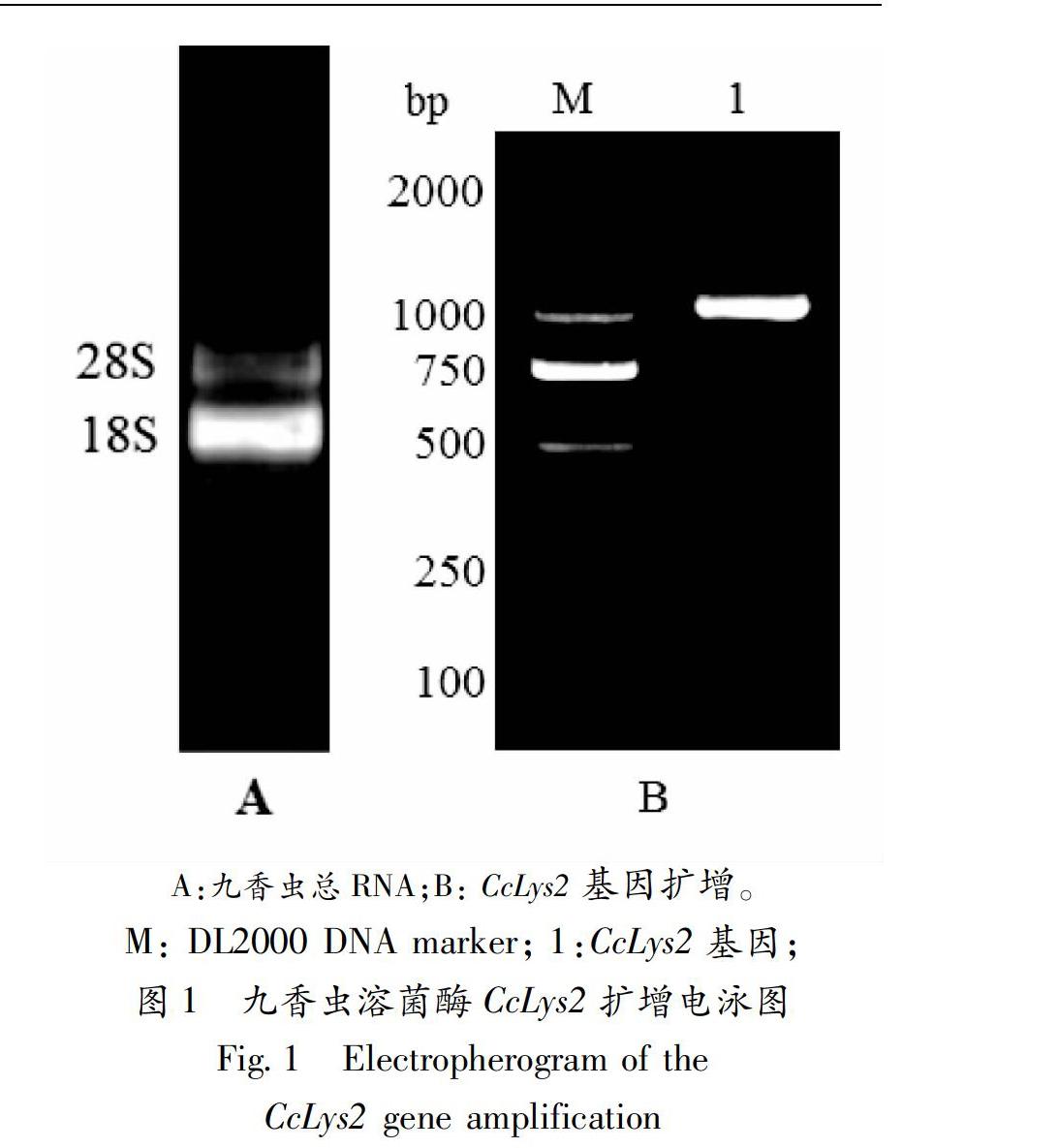
九香虫总RNA电泳图显示清晰的28S和18S两条带(图1-A),紫外分光光度计检测显示其A260/A280比值为1.90,故提取的总RNA浓度及纯度较好,能满足后续的实验要求。RT-PCR扩增九香虫溶菌酶CcLys2基因的cDNA序列,得到单一明亮且符合预期大小的条带,测序验证其长度为1096bp(图1-B)。CcLys2基因的cDNA长度为1096bp(GenBank登录号:MN816376),包含一个长672bp的开放阅读框,编码223个氨基酸(aa),3′端非编码区为424bp,具有典型的加尾信号AATAAA(图2)。
2.1 CcLys2特征分析
九香虫溶菌酶蛋白CcLys2的N端包含一段由13 aa组成的信号肽,成熟蛋白由210 aa组成。理
A:九香虫总RNA;B: CcLys2基因扩增。
M: DL2000 DNA marker; 1:CcLys2基因;图1 九香虫溶菌酶CcLys2扩增电泳图Fig.1 Electropherogram of the CcLys2 gene amplification
化性质分析表明,成熟CcLys2的分子式为C1013H1566N282O331S11,分子量为23.34 kDa,理论等电点pI为5.20;含有30个负电荷氨基酸残基(Asp和Glu),25個正电荷氨基酸残基(Arg和Lys)。亲水性平均系数为-0.56,不稳定指数为24.32,这表明成熟CcLys2为稳定的亲水蛋白。成熟CcLys2具有2个N-糖基化位点(N36, N135)和17个O-糖基化位点,6个磷酸化位点(S82, S132, S134, S151, S198, Y120)。亚细胞定位预测显示,CcLys2为分泌蛋白,分布在细胞外基质的概率为77.8%,而分布在细胞质及线粒体的概率分别为11.1%。
结构域分析结果显示,成熟CcLys2具有糖苷水解酶22家族(Glycoside hydrolase family 22, GH22)中C-型溶菌酶亚家族的保守位点与结构催化域,属于GH22家族成员。GH22家族包括C-型溶菌酶和α-乳清蛋白,这两类蛋白约有35-40%的氨基酸及4个二硫键的位置是保守的,但其功能完全不同。同源建模预测结果显示,成熟CcLys2中1-126 aa形成7个α-螺旋,2个β-折叠片及10个无规卷曲,并用4个二硫键(C6-C124, C27-C113, C62-C73, C69-C87)稳定其构象(图3)。
2.3 同源性分析与聚类树
将CcLys2的氨基酸序列在NCBI的Nr蛋白数据库里用BlastP进行在线比对,结果表明CcLys2与源自斯氏珀蝽P. stali的C-型溶菌酶氨基酸序
列有着较高的同源性,相似度为65.45%。将CcLys2同13个来源于其他昆虫的溶菌酶氨基酸序列比对后发现,组成不同溶菌酶的氨基酸残基数有137-228个不等,但均具有保守的8个半胱氨酸位点及催化活性位点E32和D50,这是维持溶菌酶结构和功能所必需的结构(图4)。系统进化树显示,CcLys2与茶翅蝽溶菌酶及斯氏珀蝽溶菌酶聚为一支,再与温带臭虫溶菌酶聚为一支(图5)。同源性与聚类分析结果表明,CcLys2与来自斯氏珀蝽的C-型溶菌酶具有最近的亲缘关系。
3 结论与讨论
作为动物体内抵御病原菌的关键抗菌物质,C-型溶菌酶基因大多表达于动物的免疫组织和细胞中,昆虫C-型溶菌酶主要在血淋巴和脂肪体中表达[7],在昆虫抵抗外源病菌的过程中扮演着重要
角色。通常具有抗菌作用的溶菌酶皆为碱性蛋白,等电点偏高,而具有消化作用的溶菌酶与此相反,其最适pH范围较窄,等电点仅在5左右,并且对胃蛋白酶不敏感。消化型的C-型溶菌酶在昆虫肠道中能够水解细菌细胞壁,释放胞内的内容物,帮助宿主吸收有用的成分以满足本身对营养物质及能量的需求。来源于黑腹果蝇Drosophila melanogaster的6种C-型溶菌酶,仅LysP为碱性蛋白,而LysB, LysC, LysD, LysE和LysS皆为酸性蛋白,且在肠道中高表达[13]。在本研究中,九香虫溶菌酶CcLys2的等电点为5.2,具有同其他消化型溶菌酶一样的等电点,推测其可能属于消化性溶菌酶,其功能还需要进一步研究。
已报道的C-型溶菌酶具有典型的结构特征,如8个保守的半胱氨酸残基形成4个二硫键,这是维持溶菌酶高级结构及酶活所必需的共价键;同时4个二硫键使分子呈紧密椭圆形有助于溶菌酶分泌到胞外[14-15]。九香虫溶菌酶CcLys2的氨基酸序列在相应位点也有8个半胱氨酸残基,具有C-型溶菌酶的特征。Glu和Asp是溶菌酶活性中心的关键氨基酸,是溶菌酶发挥水解功能必不可少的功能结构域,通过协同作用催化β-1,4-糖苷键的水解[16-17],CcLys2也具有相似的活性位点Glu32和Asp50。C-型溶菌酶可分为钙结合亚型与非钙结合亚型[18],钙结合型溶菌酶分别在第101、106和107保守位点上具有结合钙离子的3个Asp残基。九香虫溶菌酶CcLys2具有这3个保守的Asp,因而应属于C-型溶菌酶的钙结合亚型。人、鸡和昆虫的C-型溶菌酶约有150个氨基酸残基,而本研究中成熟CcLys2具有210个氨基酸,所增加或缺少的氨基酸残基都不属于酶活性中心和结构上的保守位点,推测这不影响其活性及构象。总之,九香虫溶菌酶CcLys2具有4个二硫键、2个C-型溶菌酶酶活性中心的关键氨基酸及钙离子结合位点,这些结构特征表明,CcLys2很有可能具有消化性溶菌酶的生物活性,当然其结构与功能的关系有待进一步深入研究。
本研究克隆了一种九香虫溶菌酶基因CcLys2,并分析了溶菌酶蛋白结构特征,该酶可能属于具有消化作用的C-型溶菌酶,为今后进一步研究该基因的功能及开发新型抗菌药物奠定基础。
参 考 文 献:
[1] KANEKO T, GOLDMAN W E, MELLROTH P, et al. Monomeric and polymeric gram-negative peptidoglycan but not purified LPS stimulate the Drosophila IMD pathway[J]. Immunity, 2004, 20(5):637-649.
[2] CALLEWAERT L,MICHIELS C W.Lysozymes in the animal kingdom[J].Journal of biosciences,2010,35(1):127-160.
[3] 劉梅,张士璀. 溶菌酶C及其生物学功能[J]. 生命的化学, 2006, 26(5):465-467.
[4] HIKIMA S, HIKIMA J I, ROJTINNAKORN J, et al. Characterization and function of kuruma shrimp lysozyme possessing lytic activity against Vibrio species[J]. Gene, 2003, 316(1):187-195.
[4] SANZ J M, GARCIA P, GARCIA J L. Role of Asp-9 and Glu-36 in the active site of the pneumococcal CPL1 lysozyme: an evolutionary perspective of lysozyme mechanism[J]. Biochemistry, 1992, 31(36):8495-8499.
[5] 張颖,陈建伟,高源. 九香虫资源鉴定、化学、药理与药食应用研究[J]. 亚太传统医药,2009,5(9):44-47.
[6] 姚银花. 九香虫的生物学特性及其应用价值[J]. 黔东南民族师范高等专科学校学报, 2006, 24(6):48-49.
[7] 郭玉红,张庆林. 药食昆虫九香虫的生物学及开发利用研究进展[J]. 时珍国医国药, 2015, 26(3):692-693.
[8] 吴玛莉,金道超. 九香虫血淋巴及其纯化蛋白抑菌活性的研究[J]. 应用昆虫学报, 2005, 42(3):315-318.
[9] 李尚伟,赵柏松,杜娟. 九香虫抗菌肽CcAMP1的分离纯化和抗菌活性检测[J]. 昆虫学报, 2015, 58(6):610-616.
[10] 檀军, 郭建军, 魏超,等. 九香虫血淋巴对胃癌SGC-7901细胞体外增殖的抑制作用[J]. 山地农业生物学报, 2013,32(2):28-31.
[11] 曹米兰, 檀军, 金道超,等. 九香虫血淋巴三种生物分子对胃癌SGC-7901细胞增殖影响[J]. 山地农业生物学报, 2018, 37(2):41-45.
[12] DAFFRE S, KYLSTEN P, SAMAKOVLIS C, et al. The lysozyme locus in Drosophila melanogaster: an expanded gene family adapted for expression in the digestive tract[J]. Molecular and general genetics, 1994, 242(2):152-162.
[13] IRWIN D M, GONG Z M. Molecular evolution of vertebrate Goose-type lysozyme genes[J]. Journal of molecular evolution, 2003, 56(2):234-242.
[14] ARAI M, HAMEL P, KANAYA E, et al. Effect of an alternative disulfide bond on the structure, stability, and folding of human lysozyme[J]. Biochemistry, 2000, 39(12):3472-3479.
[15] LOEW G H, THOMAS D D. Molecular orbital calculations of the catalytic effect of lysozyme: 1. Glu 35 as general acid catalyst[J]. Journal of theoretical biology, 1972, 36(1):89-104.
[16] MALCOLM B A, ROSENBERG S, COREY M J, et al. Site-directed mutagenesis of the catalytic residues Asp-52 and Glu-35 of chicken egg white lysozyme[J]. Proceedings of the National Academy of Sciences, 1989, 86(1):133-137.
[17] LIU F, WEN Z. Cloning and expression pattern of the lysozyme C gene in zebrafish[J]. Mechanisms of development, 2002,113(1):69-72.
[18] LIU F, WEN Z. Cloning and expression pattern of the lysozyme C gene in zebrafish[J]. Mechanisms of development, 2002,113(1):69-72.

