金红石型TiO2/ZnTiO3复合材料的制备及其光催化性能
朱晓东王 娟罗宇浩代华龙喻 强冯 威*
(1.成都大学机械工程学院,四川成都 610106; 2.四川新亚无损检测有限公司,四川成都 610213)
1 引 言
随着全球工业的发展,环境污染越来越严重,利用光催化技术降解污染物是解决污染问题的一种重要手段[1]。TiO2作为一种环境友好光催化材料,以其价格低廉、无毒无害、化学性质稳定、效率高等优点而备受关注[2-3]。由于纯TiO2存在光生电子-空穴对易复合、对太阳光利用率低等缺点[4-5],在实际使用中,通常对其进行改性处理,以提高光催化性能[6-9]。在改性方法中,离子掺杂被广泛采用。Anju等[10]采用水热法制备了纯TiO2与不同元素(Fe,Co,Ni)掺杂 TiO2的光催化剂,研究发现掺杂之后都能减小禁带宽度,增加对光的利用率,提高光催化性能。Kalantari等[11]利用超声辅助浸渍法制备了Fe、N单掺杂和共掺杂TiO2光催化剂,研究表明Fe、N的掺杂都能导致改性TiO2样品带隙能的降低,对光的利用增强,掺杂后光催化性能均高于纯TiO2,且Fe、N共掺杂样品表现出最佳光催化活性,对二苯并噻吩(DBT)的去除率达到59.8%。当掺杂浓度过高,就可能出现新相,形成半导体复合结构,半导体复合结构能够加快光生电子与空穴的迁移,提高光催化活性[5,7]。张进等[12]采用溶胶-凝胶法制备了TiO2-ZnTiO3纳米复合薄膜,研究结果表明,Zn浓度越高,ZnTiO3含量越多,半导体TiO2与ZnTiO3通过耦合作用,促进光生电子-空穴的分离,使其光催化性能更好,在Ti/Zn=6∶1时,复合薄膜在紫外光下对亚甲基蓝(MB)溶液的降解率可达94%。TiO2/ZnTiO3体系研究集中在锐钛矿TiO2[5]以及锐钛矿/金红石混晶TiO2[12],针对纯金红石TiO2/ZnTiO3复合结构的研究较少。一般认为金红石的光催化活性低于锐钛矿或者混晶结构,但是也有研究表明经过一定的改性处理,金红石活性明显提高,甚至高于锐钛矿[1,3]。因此,对金红石进行改性,探索提高金红石基复合光催化剂性能有很好的研究意义。本文通过溶胶-凝胶法制备了金红石型TiO2/ZnTiO3复合光催化剂,对样品进行了晶体结构、表面形貌、元素价态等表征,并以MB为目标污染物,研究了金红石型TiO2/ZnTiO3复合光催化剂的光催化性能。
2 实 验
2.1 材料制备
在溶液A中依次加入体积比为2∶1的无水乙醇和钛酸丁酯,在B溶液中加入去离子水、冰乙酸、无水乙醇,其体积比为2∶3∶6。搅拌均匀后将溶液B滴加入A溶液中,保持搅拌形成溶胶,室温下陈化形成凝胶后将其置于烘箱中在100℃下烘干,对其进行650℃下保温1 h的热处理即得最终纯TiO2粉体。在溶液B中加入一定量硝酸锌,其余步骤相同,即可制得不同Zn/Ti浓度的光催化剂,本次实验Zn/Ti原子百分比为0.5%、2%、8%。
2.2 表征技术
样品晶体结构采用DX-2700型X射线衍射仪进行分析(XRD),形貌由SU8220型扫描电子显微镜进行分析(SEM),元素组成以及价态由XSAM800型多功能表面分析系统进行分析(XPS),光生电子与空穴复合检测采用F-4600型荧光光谱仪进行分析(PL)。
2.3 光催化实验
以MB水溶液为目标污染物,初始浓度为10 mg/L,取100 mL倒入烧杯,加入样品粉体0.1 g,超声分散10 min,随后将其置于暗态搅拌30 min以达到吸附脱附平衡,然后用250 W氙灯作为光源,反应开始后每隔30 min取样一次,离心分离后取上层澄清溶液,在λ=664 nm处测试其吸光度A,并由公式(A0-At)/A0×100%计算降解率,其中A0、At分别为初始以及t时刻的吸光度,整个测试过程持续90 min。
3 结果与分析
3.1 XRD分析
图1为纯TiO2与Zn-TiO2样品的XRD图。可以看到纯 TiO2图在2θ为 27.4°、36.1°、41.2°、54.4°、56.7°、69.1°的位置出现了明显的衍射峰,分别与金红石晶型的(110)、(101)、(111)、(211)、(220)、(301)晶面相对应,表明纯 TiO2是金红石结构(PDF No.21-1276)。Zn-TiO2样品的衍射峰强度降低,半高宽由纯TiO2的0.160增大到0.186(8%Zn-TiO2),这可能是因为Zn2+的离子半径(0.074 nm)大于Ti4+的离子半径(0.060 5 nm),一部分Zn2+在取代Ti4+晶格位置时,由于价态与离子半径的不同,会在取代位置附近形成晶格缺陷,使得非晶成分增加,结晶度降低,表明Zn加入会抑制TiO2晶型的完整性[13]。值得注意的是在Zn/Ti量比为2%与8%的样品中,除了有金红石特征峰外,还在 32.9°、35.4°、49.0°、53.5°、61.9°等位置出现了新的衍射峰,对应ZnTiO3的(104)、(110)、(024)、(116)、(214)晶面(PDF No.26-1500)[12],形成了金红石 TiO2/ZnTiO3的半导体复合结构。且随着Zn浓度增加,这些峰强度也随之增大。

图1 纯TiO2和Zn-TiO2XRD图Fig.1 XRD patterns of pure TiO2and Zn-TiO2
由谢乐公式计算样品的金红石平均晶粒尺寸,随着Zn/Ti量比的提高,晶粒尺寸由纯TiO2的50.5 nm减小到43.5 nm(Zn/Ti=8%),可能是因为Zn2+置换TiO2晶格中的Ti4+离子,相互作用形成Ti—O—Zn键,阻止了晶粒的生长[14-15]。
3.2 SEM分析
图2为纯TiO2与TiO2/ZnTiO3(Zn/Ti=8%)样品的SEM照片。从照片中可以看出,样品的颗粒形状不规则,呈现板块状类似形貌,颗粒团聚现象严重,尺寸也有较大波动,从几十纳米到几百纳米均有分布。由于纳米材料具有较大的比表面积,表面存在的大量孪晶、位错等晶体缺陷使纳米颗粒具有极大的不饱和性,容易自发团聚形成大颗粒[16]。由SEM照片对比可知,Zn加入对TiO2颗粒形貌改变不明显。

图2 纯TiO2(a)及TiO2/ZnTiO3(Zn/Ti=8%)(b)SEM照片Fig.2 SEM images of pure TiO2(a)and TiO2/ZnTiO3(Zn/Ti=8%)(b)
3.3 XPS分析
为了分析样品的元素组成及价态,对纯TiO2及TiO2/ZnTiO3(Zn/Ti=8%)进行XPS测试,结果如图3所示。图3(a)为全谱图,从图3(a)可知,TiO2/ZnTiO3(Zn/Ti=8%)组成元素为 Ti、O、Zn、C,C元素主要来源于测试过程中的污染。相对于纯TiO2,出现了Zn元素特征峰,表明Zn元素已经存在于样品中。图3(b)为Ti 2p高分辨图谱,Ti 2p3/2和Ti 2p1/2轨道对应的结合能分别为 458.44 eV和 464.04 eV、458.50 eV和464.13 eV,表明 Ti元素为 +4 价[4,17];TiO2/Zn-TiO3(Zn/Ti=8%)的Ti 2p1/2和Ti 2p3/2结合能分别比纯TiO2向高结合能偏移了0.09 eV和0.06 eV。从图3(c)Zn 2p高分辨图谱可知,Zn 2p在1 021.70 eV和1 044.85 eV两处均出现了特征峰,分别对应于Zn 2p3/2和Zn 2p1/2,表明Zn元素以+2价形式存在[17-18]。图3(d)为O 1s高分辨图谱,纯TiO2特征峰位于529.80 eV和531.75 eV,分别对应于晶格氧(O2-)与表面羟基(OH-)[4,17,19];与之类似,TiO2/ZnTiO3(Zn/Ti=8%)O 1s峰位于529.83 eV和531.66 eV,也分别对应晶格氧和表面羟基。结合图3(b)和图3(d)可知,Zn掺杂后样品的Ti 2p和O 1s结合能均发生了微弱偏移,这可能归因于Zn2+进入TiO2晶格和TiO2的Ti、O元素发生了相互作用[18]。计算可得,纯TiO2表面羟基中氧元素含量占所有氧元素的比例为13.5%,TiO2/ZnTiO3(Zn/Ti=8%)为19.7%,表面羟基增多。Zn加入后样品晶粒尺寸减小,且会使TiO2表面产生氧空位,吸附了更多的羟基,这些羟基与空穴结合反应生成氢氧自由基,具有很强的氧化能力,有利于对污染物的降解[19]。

图3 纯TiO2及TiO2/ZnTiO3(Zn/Ti=8%)的XPS图谱。(a)全谱图;(b)Ti 2p高分辨图谱;(c)Zn 2p高分辨图谱;(d)O 1s高分辨图谱。Fig.3 XPS spectra of pure TiO2and TiO2/ZnTiO3(Zn/Ti=8%).(a)Total spectra.(b)High resolution spectra of Ti 2p.(c)High resolution spectrum of Zn 2p.(d)High resolution spectra of O 1s.
3.4 PL分析
TiO2受到能量大于禁带宽度能量的光照射时,价带上的电子会跃迁至导带变成光生电子,并在价带形成对应的光生空穴,光生电子与光生空穴非常容易发生复合,释放出光子。因此,高的PL峰强度代表着高的电子空穴复合率[20-21]。
图4为样品PL光谱图,由图可知,TiO2/Zn-TiO3(Zn/Ti=8%)的峰强度最低,表明具有最小的光生电子空穴复合率。0.5%Zn掺杂 TiO2、TiO2/ZnTiO3(Zn/Ti=2%)略高于纯TiO2,这可能是Zn加入后非晶成分增多,在光催化剂表面引入了缺陷,这些缺陷成为了光生电子与空穴的复合中心,因此PL峰强度略有增强[22-23]。另一方面,在TiO2/ZnTiO3(Zn/Ti=2%)和 TiO2/ZnTiO3(Zn/Ti=8%)样品中生成了新相ZnTiO3,ZnTiO3也是一种半导体,两种半导体的能带结构由于导带和价带位置不一致而产生交叠,加快了光生电子与空穴的迁移,降低了复合率,使得峰强度降低[5,12,24-26]。 且随着掺杂浓度的增加,阻碍光生电子-空穴对的复合作用越强,峰强度降低越多,因此TiO2/ZnTiO3(Zn/Ti=8%)的峰强度最低。

图4 纯TiO2及Zn-TiO2荧光光谱Fig.4 PL spectra of pure TiO2and Zn-TiO2
3.5 光催化性能
图5 为样品对MB的降解曲线,90 min后,纯TiO2、0.5%Zn 掺杂 TiO2、TiO2/ZnTiO3(Zn/Ti=2%)和TiO2/ZnTiO3(Zn/Ti=8%)对MB的降解率分别为36.9%、34.8%、39.9%、68.3%。随着Zn/Ti量比的提高,样品对MB的降解率先下降后升高。由XRD分析可知,Zn加入后衍射峰半高宽增大,表明结晶度有所降低,非晶成分增加,不利于光催化性能[13];此外,由PL测试结果可知,在Zn加入过程引入的晶体缺陷,会成为光生电子-空穴的复合中心,降低了量子利用率,不利于光催化活性。当Zn/Ti量比进一步增加时,生成了新相ZnTiO3,与金红石形成TiO2/ZnTiO3半导体复合结构,如图6所示,金红石的导带位置高于ZnTiO3导带,其导带上的光生电子能够迁移至ZnTiO3导带;同时,金红石的价带位置低于Zn-TiO3价带,光生空穴迁移至ZnTiO3价带,抑制了金红石中光生电子与空穴的复合[5],有利于提高光催化效率,这与PL光谱分析结果一致。此外,XPS结果显示TiO2/ZnTiO3(Zn/Ti=8%)表面羟基含量高于纯TiO2,在光催化过程中可以生成更多的氢氧自由基,能有效地降解MB分子,因此TiO2/ZnTiO3(Zn/Ti=8%)的光催化性能最好。
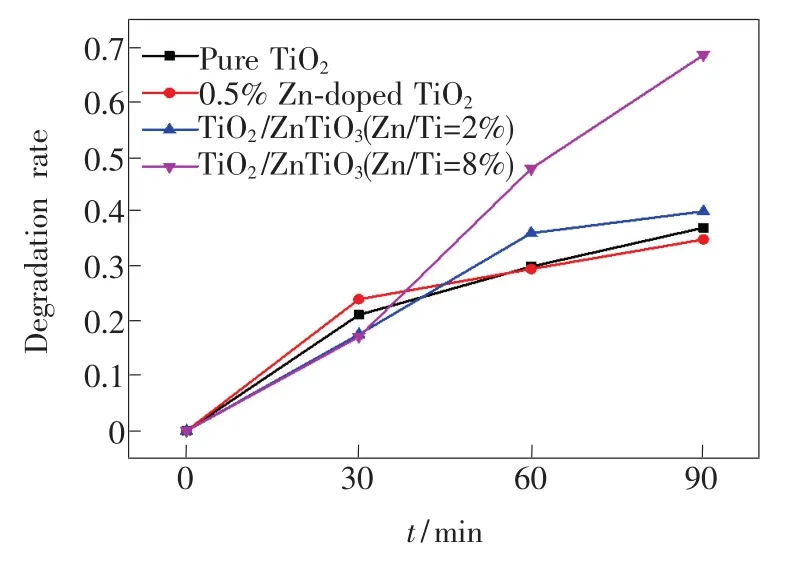
图5 样品对MB的降解曲线Fig.5 Photocatalytic degradation curves of MB for samples

图6 TiO2/ZnTiO3光生电子与空穴迁移示意图Fig.6 Schematic diagram of TiO2/ZnTiO3photogenerated electrons and holes migration
光催化降解MB的一级动力学曲线如图7所示,ln(Ct/C0)与反应时间t呈线性关系。反应速率常数k可用公式kt=-ln(Ct/C0)[4]计算得到(其中t为反应时间,Ct表示时间为t时MB的浓度,C0表示初始浓度)。在一定反应时间内,k越大,表明光降解反应速度越快,光催化活性越高。纯TiO2、0.5%Zn 掺杂 TiO2、TiO2/ZnTiO3(Zn/Ti=2%)和TiO2/ZnTiO3(Zn/Ti=8%)的一级反应速率常数k分别为0.004,0.003,0.005,0.012 min-1,TiO2/ZnTiO3(Zn/Ti=8%)的k值大约为纯TiO2的3倍,具有最快的反应速率,结果与降解率高低保持一致。

图7 样品降解MB的动力学曲线Fig.7 Degradation kinetics curves of MB over samples
4 结 论
采用溶胶-凝胶法制备了TiO2/ZnTiO3复合光催化剂,对其进行了晶体结构、表面形貌、元素组成与价态、光生电子空穴与复合等分析,以MB降解率评价其光催化性能,结论如下:(1)650℃热处理后,TiO2为金红石结构,Zn加入减小了TiO2的晶粒尺寸;Zn/Ti量比达到2%时,生成新相ZnTiO3,形成了金红石TiO2/ZnTiO3半导体复合结构;(2)TiO2/ZnTiO3(Zn/Ti=8%)表面羟基含量高于纯TiO2,形成的TiO2/ZnTiO3复合结构有利于加快光生电子与空穴的转移;(3)TiO2/ZnTiO3(Zn/Ti=8%)的光催化性能最好,对MB的降解率是纯TiO2的1.85倍,其一级反应速率常数是纯TiO2的3倍。
——以金红石为例

