PPOS方案与GnRH拮抗剂方案应用于卵巢低反应患者的促排卵疗效的Meta分析
陈雅婕,吴庚香
(武汉大学人民医院生殖医学中心,武汉 430060)
卵巢低反应(POR)是卵巢对促性腺激素(Gn)的刺激反应不良的病理状态[1]。POR患者因难以获得令人满意的卵泡数量与质量,临床预后常不佳[2]。根据2011年ESHRE提出的POR共识中的博洛尼亚标准[3],至少满足以下3条中的2条即可诊断POR:(1)高龄(≥40岁)或存在卵巢反应不良的其他危险因素;(2)前次IVF周期卵巢低反应,常规方案获卵数≤3个;(3)卵巢储备下降,窦卵泡数(AFC)<5~7个或抗苗勒管激素(AMH)<0.5~1.1 μg/L。近年的调查显示,中国妇女的POR发生率为21.16%[4],随着年龄的增长,卵巢储备逐渐降低。
控制性卵巢刺激(COS)是临床进行IVF-ET治疗不孕症重要的一环。GnRH拮抗剂(GnRH-ant)方案是IVF-ET常见的COS方案,相比于常规GnRH激动剂(GnRH-a)长方案,拮抗剂方案已证实有与长方案相当的功效和更好的安全性,有着治疗周期短、Gn用量小的优点[5]。近年来,随着冻融胚胎移植技术(FET)的发展,高孕激素状态下促排卵(PPOS)方案作为一种新的促排卵方案应运而生。PPOS方案可有效阻断LH激增,减少GnRH-ant对子宫内膜容受性的潜在影响,然而,该方案受子宫内膜的不同步所限制,需要全部胚胎冷冻后择日行冻融胚胎移植[6]。有研究报道,PPOS方案能显著改善卵巢储备不足患者的卵母细胞数量与质量[7]。
本研究旨在汇总对PPOS方案与GnRH-ant方案应用于POR患者的疗效比较的相关报道,运用Meta分析得出更可靠的结果,以便临床医生提供更佳治疗,为临床工作中方案的抉择提供更多信息。
资料与方法
一、检索策略
计算机检索PubMed、Embase、Cochrane library、中国知网、万方数据知识平台及维普数据库至2019年9月所有有关GnRH-ant方案与PPOS方案POR患者中疗效比较的随机对照试验(Randomized controlled trial,RCT)或临床对照试验(Controlled clinical trial,CCT)。中文关键词包括拮抗剂方案、安宫黄体酮方案、高孕激素状态下促排卵方案、卵巢低反应、卵巢反应不良。英文关键词包括:GnRH antagonist protocol,Gonadotropin-releasing hormone antagonist protocol,GnRH-ant,Progestin-primed ovarian stimulation,PPOS,Poor ovarian response,low response。在此基础上,通过文献追溯研究者相关研究进行补充检索。
纳入标准:(1)研究类型:RCT与CCT,文种限中、英文;(2)研究对象:以PPOS方案和GnRH-ant方案作为COS方案的POR患者,POR诊断标准以2011年博洛尼亚标准[3]为准;(3)结局指标:Gn使用时间、Gn用量、获卵率、早发LH峰率、受精率、优胚率、周期取消率和临床妊娠率。
排除标准:重复文献;不相关文献;综述、Meta分析类描述性研究;PPOS方案与非拮抗剂方案比较的研究;拮抗剂方案与非PPOS方案比较的研究;研究数据不全。
二、研究方法
1.文献筛选和数据提取:由2名研究者按预先设计的表格独立阅读文献,提取资料。若出现意见不一致时,由双方讨论解决或请第3名研究者进行判断。按照纳入与排除标准进行文献筛选,提取的数据包括:纳入研究的基本信息特征、研究方法学和质量评价及结局指标如Gn使用时间、Gn用量、获卵数、早发LH峰率、受精率、优胚率、周期取消率、临床妊娠率。
2.纳入研究的质量方法学评价:采用Cochrane偏倚风险评价工具对纳入RCT研究进行偏倚风险评估。评估内容包括:(1)随机方案产生;(2)分配方案隐藏;(3)盲法;(4)研究结局的盲法评价;(5)数据的完整性;(6)选择性报告结果;(7)其他偏倚。对此7项中每一项作出“是”(低度偏倚)、“否”(高度偏倚)和“不清”(缺乏相关信息或偏倚情况不确定)的判断。
三、统计学分析
采用Review Manager 5.3软件进行 Meta分析。二分类变量采用OR及其95%可信区间(95%CI)表示,连续变量则用MD及其95%CI表示。P<0.05表示差异有统计学意义。不同研究间的异质性检验使用I2来描述,检验水平为I2=50%。无异质性或异质性不大的结果(I2<50%)采用固定效应模型合并分析;如有较大异质性者(I2>50%),首先分析异质性产生的原因,如无明显临床异质性,采用随机效应模型合并分析。
结 果
一、检索文献结果及纳入研究的一般信息
计算机检索共得到12篇文献,删除重复文献3篇,通过阅读题目与摘要,排除无关文献1篇,再通过阅读全文,进一步筛选不符合纳入标准的文献1篇,最终纳入7个研究,其中中文6篇[8-13],英文1篇[14],包括1 309例周期。
纳入的所有PPOS组和GnRH-ant方案组总周期数分别为691例和618例。7篇文章全部报道了Gn时间、Gn用量、获卵数、受精率;有6篇文章报道了优胚率[8-9,11-14],分别有5篇文章报道了周期取消率[8-10,12,14]和早发LH峰率[8-9,11-12,14],有4篇文章报道了冻融胚胎移植的临床妊娠率[10,12-14]。对以上结局指标进行Meta分析。其余结局指标报道文献不足4篇,故本研究不予讨论。纳入研究的一般信息见表1。
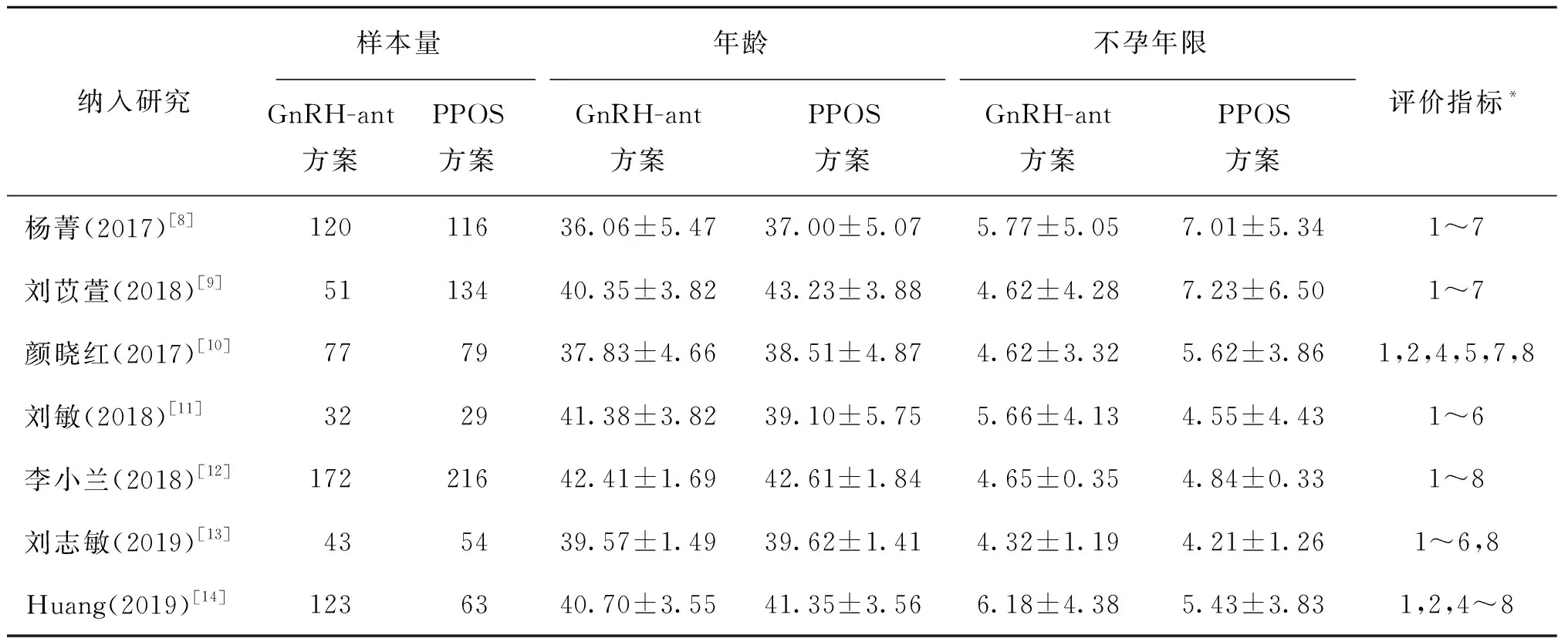
表1 纳入研究文献的一般情况
二、Meta分析结果
1.Gn使用时间:7篇文献[8-14]报道了1 309例周期的Gn使用时间,各研究间存在异质性(I2>50%),更换为随机效应模型计算合并统计量。研究表明,PPOS组的Gn使用时间显著长于拮抗剂方案组[MD=0.42,95%CI(0.11,0.74),P<0.05](图1)。
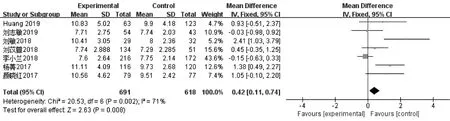
图1 PPOS组与拮抗剂方案组Gn时间的Meta分析
2.Gn用量:7篇文献[8-14]报道了1 309例周期的Gn用量,各研究间存在异质性(I2>50%),更换为随机效应模型计算合并统计量。研究表明,PPOS组的Gn用量显著低于拮抗剂方案组[MD=-287.82,95%CI(-380.96,-194.67),P<0.05](图2)。

图2 PPOS组与拮抗剂方案组Gn用量的Meta分析
3.获卵数:6篇文献[8-9,11-14]报道了1 124例周期的获卵数,各研究间存在异质性(I2>50%),更换为随机效应模型计算合并统计量。研究表明,PPOS组的获卵数显著低于拮抗剂方案组[MD=-0.25,95%CI(-0.44,-0.05),P<0.05](图3)。

图3 PPOS组与拮抗剂方案组获卵数的Meta分析
4.早发LH峰率:5篇文章[8-9,11-12,14]报道了939例周期的早发LH峰率,异质性检验(I2>50%),更换为随机效应模型计算合并统计量。研究表明,PPOS组的早发LH峰率显著低于拮抗剂方案组[OR=0.38,95%CI(0.19,0.77),P<0.05](图4)。
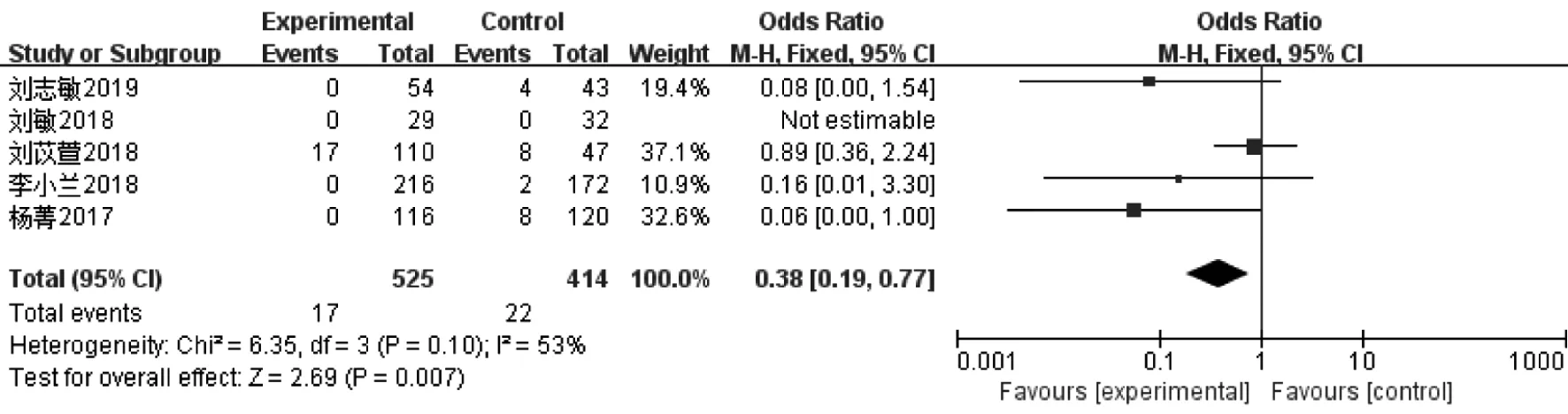
图4 PPOS组与拮抗剂方案组早发LH峰率的Meta分析
5.受精率:7篇文献[8-14]报道了3 159颗卵母细胞的受精率,各研究间同质性较好(I2=9%),故使用固定效应模型计算合并量。研究表明,PPOS方案组与拮抗剂方案组的受精率无统计学差异[OR=1.14,95%CI(0.97,1.36),P>0.05](图5)。
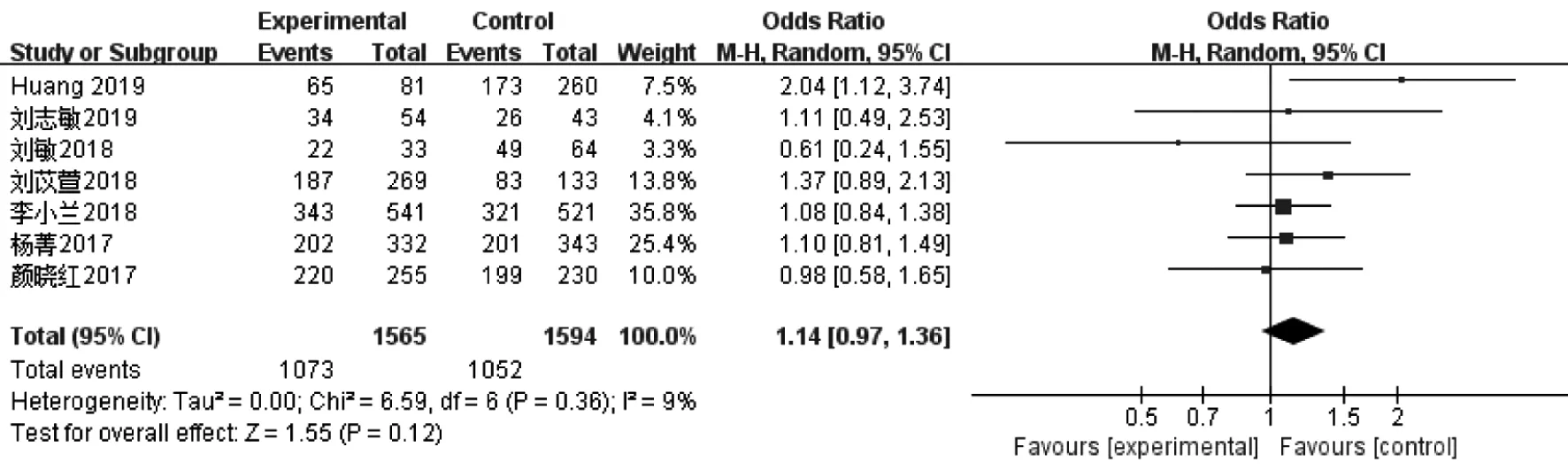
图5 PPOS组与拮抗剂方案组受精率的Meta分析
6.优胚率:6篇文献[8-9,11-14]报道了优质胚胎率,各研究间存在异质性(I2=50%),更换为随机效应模型计算合并统计量。研究表明,PPOS组与拮抗剂方案组的优胚率相比差异无统计学意义[OR=1.13,95%CI(0.94,1.36),P>0.05](图6)。

图6 PPOS组与拮抗剂方案组优胚率的Meta分析
7.周期取消率:5篇文献[8-10,12,14]报道了1 151例周期的取消率,各研究间同质性好(I2=0%),故使用固定效应模型计算合并量。PPOS方案组与拮抗剂方案组的周期取消率相比差异无统计学意义[OR=1.17,95%CI(0.85,1.61),P>0.05](图7)。
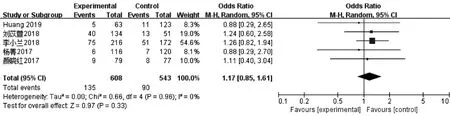
图7 PPOS组与拮抗剂方案组周期取消率的Meta分析
8.临床妊娠率:4篇文章[10,12-14]报道了50例FET的临床妊娠率,各研究间同质性好(I2=0%),故使用固定效应模型计算合并量,PPOS方案组与拮抗剂方案组的临床妊娠率相比差异无统计学意义[OR=1.46,95%CI(0.92,2.32),P>0.05](图8)。
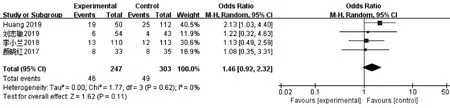
图8 PPOS组与拮抗剂方案组临床妊娠率的Meta分析
9.漏斗图分析纳入文献发表偏倚:以评价指标“Gn使用时间”为例,在比较PPOS方案组与拮抗剂方案组的Meta分析中,以MD为横坐标,SE为纵坐标绘制漏斗图检测发表偏倚,结果显示图形基本对称,分布均匀,显示纳入研究的文献基本无发表偏倚(图9)。
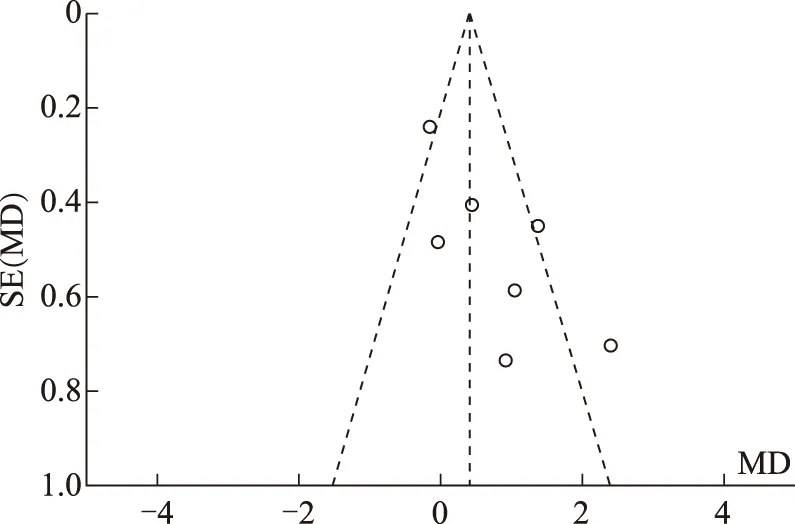
图9 纳入文献发表偏倚分析
讨 论
高龄是POR最重要的病因之一,导致POR的因素还有肥胖、遗传、卵巢病变、药物因素和不明原因的POR等等[15]。在生育年龄逐步增大、开放二胎政策的社会环境下,临床工作中POR发生率逐年增加。POR患者在COS中疗效显著低于正常人群,对促排卵药物反应不良、获卵数少、临床妊娠率低而周期取消率高、常规促排卵治疗结局不理想,是促排卵治疗中的难题。目前临床上用于POR患者的COS方案有激动剂长方案、短方案、拮抗剂方案、微刺激方案、自然周期IVF等等,但哪种方案最适合POR患者还尚未有定论。
拮抗剂方案有着比其他常规方案更佳的临床妊娠率[16],周期短、费用少、依从性好以及卵巢过度刺激综合征(OHSS)发生率更低的优点。而拮抗剂方案与微刺激方案相比,也能明显增加获卵数和有效胚胎数并且降低周期取消率[17]。许多经常规方案治疗疗效不佳的患者调整为拮抗剂方案治疗后,往往能得到较好的预后。但是,拮抗剂方案依然存在一些缺陷:许多研究报道了新鲜胚胎移植的结局差于FET的情况[18-20]。对此,王涛等[21]提出拮抗剂方案中,拮抗剂同时作用于子宫内膜、影响内膜容受性,从而降低新鲜胚胎移植的妊娠率的可能;另外,拮抗剂方案在扳机日使用激动剂触发后可能出现黄体功能不足的情况,进而影响临床妊娠率。
PPOS方案于2011年首先被上海交通大学医学院附属第九人民医院匡延平教授团队提出,原理是利用高孕激素抑制LH峰,并全面进行冻融胚胎移植[22]。随着冻融胚胎移植技术的日益成熟,PPOS作为一项极具发展前景的新方案,也有了更广泛的临床应用。它的出现弥补了常规方案周期长、Gn用量大、卵巢过度刺激并发OHSS、价格昂贵且不灵活的不足,并且该方案降低早发LH峰率的效果也很显著[23]。该方案相比于拮抗剂方案,可降低拮抗剂对子宫内膜容受性的影响,明显降低OHSS发生率,提高优质胚胎率[24]。但是PPOS方案最明显的限制在于该方案子宫内膜发育不同步[25],所以得到的胚胎无法进行新鲜周期移植,必须经冷冻保存后再行冻融胚胎移植术。然而这种限制提供了更多的不限,如可以灵活调整最佳移植时间等。同时由于PPOS方案中使用的安宫黄体酮价格非常便宜,因此对患者友好兼具经济实惠的优点,在供卵周期及胚胎植入前遗传学检测周期中有更大的应用价值。
本研究通过计算机制定检索策略检索国内外共6个数据库并进行人工检索补充,Meta分析结果显示,虽然PPOS方案的Gn使用时间更长、获卵数低于拮抗剂方案,但其Gn用量及早发LH峰率均低于拮抗剂方案,且两组的受精率、周期取消率、优胚率、临床妊娠率等均无统计学差异(P>0.05)。有研究报道,早发LH峰对卵母细胞的质量有着负面的影响[26],POR与卵巢功能储备低下的患者更易出现早发的LH峰[27],表现为外周高LH和低AMH水平[28]。本研究结果显示PPOS方案能有效抑制LH峰,其效果优于拮抗剂方案,虽然其获卵数略低于拮抗剂方案,但其优胚率、冻融胚胎移植临床妊娠率两者相当,综合考虑经济因素,PPOS方案可能对POR的患者获益更大。
综上所述,对POR患者来说,PPOS方案可能较拮抗剂方案获益更大,但由于受语种限制,本研究仅纳入中英文而排除了其他小语种的研究,可能有少部分研究未纳入;同时由于本研究纳入的文献均为回顾性研究,且样本量不大,同时多数PPOS方案周期未报道冻融胚胎移植妊娠情况,因此该结论仍需多中心大样本随机对照研究进一步证实。

