供精人工授精助孕患者人乳头瘤病毒感染情况及妊娠结局分析
王莉莉,郝伟明,史雅萍,郅洋,李艳梅,梁云霞,张晓花,宋海霞,姬英英,郭兴萍
(山西省生殖科学研究所生殖医学中心,太原 030006)
人乳头瘤病毒(human papillomavirus,HPV)属乳多空病毒科,目前已鉴定出多种亚型。临床上根据HPV的侵染偏好及致癌性,将其分为高危型、疑似高危型及低危型[1]。其中高危型感染除与生殖道疣、鳞状上皮内病变(SIL)有关,更与女性宫颈癌的发生发展存在密切关联[1-2]。HPV在女性育龄人群中的携带率较高(约为10%),性传播及密切生活接触是其主要的传播途径[3]。
近年来国内外有文献报道了HPV感染对育龄人群生育力的影响[4-5],但对接受辅助生殖技术(ART)治疗的不孕不育人群的感染情况及其对妊娠结局影响的报道仍较少,尤其是供精人工授精(artificial insemination by donor,AID)助孕患者。本研究回顾了近5年来在山西省生殖科学研究所生殖医学中心接受AID治疗的女性患者HPV感染情况,并通过归纳分析探究HPV感染对AID妊娠结局的影响。
资料与方法
一、研究对象
回顾性分析2014年1月至2019年6月在本所生殖医学中心接受AID治疗的824例女性患者的1 834个AID治疗周期的病例资料。纳入标准:男方因素导致的不育,包括:不可逆的无精子症(如先天性无睾丸、隐睾、输精管缺如)、严重少弱畸精子症、不宜生育的严重遗传性疾病等;女方至少一侧输卵管畅通;无排卵障碍。排除标准:女方高龄(>40岁);子宫内膜炎、治疗过程中出现中重度盆腔炎症等;内分泌异常,如基础性激素水平、甲状腺功能异常等。根据女方HPV感染情况,将上述研究对象分为两组:HPV阳性组共85例(184个周期)与HPV阴性组共739例(1 650个周期)。接受AID治疗前,夫妇双方均知情同意并签署相关知情同意书。
二、研究方法
1.HPV检测:进入治疗周期前的1个月内进行检测。检测方法为PCR-反向点杂交法。检测的HPV型别有:高危型(16、18、31、33、35、39、45、51、52、56、58、59型)、疑似高危型(53、66、68、73、82、83型)和低危型(6、11、42、43、81型)。采用专门的宫颈脱落细胞采集器进行采样,采样后对含脱落细胞的宫颈黏液进行处理,提取HPV DNA,经PCR扩增、产物杂交、洗膜、显色等步骤后,通过膜条上各探针区域的显色情况判读受检者的HPV感染情况。所用检测试剂盒由深圳亚能生物技术有限公司提供,所有操作全部按照试剂盒内说明书进行。
2.治疗方案:根据女方排卵情况,选择自然周期或卵巢微刺激方案。卵巢微刺激方案主要包括氯米芬(CC,高特制药,塞浦路斯)/人绝经期尿促性腺激素(HMG,珠海丽珠制药)+人绒毛膜促性腺激素(HCG,珠海丽珠制药)或CC+HMG+HCG方案。一般自月经第10天左右开始,通过阴道B超监测卵泡发育情况,直至优势卵泡破裂。
3.供精精液选择及处理:所用的供精精液全部来自于山西省人类精子库。依据“血型一致(即供精者与男方患者血型一致)”、“1∶5(即每位供精者精液最多只能使5名女性受孕)”、“每周期使用同一供精者精液”的原则,为患者随机分配精液(1 ml×2支)。患者同意使用后,将装在冻存管中的精液从液氮中取出,置于37℃水浴箱中复苏10 min。复苏后通过双层密度梯度离心法进行处理。处理后精子悬液体积调至0.5~0.6 ml。
4.人工授精:分为排卵前、后双次授精和排卵后单次授精。双次授精:当B超显示优势卵泡未破但患者尿LH呈阳性,或者人工注射HCG后的当日(一般为HCG后3 h内)行第1次授精,待B超确认卵泡破裂后行第2次授精;单次授精:B超确认优势卵泡破裂后的24 h内,将2支精液同时处理后进行授精。人工授精后均给予黄体支持(地屈孕酮10 mg/次,2次/d,口服2周)。
5.妊娠确认:患者于人工授精术后的第14天来院抽血化验β-HCG,确定生化妊娠情况;第35天来院行B超检查,确定临床妊娠情况,并于孕18周继续来院检查,明确胎儿发育情况。
6.观察指标:(1)患者一般情况:女方年龄、HPV感染情况、不孕类型及不孕年限、治疗方案、实施周期数;(2)治疗相关参数:优势卵泡数、处理前后精子浓度与前向运动精子比例、授精日子宫内膜厚度、授精方式;(3)周期妊娠结局:临床妊娠率、生化妊娠率、流产率、异位妊娠率、活产率、持续妊娠率。
三、统计学处理
结 果
一、HPV感染情况
纳入研究的824例女性患者中HPV感染者85例,占10.3%;HPV未感染者739例,占89.7%。其中70例为单一型感染,15例为多型混合感染。单一型感染中高危型(包括疑似高危型)感染60例,占总感染数的70.6%;低危型感染10例,占总感染数的11.8%。混合感染中,高危型感染11例,占总感染数的12.9%,其中大部分为2个型别的感染,少数为3个及3个以上型别的感染,另有4例为低危型与高危型的混合感染,占总感染数的4.7%。高危型中,感染率最高的为16型(17/85,20.0%),另一常见高危型18型的感染率较低(3/85,3.5%),不常见的高危型51型(9/85,10.6%)、52型(12/85,14.1%)、58型(9/85,10.6%)和疑似高危型53型(9/85,10.6%)的感染率较高;低危型中,主要涉及的型别有6型(3/85,3.5%)、42型(5/85,5.9%)和81型(5/85,5.9%)等,其中42和81型检出率最高,未发现2种及以上低危型的混合感染。
二、两组患者一般资料及治疗情况比较
除HPV感染情况外,AID患者涉及的其它可能影响妊娠结局的重要因素有:女方年龄、不孕年限、不孕类型、治疗方案、实施周期数、平均优势卵泡数、授精次数、精液指标、子宫内膜情况等。经t检验及χ2检验,以上各参数在HPV阴性组及HPV阳性组间的差异均无统计学意义(P>0.05)(表1)。

表1 患者一般资料及治疗情况比较[(-±s),%]
三、两组患者AID妊娠结局比较
纳入研究的1 834个AID周期中,HPV阴性组患者实施周期数为1 650个,HPV阳性组患者实施周期数为184个,HPV阳性组临床妊娠率和总流产率略高于HPV阴性组,尚无显著性差异(P>0.05);按照流产时间进行细分后,HPV阳性组晚期流产率显著高于HPV阴性组(P<0.05),早期流产率及其它妊娠结局指标两组间比较均无显著性差异(P>0.05)(表2)。
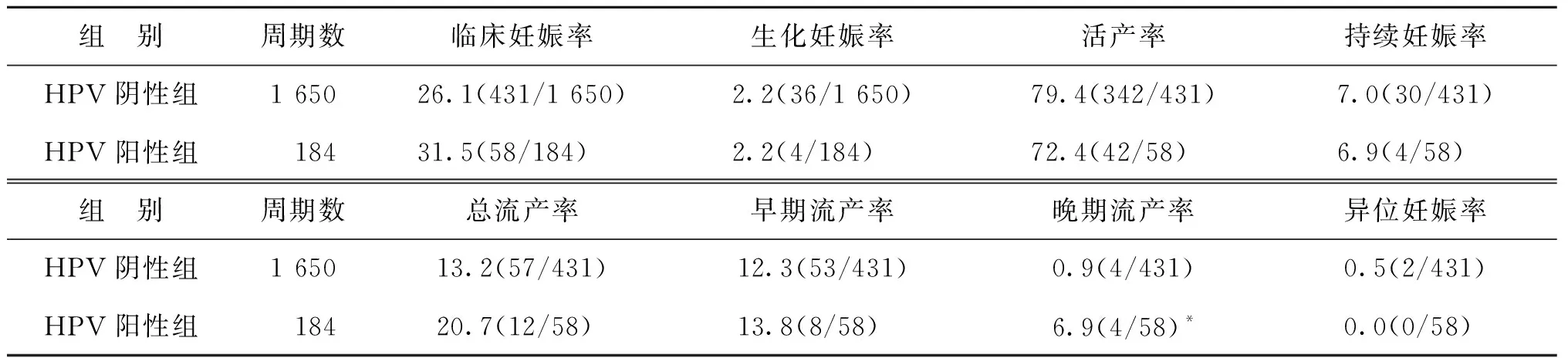
表2 两组患者妊娠结局比较(%)
讨 论
人类ART运用至今,已发展到胚胎植入前遗传学检测(PGT)乃至卵胞浆置换技术的阶段,但人工授精术以其操作简便、几乎无创、费用较低等优势,仍然是临床首选的一线助孕方案[6]。尤其是上世纪80年代末,人类精子库和AID技术应运而生,解决了不可逆性无精子症和严重染色体异常等问题患者的合法生育需求。目前人工授精的周期临床妊娠率一般在10%~20%之间,且受诸多因素影响[7-8]。研究已证实其主要影响因素有:女方年龄、不孕年限、治疗方案、排卵情况(优势卵泡数)、精子质量(活力、浓度)等[7-9]。此外,子宫内膜情况、授精时机及次数、病原体感染情况等作为临床妊娠率的潜在影响因素也有报道,但结论并不一致[10-12]。
目前纳入人工授精术前常规检查的病原体检查项目有解脲支原体、沙眼衣原体、优生十项(TORCH)、HBV、HCV、HIV、梅毒、淋球菌等。关于这些病原体对人工授精妊娠结局影响的研究报道较少。与之相比,HPV虽未被列入人工授精术前的必查项目,但其对人工授精、体外受精-胚胎移植(IVF-ET)的妊娠结局都有显著的不利影响。Depuydt等[13]通过对590名女性的1 529个夫精人工授精(AIH)周期的回顾性分析发现,HPV感染者的临床妊娠率约为未感染者的1/6(1.87% vs.11.36%,P=0.004 1);2019年,Depuydt等[14]又通过对877个AIH周期和485个AID周期的回顾性分析,再次确认HPV感染可导致人工授精临床妊娠率显著下降。Garolla等[15]亦研究发现HPV感染可明显降低人工授精与IVF-ET的活产率并增加流产率。一些系统评价与meta分析也得出相似结论[4-5,16]。更有临床研究显示,不论接受IVF-ET治疗的夫妇任何一方感染HPV,都可带来至少40%的流产率,而当双方同时感染HPV时,流产率可达100%[17]。
本研究中,接受AID治疗的824名女性中HPV的感染率为10.3%,与其他文献报道的结论[3]相似。具体分析,呈现出“高危为主、型别多样”的感染特点。高危型中,感染率最高的为16型,这也是临床最早发现、最常见、研究最多的HPV型别[1]。除16型外,另一较常见、报道较多的高危型18型在本研究患者中感染率较低,但是51、52、53、58等型别感染率较高,其原因还有待进一步的流行病学研究。低危型呈现出“感染率低、型别单一”的特点,未发现2种及以上低危型的混合感染。
从妊娠结局来看,HPV阳性组临床妊娠率略高于HPV阴性组,活产率及持续妊娠率略低于HPV阴性组,但均无显著性差异(P>0.05)。不良妊娠结局中,除异位妊娠率和生化妊娠率外,其余指标HPV阳性组均高于HPV阴性组,其中晚期流产率HPV阳性组显著高于HPV阴性组(6.9% vs.0.9%,P=0.007)。虽然本研究中两组研究对象的样本量相差较大可能会对研究结果产生一定影响,但对HPV感染之外的各项妊娠结局影响因素进行二分类统计检验,结果显示HPV阳性组与HPV阴性组间各项参数指标均在正常范围,差异也均无统计学意义(P>0.05)。因此之前提到的女方年龄、不孕年限、排卵情况等因素均未给HPV阳性组与HPV阴性组妊娠结局带来明显影响,对结果的统计分析影响亦较小。提示在忽略样本量及其它未知影响因素的情况下,女方HPV感染有降低活产率、增加流产率的风险,尤其是晚期流产率,继而影响AID妊娠结局。2006年Henneberg等[18]通过鼠胚实验证实,暴露在16及18型HPV DNA下的二细胞胚胎无法继续发育至囊胚,若从四细胞阶段开始暴露,虽有一部分胚胎可以继续发育,但大部分胚胎的发育仍受到阻滞。但本研究中除16、18型外,尚有51、52、58等多个高危型也具有较高的感染率,这些型别是否与AID术后流产存在明确的关联性,以及多型混合感染是否会进一步增加流产的风险,目前尚无相关文献报道,仍需进一步研究。此外,部分动物及人细胞水平的体外研究结果显示,HPV感染导致流产率增高可能与使用携带HPV的精子授精有关[2,4,15],但由于缺少体内研究结果,目前尚无统一结论。另一方面,这些体外的分子或细胞研究也无法阐明母体HPV感染作用于胎儿发育的具体阶段。虽然其具体机制尚待明确,但本研究结果至少提示有HPV感染及既往感染(尤其高危型)的女性在接受助孕治疗期间应定期关注HPV感染的进展、复发情况,通过人工授精获得临床妊娠后,应密切关注胎儿的发育情况。
综上所述,HPV感染具有“高危为主、型别多样”的特点,作为一个风险因素,可明显增加AID术后的晚期流产率。但其影响AID妊娠结局的具体机制仍需进一步深入研究。

