不同生态混凝土坡岸中溶解性有机质与镉的相互作用机理研究
梁明欣,寇莹莹,王京刚,何连生,张 琪,徐红灯,袁冬海*
1.北京化工大学化学工程学院,北京 100029 2.北京建筑大学,城市雨水系统与水环境教育部重点实验室,北京 102616 3.中国环境科学研究院,北京 100012 4.中铁十一局集团第五工程有限公司,重庆 400037
近年来,随着经济的快速发展和城镇化水平的不断提高,一方面城市不透水下垫面面积持续增加,导致城市径流雨水无法自然下渗,洪涝灾害频发;另一方面城市人口和机动车数量急剧增加,人类生产生活和汽车尾气排放致使大量有机污染物和重金属随着城市地表径流冲刷进入城市河道,破坏城市生态环境,影响城市居民生活[1]. 因此,基于此背景,开发以净化河道水质和改善河道生态环境为目标的现代生态护坡技术迫在眉睫. 传统人工护坡技术由于其表面完全被混凝土覆盖,其机械强度和抗冲刷性虽然较高,但是景观性和植物亲和性较差[2]. 近年生态混凝土护坡技术越来越多的被用于河道治理当中,生态混凝土作为一种特定的混凝土,与传统混凝土相比具有高孔隙率和大比表面积等优势,微生物能够获得更大的生存空间,进而能够有效去除污染物,更加符合“生态”理念[3]. 但是针对我国水体污染的现状以及人们生活水平的提高,生态混凝土护坡技术的水质净化能力仍然达不到我国地表径流净化的要求. 因此,基于AEC (applied eco-concrete, 应用型生态混凝土)护坡技术,研制具有高水质净化能力和植物亲和性的IEC (improved eco-concrete, 改良型生态混凝土)护坡技术更具现实意义,该试验选取工程普遍采用的AEC和课题组研制的以吸附材料为骨料的IEC(见表1)分别铺设坡岸[1].
DOM作为有机污染物的重要组成部分广泛存在于城市地表径流中,进而在水体自然循环中扮演着重要角色[4]. 由于DOM中包含各种官能团(如羧基、羰基、羟基、酯类等),这些官能团的存在使DOM能够与重金属发生络合,从而影响重金属的形态结构、迁移性及生物有效性[5-6]. 地表径流重金属污染程度较大,且呈现出较大的区域差异性. 其中Cd元素作为人体和动植物的非必需元素,道路Cd2+含量受汽车部件磨损、汽车尾气、燃油泄露等的影响[7],当浓度超标时,会严重危害动植物和人体的健康,污染城市地表径流. 受污染的地表径流流经生态混凝土坡岸进入城市河道,一方面造成河道内水体的污染,另一方面径流中的Cd元素会在生态混凝土中残存,影响城市生态. 因此,研究DOM和Cd2+的络合机理在生态混凝土坡岸中的变化显得尤为重要.
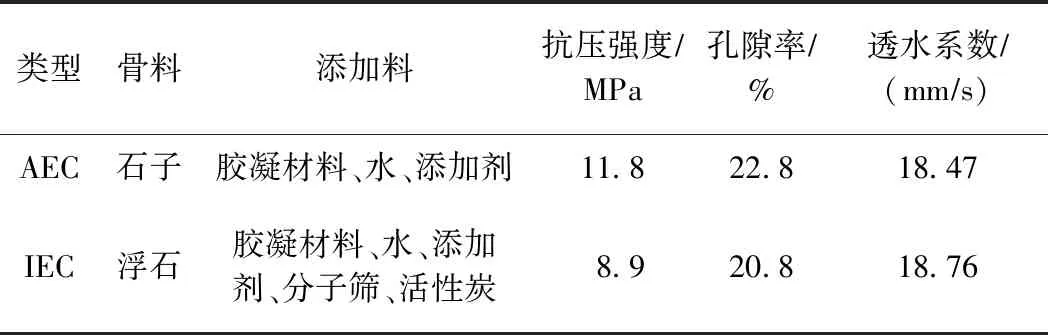
表1 AEC和IEC指标参数
该研究利用3D-EEMs (three-dimensional fluorescence spectroscopy, 三维荧光光谱)结合PARAFAC (parallel factor, 平行因子分析)深入分析两种生态混凝土坡岸中DOM在Cd2+影响下特征、组分和形态结构的变化,并联合2D-COS探究坡岸中DOM不同组分和Cd2+的络合机理,为了解生态混凝土坡岸中DOM与Cd2+相互作用提供科学依据.
1 材料与方法
1.1 水样的采集与配制
地表径流水样采集于北京市大兴区某路面. 选择4 L的矿泉水瓶作为取样瓶,用去离子水进行清洗;根据降雨时间,待地表产流后采集径流样品;采集样品迅速进行水质指标测定,结果见表2. 剩余水样放在冰箱中冷冻保存.
由于试验用水量较大,以采集样品水质指标为目标浓度进行水样配制,配制方案如表2所示. 试验水样由采集水样与配制水样按体积比为1∶9混合配制.
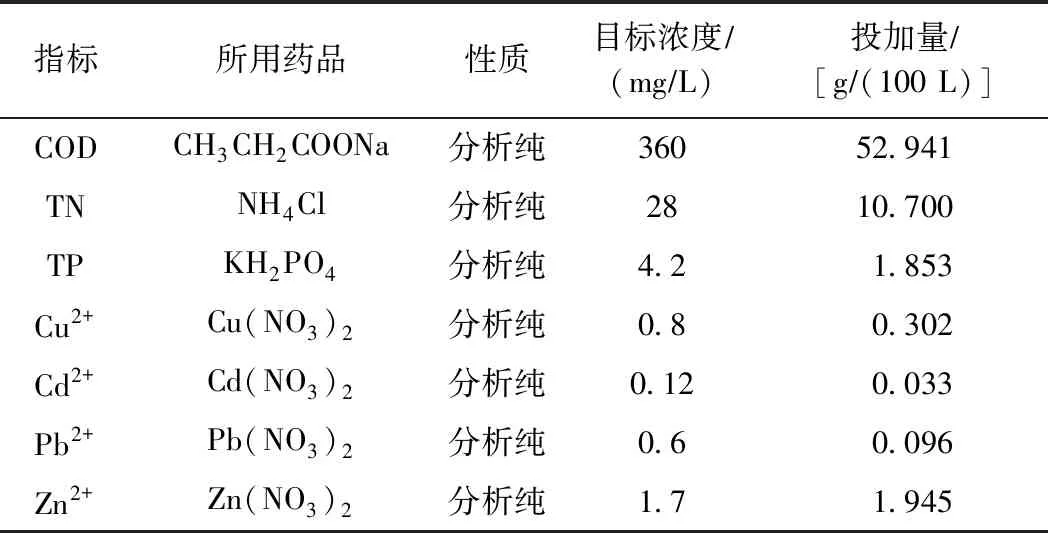
表2 水样配制方案
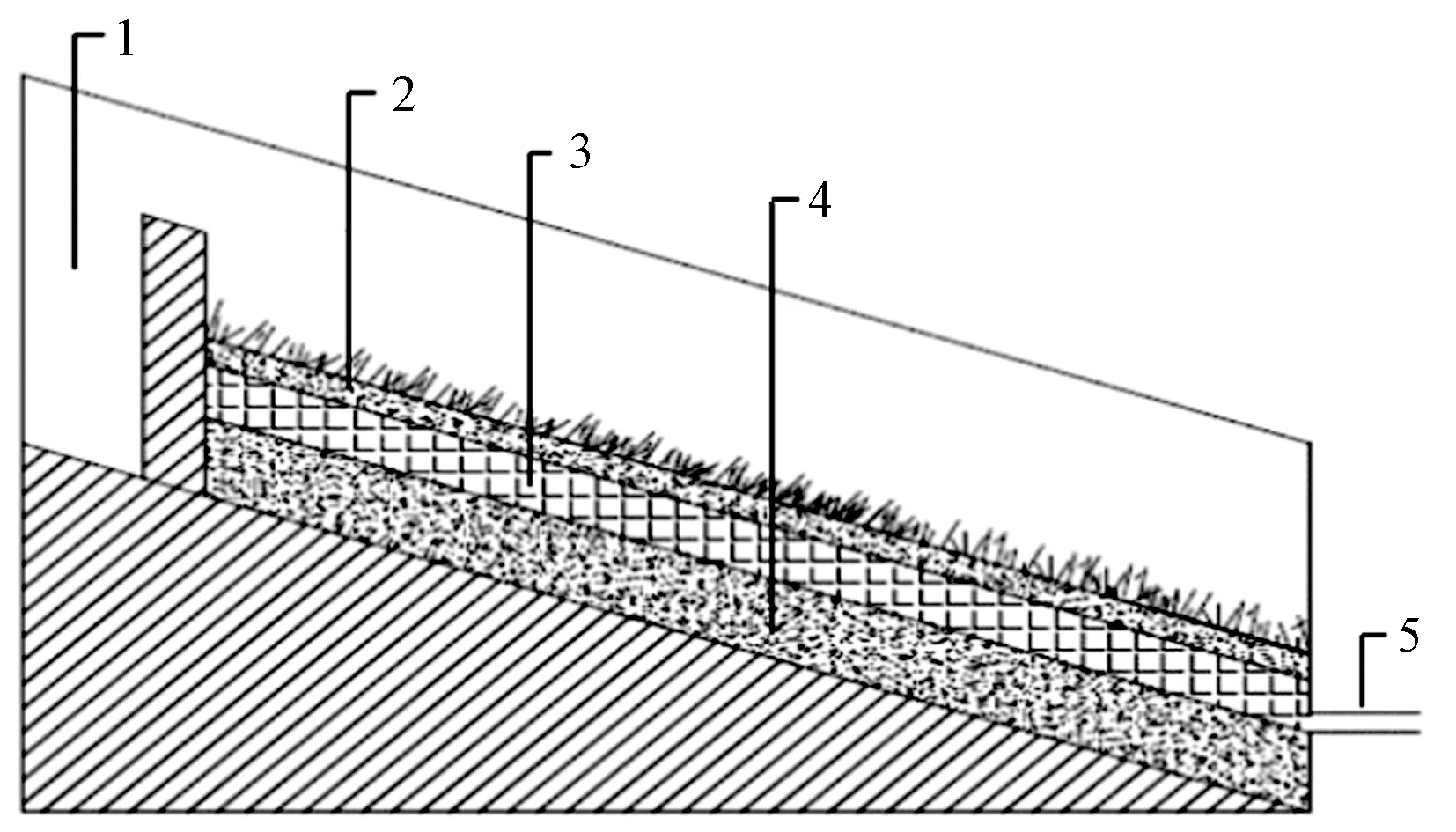
注:1—进水口; 2—表层土; 3—EC层; 4—种植土层; 5—出水口.图1 试验装置示意Fig.1 Schematic diagram of experimental device
1.2 试验装置
设计模拟城市河道坡岸装置(见图1). 装置长0.8 m、高0.9 m,坡度设定为25°. 生态混凝土坡岸结构包括3个部分,表层铺设2~4 cm的种植土;中间层为EC层,厚度设为12~15 cm,主要起到去除污染物和巩固坡岸的作用;底层为基层土壤,厚度设为12~15 cm,土壤可以为植物生长提供扎根空间,防止水土流失. 每组试验采用等量的水模拟河道坡岸冲刷,待出水口产流后进行水样收集,每批试验每组生态混凝土坡岸接3组水样,配制的进水水样记为RW,AEC出水水样记为AECow,IEC出水水样记为IECow,收集的水样过0.45 μm的玻璃纤维膜过滤,置于冰箱中4 ℃下冷藏用于FQT (fluorescence quenching titration, 荧光淬灭滴定)试验.
1.3 FQT试验设计
在滴定试验进行之前,为保证样品的可比性以及降低酸碱溶液对样品的影响,应将样品DOM浓度统一调至10 mg/L,同时将样品溶液pH调至7.5左右. 试验中Cd2+溶液的加入量不得超过样品总量的5%. 该研究Cd2+溶液浓度范围设定在0~200 μmol/L之间,样品中c(Cd2+)分别为0、10、20、40、60、90、120、160和200 μmol/L. 滴定后的样品于20 mL棕色瓶中,在恒温振荡箱内振荡24 h,保持温度25 ℃,待样品中DOM与Cd2+充分络合后取出进行三维荧光测定.
1.4 3D-EEMs测定方法
光谱采用F-7000荧光分光光度计(日本日立公司)扫描,PMT电压为700 V,光源为150 W的疝气灯,扫描范围λEx(激发波长)为200~450 nm、λEm(发射波长)为280~550 nm,扫描速率为 2 400 nm/min,扫描间隔为5 nm,响应时间为0.5 s. 同步荧光光谱扫描范围λEx为250~500 nm,在λEm为310 nm处,为了消除瑞利散射峰的影响,所有光谱使用前需减去超纯水空白光谱,样品均在室温下测定[8-9].
1.5 PARAFAC分析方法
由于使用传统的3D-EEMs难以将DOM样品中重叠的荧光峰分离出来,因此PARAFAC结合3D-EEMs 分析DOM样品已被广泛使用[10-11]. PARAFAC结合3D-EEMs不仅可以分离出荧光峰的种类,还可以确定荧光峰的强弱[12]. PARAFAC[13-16]是一种运用交替最小二乘数学计算方法的研究手段,该方法能够将多种组分分解成多种载荷矩阵. 城市地表径流中DOM样品的3D-EEMs数据组成一个三维线性组合i×j×k,其中i表示DOM样品数量,j表示发射光谱数目,k表示激发光谱数目. PARAFAC将三维的数组分解为一个得分矩阵和两个载荷矩阵,得分矩阵标记为A,两个载荷矩阵分别标记为B和C,其数学表达式:
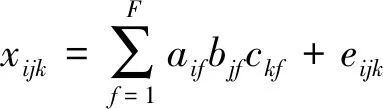
(i=1,2,…,m;j=1,2,…,n;k=1,2,…,w)
(1)
式中:F为荧光组分的总数目;f为某一个荧光组分;aif为第f个荧光组分在第i个样品中的荧光强度得分;bjf为第f个荧光组分的发射光谱负荷;ckf为第f个荧光组分的激发光谱负荷;eijk为残差,是模型未考虑的误差部分.
该研究PARAFAC分析使用MATLAB 7.0中的DOM-Flour来执行,并通过半分裂分析来验证模型结果的可靠性.
1.6 2D-COS分析方法
2D-COS可以反映外界环境扰动对光谱所产生的影响,也可以提供更多DOM和重金属络合的信息,包括同络合顺序和络合位点[17-18].
(3)
该研究使用二维Shige软件进行光谱分析,重金属离子的浓度作为外部扰动,同步相关光谱计算公式:
异步相关光谱计算公式:
1.7 非线性拟合模型
非线性拟合模型由Ryan and Weber提出经Plaza改进,通过络合模型计算出城市地表径流中DOM与Cd2+的络合常数 (lgK),从而评估DOM分子与Cd2+络合能力的大小[19-20]. 该模型基于DOM和Cd2+的络合位点依照1∶1进行络合. 络合模型的非线性拟合如式(5)所示.
(6)
式中:I为加入重金属后DOM的荧光强度,a.u.;I0为加入重金属前DOM的荧光强度,a.u.;IML为荧光强度稳定时,重金属离子的浓度阈值,mg/L;CL为重金属与DOM的络合容量,mg/L;KM为重金属与DOM的络合常数;CM为重金属的离子浓度,mg/L.
通过Origin 8.0软件导入公式,设计参数进行运行,最后计算得出该络合模型的络合常数.
2 结果与讨论
2.1 3D-EEMs组分分析
3D-EEMs可以方便直接地检测出DOM不同类型的荧光组分,通常λEx/λEm=200~250 nm/280~350 nm位置为类蛋白峰Peak B,λEx/λEm=250~280 nm/300~380 nm位置为类蛋白峰Peak D,λEx/λEm=240~290 nm/370~440 nm位置为类富里酸Peak A,而类腐殖质峰Peak C位于λEx/λEm=350~440 nm/430~510 nm处[15].
由图2~7可见,地表径流流经两种生态混凝土坡岸时,水体中DOM组分会发生不同程度的变化,其中AECow相对于RW:类蛋白峰Peak B RW(2 252 a.u.)→AECow(747.8 a.u.);类蛋白峰Peak D RW(2 492 a.u.)→AECow(1 256 a.u.);类富里酸峰Peak A RW(678.0 a.u.)→AECow(1 444 a.u.);类腐殖质峰Peak C RW(323.2 a.u.)→AECow(926.1 a.u.). 可见,经过AEC坡岸处理,类蛋白峰Peak B、Peak D荧光强度降低,其中Peak B的降低程度最大,而类富里酸峰Peak A和类腐殖质峰Peak C荧光强度升高,其中类腐殖质峰Peak C的升高程度最大. 这种现象可能是由于地表径流流经AEC坡岸时,由于孔隙中微生物活动的影响,水体的腐殖化程度升高[21]. IECow相对于RW:类蛋白峰Peak B RW(2 252 a.u.)→IECow(328.4 a.u.);类蛋白峰Peak D RW(2 492 a.u.)→IECow(2 492 a.u.);类富里酸峰Peak A RW(678.0 a.u.)→IECow(603.5 a.u.);类腐殖质峰Peak C RW(323.2 a.u.)→IECow(287.5 a.u.). 可见,经过IEC坡岸处理,类蛋白峰Peak B显著降低,类富里酸峰Peak A和类腐殖质峰Peak C出现不同程度降低,出现这种现象一方面是微生物活动的作用; 另一方面是由于IEC主骨料为吸附材料,其自身对污染物有一定的吸附净化能力.
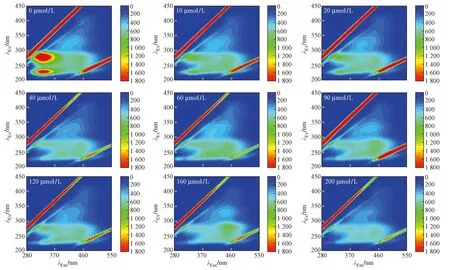
图2 RW样品不同c(Cd2+)荧光淬灭光谱Fig.2 Fluorescence quenching spectra of different concentrations of Cd2+ in RW samples

图3 RW样品中DOM组分荧光强度随c(Cd2+)的变化Fig.3 Fluorescence intensity of DOM component with Cd2+ concentration in RW samples
观察RW样品中DOM与Cd2+络合光谱图(见图2~3)可知,DOM中4种荧光组分均随c(Cd2+)增加而降低,最终趋于稳定. 当c(Cd2+)为200 μmol/L时,类蛋白峰Peak B、Peak D、Peak A、Peak C荧光强度分别削减80.16%、78.68%、16.89%、15.56%,其中类蛋白峰Peak B和Peak D降低明显,而类富里酸峰Peak A和类腐殖质峰Peak C的变化程度不大,表明类蛋白组分受Cd2+的荧光淬灭能力强于类腐殖质和类富里酸组分;类蛋白峰Peak B的荧光淬灭程度高于类蛋白峰Peak D,同时也说明peak B峰的类蛋白物质受Cd2+影响的淬灭能力强于Peak D峰的类蛋白物质[22-23],而类腐殖质峰Peak C荧光强度没有类富里酸峰Peak A降低明显,说明类腐殖质物质受Cd2+淬灭能力弱于类富里酸物质. 当c(Cd2+)为60 μmol/L时,Peak A和Peak C峰均出现短暂的上升,这可能是由于Cd2+的加入,使类富里酸和类腐殖质物质的一些发色基团出来,从而荧光强度升高,随c(Cd2+)的增大,该荧光峰很快被淬灭.
由图4~5可见,在AECow样品中,DOM各组分荧光强度随Cd2+投加同样表现淬灭现象,但类蛋白组分B、D随Cd2+的淬灭现象不如RW明显,反而类富里酸A和类腐殖质C表现较明显的淬灭现象,这是由于坡岸的处理,DOM中初始类蛋白组分荧光强度比RW低,而初始类富里酸和类腐殖质物质荧光强度高.
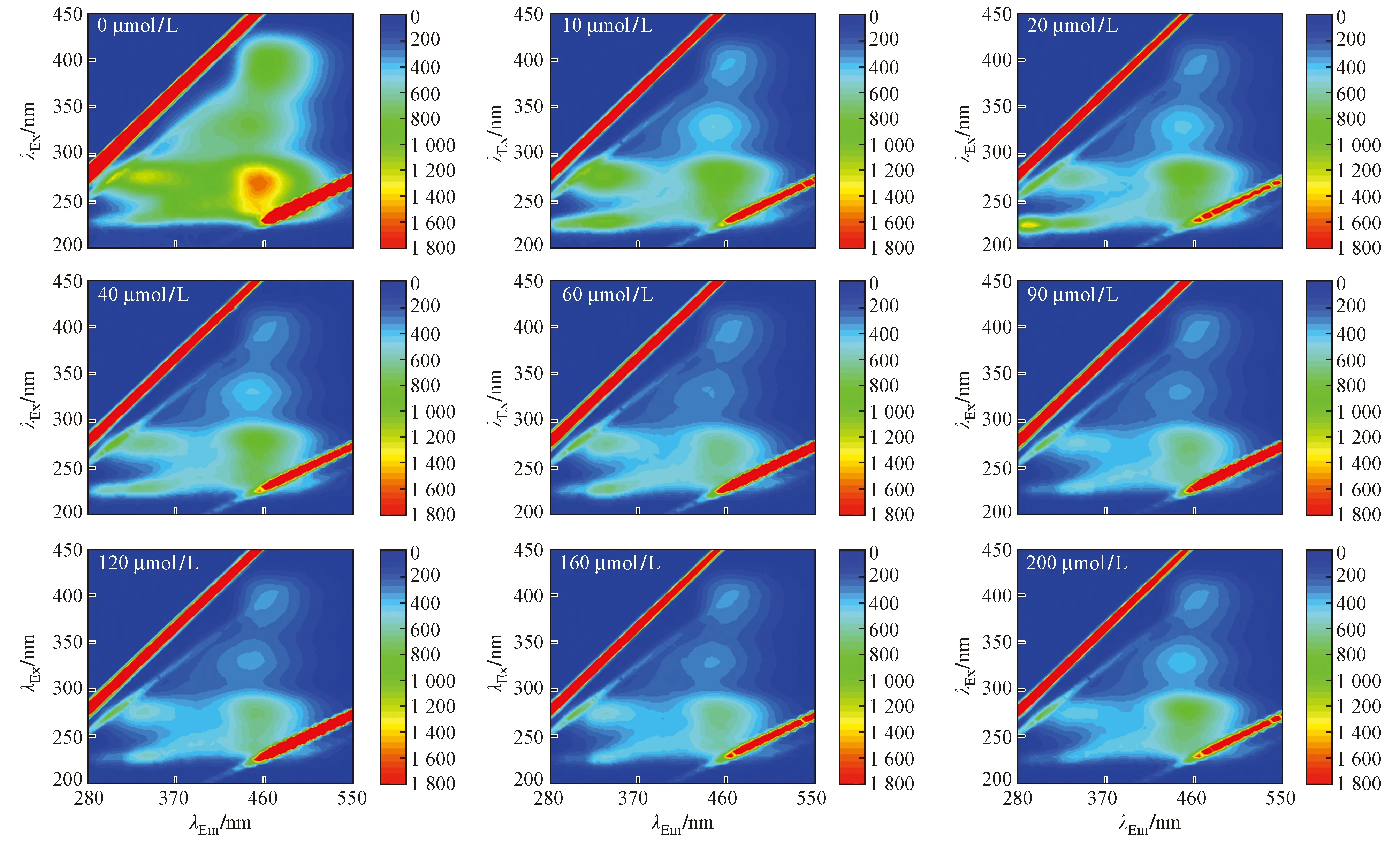
图4 AECow样品不同c(Cd2+)荧光淬灭光谱Fig.4 Fluorescence quenching spectra of different concentrations of Cd2+ in AECow samples
由图6~7可见,在IECow样品中,类蛋白组分D表现明显淬灭现象,其他组分变化不大,这可能是因为生态混凝土坡岸处理降低了各组分的初始浓度,导致淬灭现象表现不明显,随c(Cd2+)增加,中间某些峰荧光强度出现短暂的升高,但随c(Cd2+)继续增大,最终发生淬灭.
2.2 PARAFAC组分分析
该研究采用PARAFAC法来阐述3D-EEMs,可分离3D-EEMs中重叠的荧光组分. 如图8所示,所有样品均被分离为3个独立荧光组分. RW中C1组分存在两个荧光峰,其峰的位置与IECow中C1组分中荧光峰的位置相似,λEx最大值分别位于230和325 nm处,λEm最大值均位于400 nm处,参考已有研究[16-17],该组分与类富里酸物质有关. RW和IECow中C2组分同样显示出两个荧光峰(λEx/λEm=225 nm/330 nm和275 nm/330 nm处),该峰被定义为类蛋白物质中的类色氨酸,反映了生物可利用的有机质的存在[24-25]. RW中C3组分属于类腐殖酸物质,其产生的两个荧光峰与IECow中C3组分中的两个荧光峰类似,均位于λEx/λEm=270 nm/470 nm和380 nm/470 nm处[26],但两组分都发生红移,反映出两组分中DOM的结构和官能团种类、数量存在相应的变化[27-28]. AECow中C1组分与RW中C3组分类似,同样属于类腐殖酸物质. AECow中C2组分产生的两个荧光峰位置分别位于λEx/λEm=240 nm/450 nm和325 nm/450 nm处,该组分与RW中C1组分类似,属于类富里酸物质. AECow中C3组分与RW中C2组分类似,属于类蛋白物质.
2.3 DOM不同组分与Cd2+的相互作用
由于PARAFAC分析将DOM分离成3个独立组分,可以更清晰地研究各个组分与Cd2+的相互作用. 如图9所示,当c(Cd2+)为0 μmol/L时,两种坡岸出水,类蛋白组分荧光强度RW(2 351.1 a.u.)>IECow(833.4 a.u.)>AECow(743.3 a.u.),类腐殖酸组分荧光强度AECow(684.9 a.u.)>RW(556.0 a.u.)>IECow(364.4 a.u.),而类富里酸组分荧光强度AECow(562.4 a.u.)>RW(553.3 a.u.)>IECow(502.0 a.u.),可见PARAFAC分析结果证实了3D-EEMs结论,即城市地表径流流经AEC坡岸,蛋白质物质减少,而水体腐殖化程度增加,流经IEC坡岸,DOM中3种组分均降低.
如图9所示,Cd2+与3个组分均会发生络合,从而对各个组分的荧光强度产生不同程度的淬灭. AECow中C2组分和IECow中C3组分与Cd2+呈现出微弱的淬灭效应,而RW中C1组分、AECow中C2组分以及IECow中C1组分则显示出较明显的淬灭效果,表明类富里酸物质与水体中Cd2+的络合反应更强烈,对其迁移性和生物有效性影响更大[29-30]. 其次,RW和AECow中的C1组分以及IECow中的C2组分荧光强度在低Cd2+浓度下会突然增加,而后随着c(Cd2+)升高而逐渐降低,这是因为低浓度的Cd2+刺激DOM中一些发色团,使其荧光强度瞬间增高,之后随着c(Cd2+)的增加,络合反应越来越充分,其荧光强度逐渐降低[31-32]. 对于RW中C2组分,其荧光强度在后期随着c(Cd2+)增加而升高,这可能是由于高浓度Cd2+加入导致蛋白质分子的三维结构发生改变,从而引起蛋白质荧光量子产率发生变化[33].
运用非线性拟合模型阐述DOM组分与Cd2+的淬灭过程,来进一步说明DOM不同组分与Cd2+结合能力的强弱. 表3列出了络合常数lgK值. Cd2+与RW中C3组分、AECow中的C1组分以及IECow中的C3组分未能得出lgK值,而这3个组分均属于类腐殖酸,这说明在1∶1的络合模型下,Cd2+与类腐殖酸组分不能模拟出lgK值[34]. 通过Ryan and Weber模型模拟结果发现,所有样品中,Cd2+与类富里酸组分的lgK值均大于类蛋白物质,因此Cd2+与类富里酸组分的络合能力强于类蛋白物质. LU等[35]研究表明:Cd(Ⅱ)与DOM羧基发生络合作用,类蛋白组分中存在大量酚羟基官能团和少量的羧基官能团;而类富里酸组分中含有大量的羧基官能团和少量的酚羟基官能团,即Cd2+与类富里酸组分的络合能力较强. 其次,Cd2+与类富里酸组分能够模拟出较好的lgK值,RW中C1组分、AECow中C2组分和IECow中C1组分与Cd2+的lgK值分别为3.83、3.77和3.64(RW>AECow>IECow),表明Cd2+与RW中类富里酸物质之间的络合能力强于AECow和IECow. Cd2+与类蛋白物质同样得出较好的lgK值,分别为3.06、2.50和1.50(RW>AECow>IECow). 不难发现,生态混凝土坡岸处理能够降低城市地表径流中DOM组分与Cd2+的络合能力,降低了下游生态系统中Cd2+在水生态系统中的迁移性及生物有效性,这与崔骏等[36-38]研究结果相似.
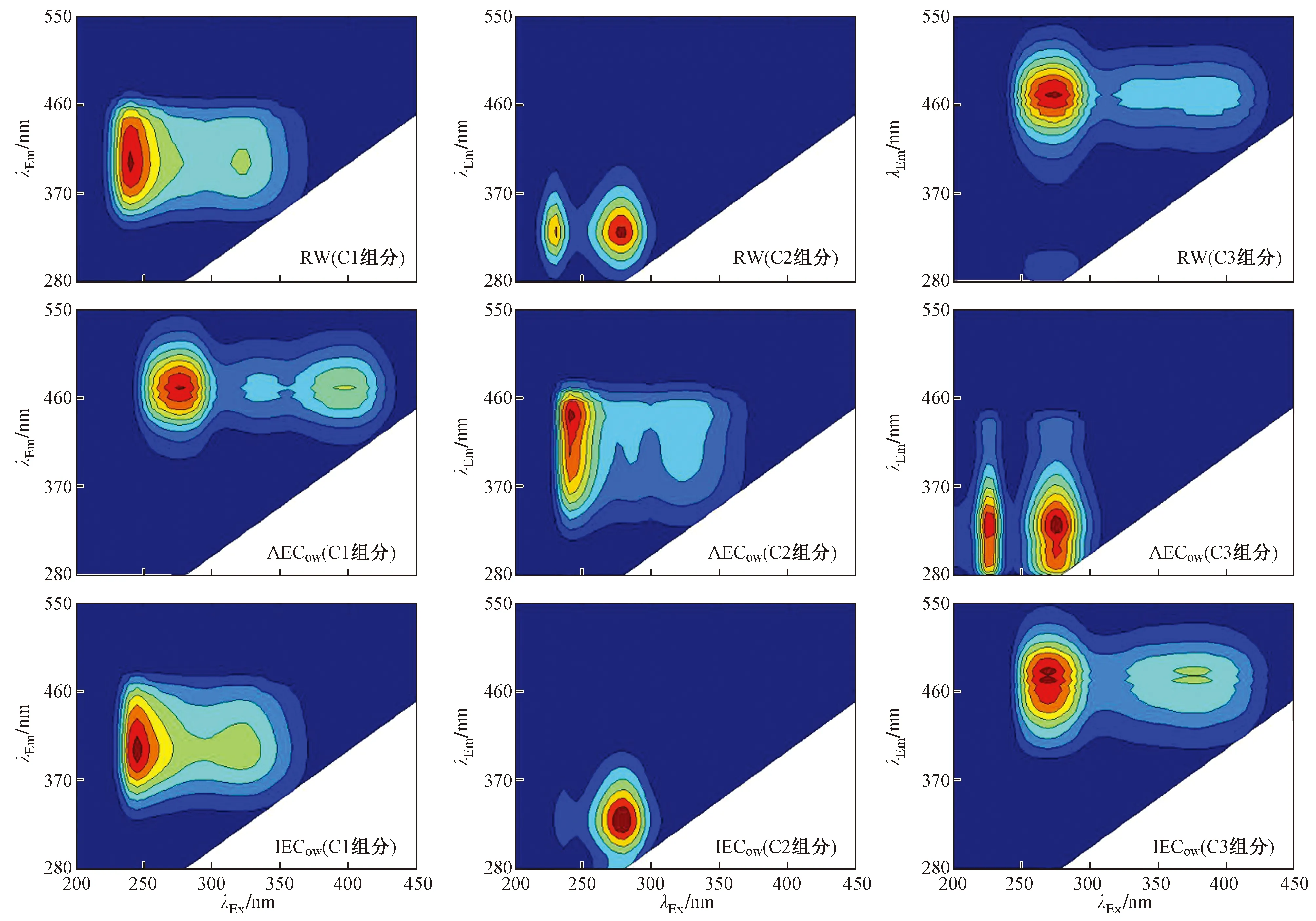
图8 PARAFAC分析组分图Fig.8 The diagram of PARAFAC analysis component
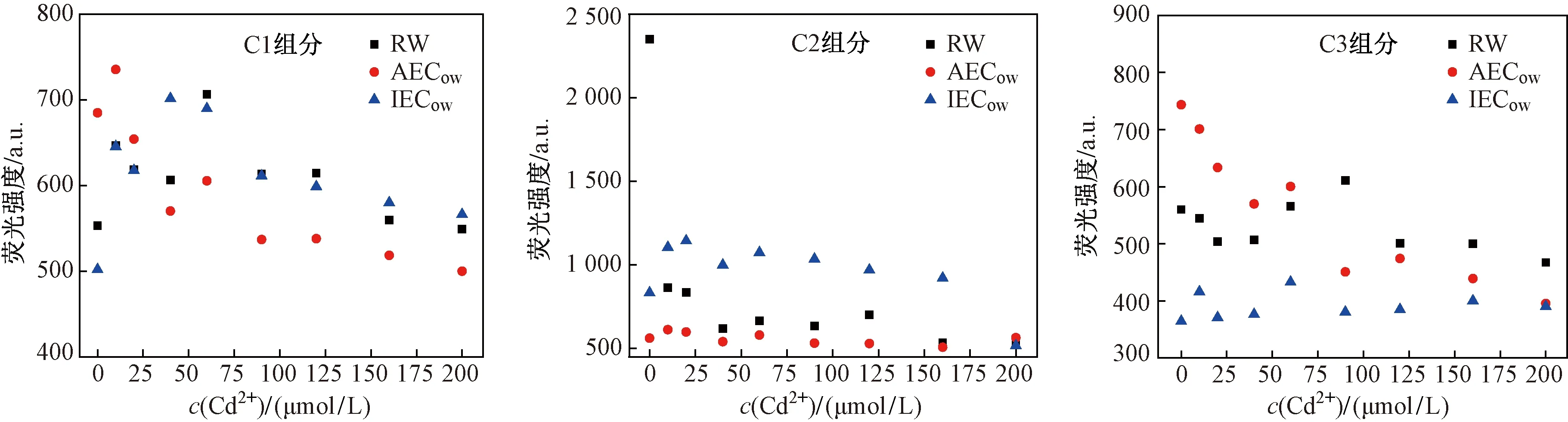
图9 基于PARAFAC的荧光组分强度随c(Cd2+)的变化Fig.9 Fluorescence component intensity variation with Cd2+ concentration based on PARAFAC analysis
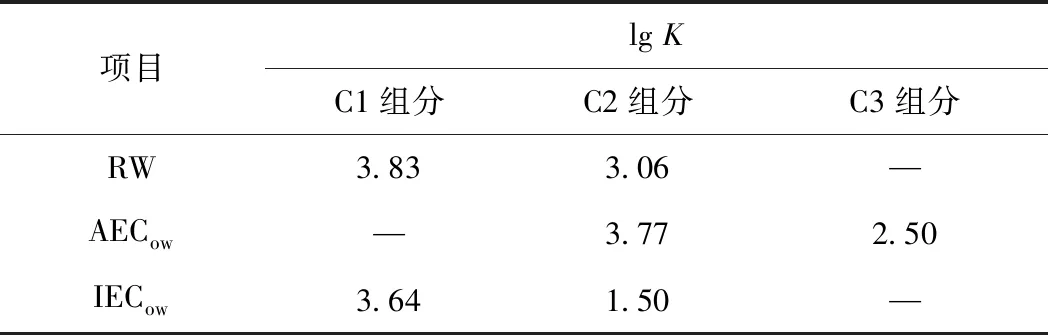
表3 Cd2+与DOM不同组分的络合常数lg K
2.4 DOM不同组分与Cd2+络合信息
2D-COS与PARAFAC相比,其能够提供更多有关DOM与重金属络合的信息,包括络合位点和络合顺序等. 该研究以c(Cd2+)变化为干扰因素,探析Cd2+与DOM的络合位点和络合顺序在不同类型生态混凝土坡岸中的的变化.
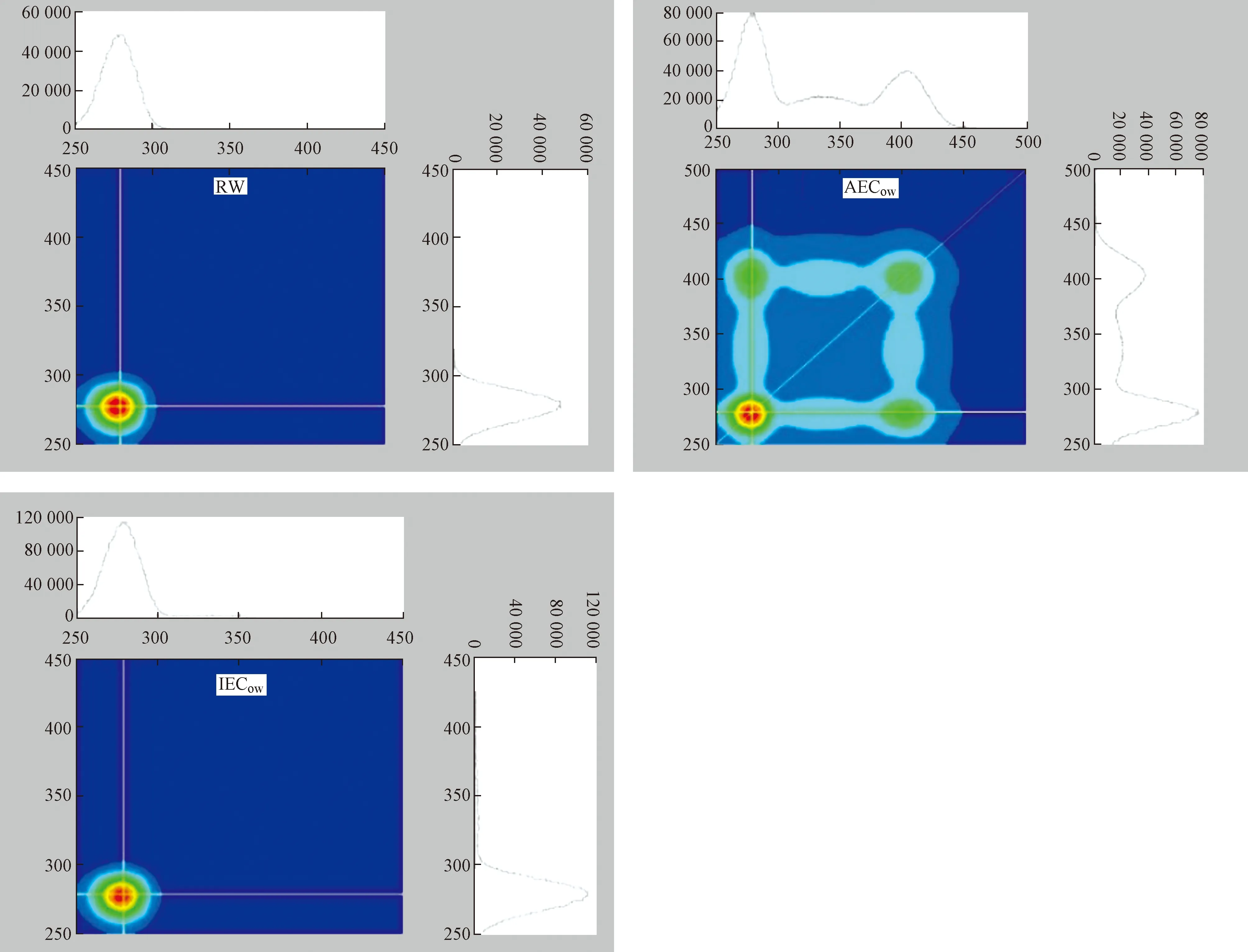
图10 不同样品(RW、AECow、IECow)与Cd2+络合的2D-COS同步光谱Fig.10 2D-COS synchronous spectra of different samples (RW, AECow, IECow) compounded with Cd2+
2D-COS包括两种光谱图,即同步和异步光谱图. 2D-COS同步光谱图关于对角线对称,其含有两种类型的峰,峰中心位置位于对角线区域的为自发峰,位于非对角线区域的为交叉峰[39]. 自发峰或交叉峰表示相应光谱区域对由于外部扰动引起的光谱强度变化的敏感性[40]. 如图10所示,RW拥有一个自发峰,位于275 nm处;AECow拥有两个自发峰,分别位于275、400 nm处,各处峰值大小依次为275 nm(80 000 a.u.)>400 nm(40 000 a.u.);IECow拥有一个自发峰,位于275 nm处. 275 nm处的自发峰是由于类蛋白物质与Cd2+络合,不同区域对应峰值越高表示其对Cd2+的敏感度越大,所以在RW、AECow、IECow中类蛋白物质对Cd2+的敏感度最大.
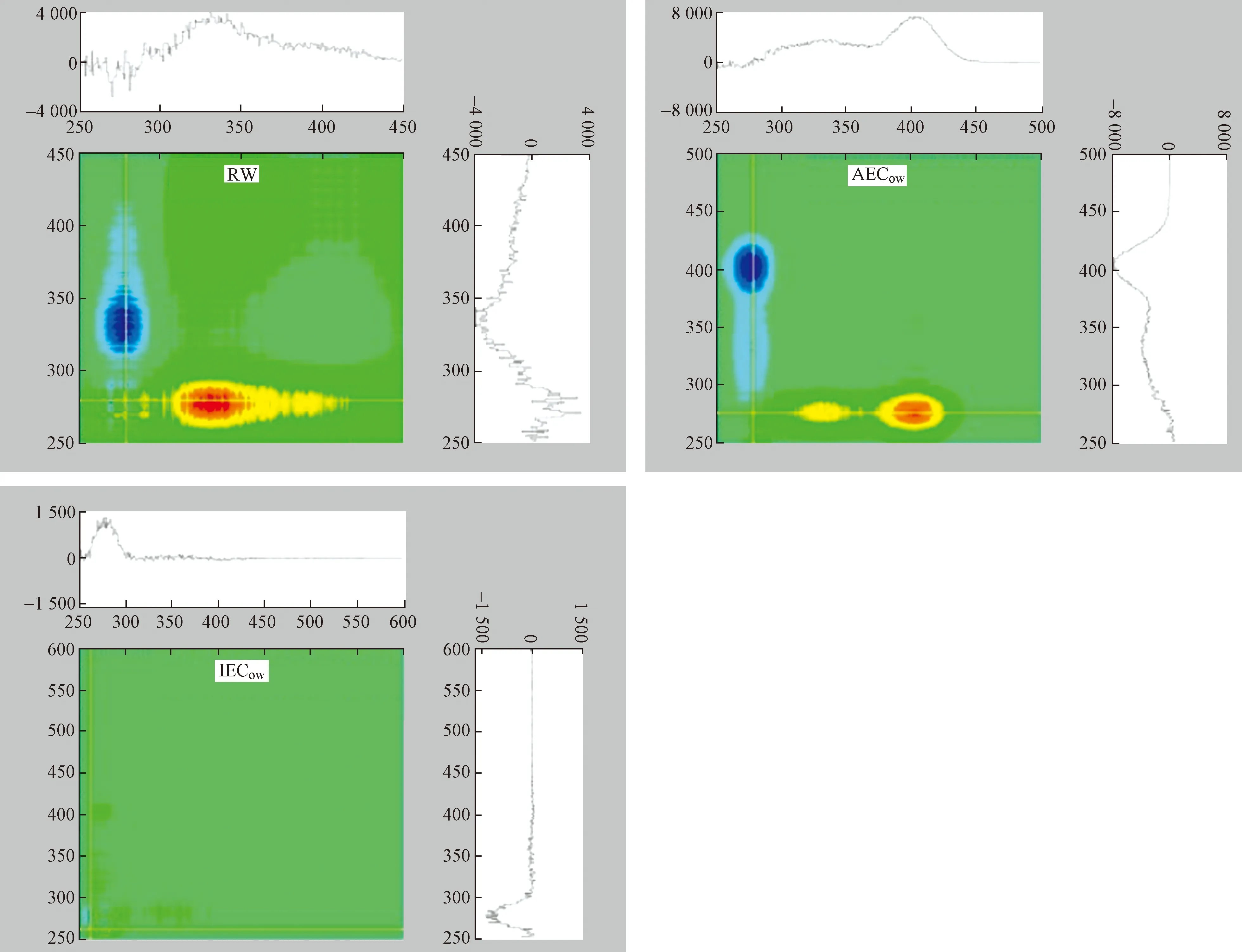
图11 不同样品(RW、AECow、IECow)与Cd2+络合的2D-COS异步光谱Fig.11 2D-COS asynchronous spectra of different samples (RW, AECow, IECow) compounded with Cd2+
2D-COS异步光谱图同样关于对角线对称,但是拥有正、负两种交叉峰. 2D-COS异步光谱图可以反映Cd2+与DOM的络合位点及络合顺序[41]. 如图11所示:RW在对角线的下方拥有两个峰,分别为一个正交叉峰(340 nm)和两个负交叉峰(273、282 nm),各处峰值大小依次为340 nm(3 700 a.u.)>273 nm(2 500 a.u.)>282 nm (2 000 a.u.),根据Noda规则[42],峰值越大代表Cd2+与该波长处的DOM组分优先络合,其络合顺序为340 nm→273 nm→282 nm;340 nm波长处代表微生物类腐殖质物质,273、282 nm波长处代表类蛋白物质,这表明Cd2+优先与微生物类腐殖质发生络合,其次再与类蛋白物质发生络合. 对于AECow,可以在330 nm和410 nm处发现两个正交叉峰,各处峰值大小为410 nm(6 000 a.u.)>330 nm(3 000 a.u.),根据Noda规则,其络合顺序为410 nm→330 nm;410 nm处的荧光物质代表类富里酸物质,330 nm处的荧光物质则代表微生物类腐殖质,说明在AEC坡岸中Cd2+率先与类富里酸物质发生络合反应. IECow在对角线下只发现一个微弱的正交叉峰,位于275 nm处. 综上,两种类型的生态混凝土坡岸能够对DOM与Cd2+的络合点位和络合顺序产生影响,出水中Cd2+优先与类富里酸物质络合,其次与类腐殖质物质络合,最后才与类蛋白物质络合.
2.5 环境意义
DOM是一种广泛分布于自然水体中的具有高度异质性并且带有多种活性官能基团的混合物[39,43]. 其不仅是自然界中碳循环的重要组成部分,同时影响着自然水体中污染物的环境行为,如污染物的分布、迁移转化、生物有效性以及毒性等[44-45]. 而重金属是一类不能降解的污染物,一旦被水生动植物吸收,就会在食物链中由低级向高级转移,从而对水环境人类的健康存在潜在的威胁[46-47]. 而DOM的存在恰好可以影响重金属的环境行为. 该研究发现,存在Cd2+情况下,DOM中类富里酸、类腐殖质物质优先与其络合,且络合能力强,类蛋白物质对Cd2+的敏感度最大,受其影响淬灭效果最明显. 城市地表径流经过AEC坡岸处理,水体腐殖化程度增加,类蛋白物质降低,因此AEC坡岸出水可增加下游Cd2+在水生态系统中的迁移风险和生物毒性. 经过IEC坡岸处理,水体DOM各组分均降低,这表明,相比AEC坡岸,IEC坡岸能够更好地降低Cd2+的迁移性和生物毒性,从而减少对水环境和人类健康造成影响. 因此,该研究能够为深入了解水体中不同污染物的分布、迁移转化、生物有效性等环境化学行为提供理论基础和科学依据.
3 结论
a) 3D-EEMs结果显示:地表径流流经AEC坡岸,DOM中类蛋白峰降低,类富里酸、类腐殖质峰升高;流经IEC坡岸,DOM中类蛋白峰、类富里酸峰、类腐殖质峰均降低. Cd2+与DOM中所有组分均能络合,其中Cd2+与类蛋白组分的淬灭现象最明显,随着c(Cd2+)增加,各组分的荧光强度趋于稳定,说明各组分与Cd2+络合达到平衡.
b) PARAFAC结果显示,所有样品均被分离成类蛋白、类腐殖酸及类富里酸3个独立组分. 进一步证实,地表径流流经AEC坡岸,蛋白质物质减少,而水体腐殖化程度增加,流经IEC坡岸,DOM中3种组分均降低. 随c(Cd2+)的增加,类富里酸组分表现稳定的淬灭效果.
c) Ryan and Weber模型分析结果表明,水体中Cd2+与DOM中类富里酸物质的络合能力强于类蛋白质. RW中Cd2+与DOM组分的络合能力强于AECow和IECow,表明城市地表径流经过两种生态混凝土坡岸,水体中DOM与Cd2+的络合能力降低.
d) 2D-COS相关光谱分析结果表明,DOM中类蛋白物质对Cd2+的敏感度最大,淬灭现象最明显. 水体中Cd2+优先与DOM中类富里酸物质络合,其次与类腐殖质物质络合,最后才与类蛋白物质络合.

