AT1R及MCP-1基因多态性与脑梗死患者预后的相关性分析
常 升 王 铭 奚 志 白宏英 杨霄鹏△
1)郑州市惠济区人民医院,河南 郑州 450053 2)郑州大学第二附属医院,河南 郑州 450003
老年人易患多种脑血管疾病,随着中国人口老龄化的增加,发病率逐渐增加,尤其是脑梗死(CI),发病率和病死率高。缺血性脑梗死的发作主要归因于一系列血液循环障碍,导致脑缺血性坏死或脑组织软化。一旦发生缺血性脑梗死,如未及时有效的治疗,会迅速发展并造成严重后果[1-2]。CI是神经内科常见的急危重病症,是因颅脑局部血循环障碍引起,通常发病突然,病情危重,变化快,有着较高病死率和致残率。脑梗死的病因涉及高血压、糖尿病、高脂血症、血管炎、动脉粥样硬化和遗传因素等。多种因素研究表明[3],CI的病理生理变化较复杂,遗传因素有着重要作用和影响。当前,临床研究的CI有关候选基因已达到数十种。近年来,研究发现AT1R、MCP-1基因多态性会影响到血浆水平[4],认为此种异常表达和缺血性心脑血管病有着密切关系。
血管紧张素Ⅱ(Ang Ⅱ)对心血管和肾脏系统的病理生理至关重要[5]。过量会引起炎症/氧化反应、高血压、内皮功能障碍和血管重塑;各种研究表明,血管紧张素受体1亚型(AT1R)起介导的作用。AT1R基因表达的增加有助于高血压和其他相关心脑血管异常的发作[6]。趋化因子在选择性募集单核细胞,嗜中性粒细胞和淋巴细胞以及通过激活G蛋白偶联受体诱导趋化性中起主要作用[7]。单核细胞趋化蛋白-1(MCP-1/CCL2)是调节单核细胞/巨噬细胞迁移和浸润的关键趋化因子之一[8]。MCP-1除了被认为是将单核细胞和巨噬细胞吸引到炎症位点的有效介体外,还通过血脑屏障介导炎症细胞的跨内皮迁移,并通过在体内形成趋化梯度来调节局部炎症反应[9]。
但关于两者和CI预后的相关性的研究报道还不多。本文应用PCR-RFLP技术测定AT1R及MCP-1基因多态性,并系统剖析与患者预后的相关性。
1 资料与方法
1.1一般资料以郑州市惠济区人民医院神经内科2018-01—2019-10收治的145例CI患者作为研究对象,均经临床症状、轮脑影像学等检查确诊,符合CI的相关诊断标准[10]。临床表现主要是头痛、失语、偏瘫、嘴角歪斜等。纳入标准:(1)均为首发性缺血性CI,在发病后6 h内送院诊治;(2)入院时GCS评分>8分,NIHSS评分<15分;(3)患者及家属对研究知情并同意;(4)无用药禁忌证。排除合并冠心病、肝肾功能不全、恶性肿瘤、凝血机制障碍、颅脑外伤及不接受随访等患者。其中男83例,女62例;年龄52~68(58.6±3.4)岁;发病到入院5~26(9.2±1.4) h。本研究得到医院伦理委员会批准,且研究流程符合相关规范标准。
1.2方法
1.2.1 临床治疗:本组患者在确诊后均给予专科对症治疗,包括行颅压、抗血凝、吸氧、溶栓、改善侧支循环、营养脑神经等;同时,遵医嘱给用依达拉奉(南京先声东元制药有限公司,批准文号:国药准字H20031342)30 mg+0.9%氯化钠溶液150 mL,静注,30 min完成,2次/d,连续用药14 d[11-12]。
1.2.2 基因多态性检测:所有患者接受6个月随访,在末次随访抽取空腹12 h以上晨起外周肘静脉血5 mL保存于EDTA抗凝血管待检,通过低渗法将白细胞予以分离,再采用氯仿/异戊醇法完成DNA提取,待进行基因检测。(1)AT1R A1166C,应用PCR-RFLP技术检测,对于基因引物设计则参照相关文献[13],上游引物:5'-ATAATGTAAGCTCATCCACC-3',下游引物:5'-GAGATTGCATT TCTGTCAGT-3',PCR扩增反应相关条件:于94 ℃下预变性2 min,94 ℃变性30 s,退火57 ℃ 45 s,72 ℃ 60 s,经过33个循环周期之后于72 ℃下延伸5 min,置于4 ℃恒温下予以保存。加入5 U内切酶DdeI以及酶切缓冲液,置于37 ℃水中浴12 h酶切反应,应用2.5%琼脂糖凝胶电泳,予以溴化乙锭染色,再置于紫外灯下进行基因型的鉴定:如2个等位基因上均含内切酶识别位点,且在酶切后产生210 bp、140 bp的片段,则定为CC型;如在酶切之后产生350 bp、210 bp及p140 b的片段,则定义成AC;如不含概酶切位点,仅有350 bp片段,那么定义成AA型。(2)MCP-1 2518基因型。根据MCP-1 全DNA序列,以及有关文献设计引物[13],上游引物:5'-TCTCTCACGCCAGCACTGACC-3',下游引物:5'-GAGTGTTCACATAGGCTTCTG-3'。PCR扩增反应条件:于95 ℃预变性5 min,再转变成95 ℃变性40 s,退火至0 ℃ 30 s,然后72 ℃延伸40 s,经过30个循环周期之后,再于72 ℃延伸5 min。将扩增产物置于自动凝胶成像系统中观察扩增情况,以确定PCR产物是所需目的片段(234 bp),再对目的片段实施限制性酶切:①基本条件:PvuⅡ内切酶1 μL,PCR产物10 μL,去离子水7 μL,缓冲液2 μL,混合均匀后置于37 ℃水中水浴过夜;②基因分型:用2 μL上样缓冲液溴酚蓝与5 μL酶切产物混合均匀后,应用微量吸管把混合液加至凝胶槽孔内;③电泳,经凝胶成像系统观察确定基因型,仅显示234 bp片段为AA型,显示234 bp、159 bp及75 bp片段为GA型,显示159 bp、75 bp片段为GG型。
1.3评价标准在随访6个月后,应用mRs量表评价患者预后,0~6分,无症状为0分;虽有症状,但无显著残障;轻度残障3分;重度残障4分,严重残障为5分,6分为死亡。如评分≤1分为预后良好,>1分为预后不良。
1.4统计学处理将本课题研究资料统一录入Excel进行整理,并应用SPSS 12.0 软件包完成统计学分析,基因型、等位基因的频率用%表示,行χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1预后情况本组145例患者出院后均接受6个月随访,无失访病例,通过mRs评分,预后良好90例,占62.07%,预后不良55例,占37.93%。
2.2预后良好和预后不良组AT1R基因多态性对比通过对AT1R A1166C基因检测(图1),预后良好组患者AA、AC基因型频率及C等位基因频率分别为86.67%、23.33%、5.56%,分别低于预后不良组的45.45%、54.55%及24.55%,差异有统计学意义(P<0.05)。见表1。
2.3预后良好和预后不良组MCP-1基因多态性对比通过对MCP-1 2518G/A基因检测(图2),预后良好组的GG基因型频率为27.78%、G等位基因频率为43.33%,分别低于预后不良组的36.36%、54.55%(P<0.05)。见表2。
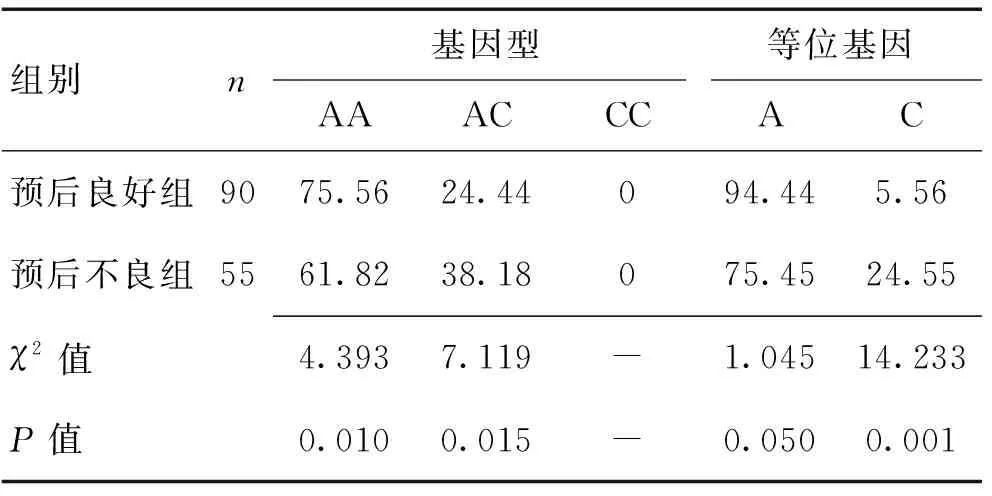
表1 预后良好和不良患者的AT1R基因多态性比较 (%)Table 1 Comparison of AT1R gene polymorphism betweenpatients with good and poor prognosis (%)
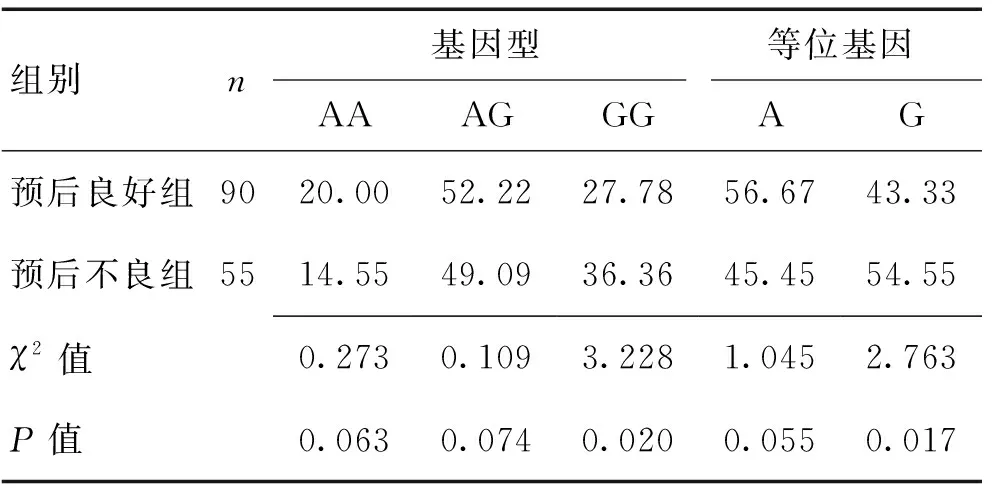
表2 预后良好和不良患者的MCP-1基因多态性比较 (%)Table 2 Comparison of MCP-1 gene polymorphism betweenpatients with good and poor prognosis (%)
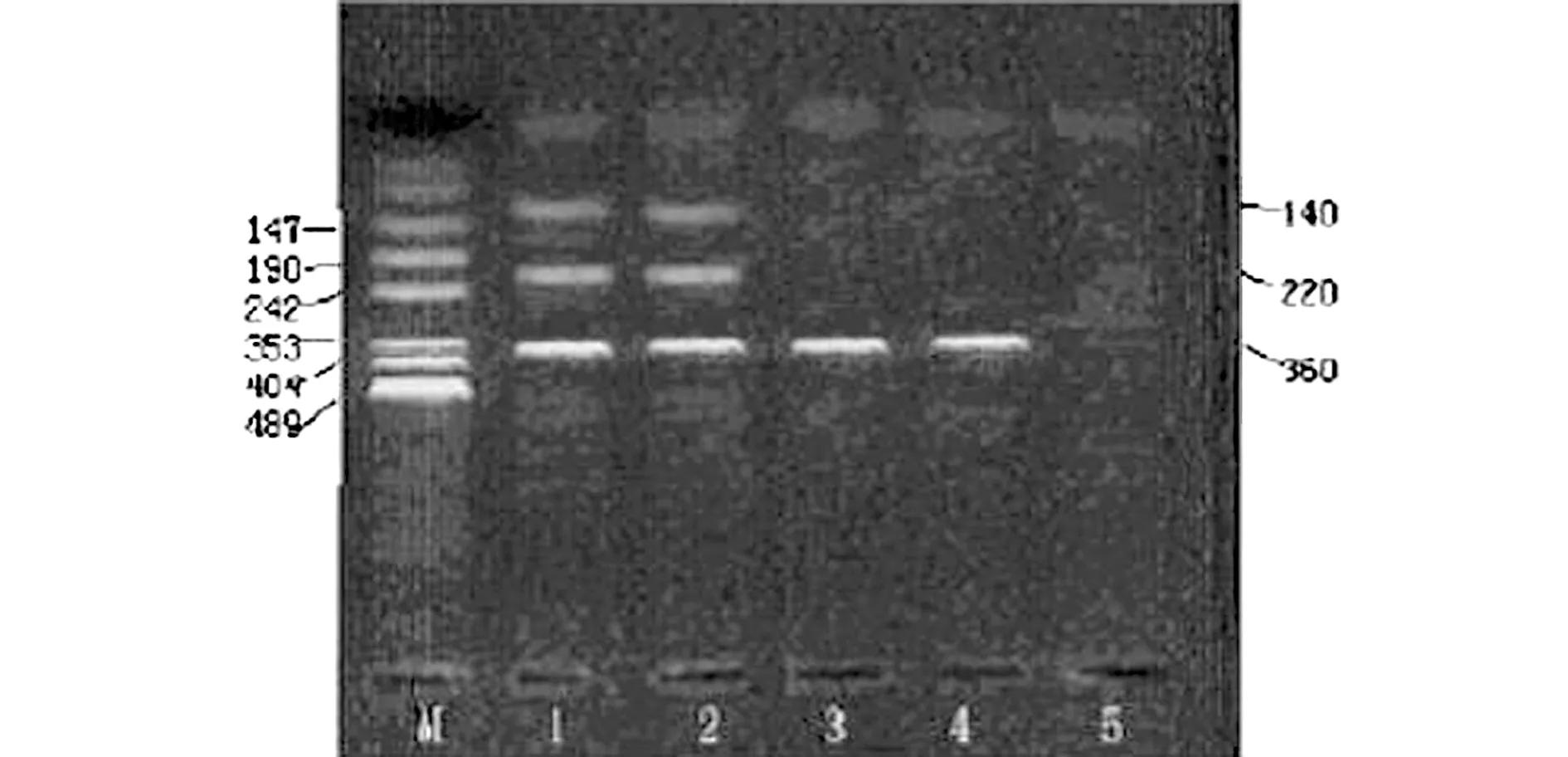
图1 AT1R PCR扩增产物内切酶酶切后琼脂糖凝胶电泳Figure 1 Agarose gel electrophoresis of AT1R PCR amplified products after endonuclease digestion

图2 MCP-1 2518G/A的PCR产物酶切电泳图Figure 2 PCR products of MCP-1 2518G/A digested by endonuclease and then electrophoretic
3 讨论
近年来,随着现代分子生物学在临床研究中应用开来,及遗传学技术、流行病学试验等研究方法的应用,CI遗传学的研究不断深入。当前,用于分析人的基因突变和CI发生及预后的遗传流行病学研究主要是关联分析法,针对群体病例进行对比研究。人类基因组内的遗传多态性大多数表现出重复序列和普遍性单核苷酸多态性(SNP)。所谓SNP就是在基因组内特定核苷酸所在位置存在的2种不同碱基置换,一般仅为1种二等位基因或二态遗传变异,可通过自动化实现批量化检测,与此同时,因在基因组中SNP的数量极大,分布密而有着很高的稳定性,能够为临床提供丰富、多样的基因遗传变异信息,所以,将其作为新一代的基因遗传标记。伴随人类基因组计划的不断完善,学界日益重视基因组SNP,其可充分反应出不同群体、个体间的基因遗传差异,并基于特定SNP研发和选用敏感药物,以实现高度个体化的治疗和干预,实现理想的治疗效果和预后。
AT1R是一种G蛋白偶联受体,主要存在于血管平滑肌、心脏等组织内,在被血管紧张素II(Ang II)激活之后的效应主要在于平衡机体血压与水电解质,机体持续性高血压状态会导致心脑血管形态学与生理功能发生改变[14],如左室重塑、血管形态改变、内皮功能损害等。ATlR基因则位于人3号染色体长臂21~25区,A1166C则位于3’未翻译区57端,A突变成C会出现这三种基因型:一是未突变纯合子AA型;二是突变杂合子AC型;三是突变纯合子CC型。此位点的突变不会导致其编码氨基酸序列以及生理功能发生变化,但是可能会参与到基因的转录、翻译的调控中,进而影响到AT1R对于Ang Ⅱ亲和力改变。研究表明[15],AT1R基本介导Ang Ⅱ所有临床效应,会导致脑动脉、微动脉收缩效应,促进儿茶酚胺释放,引发血管平滑肌细胞过度肥厚或增生,减小血管腔/壁比值,影响CI病情的改善。本研究中,对AT1R多态性与CI预后相关性开展研究,结果显示CI预后良好患者的ATlR AA、AC基因型以及C等位基因的频率整体高于预后不良患者(P<0.05)。由此表明,ATlR AA、AC基因型和CI预后有密切关系,与相关课题研究结论基本一致。
MCP-1会导致单核细胞与巨噬细胞的胞浆内游离Ca2+水平增高,表达粘附分子,释放溶酶体酶以及超氧阴离子、组织因子以及促炎细胞因子,致单核/巨噬细胞激活和聚集,而加重血管腔内的脂质积累,促使动脉血管内膜组织细胞增生,加快动脉斑块生长,引发CI,不利于病情改善。临床上对MCP-1基因进行了诸多研究,但对其2518G/A多态性和动脉粥样硬化、CI、心梗等缺血性心脑血管病变的预后间的相关性机制尚未完全明确。国外学者SKALNIAK 等[16]人研究发现,MCP-1 2518G/A多态性血浆脂蛋白a(LP(a))的机体含量存在相关性。研究发现[17],MCP-1 2518GG 基因型人群的LP(a)含量、患心脑血管病变的几率均显著高于MCP-1 2518AA基因型人群。高脂蛋白(a)血症是动脉粥样硬化、CI发生的主要危险因素。高脂蛋白(a)血症和MCP-1 2518 GG基因型可能是通过提高MCP-1表达水平,增加白细胞聚集,进而增加动脉粥样硬化损伤的危险性[18]。但有学者认为,也可能是通过促进脂质过氧化来导致动脉粥样硬化损伤。研究认为[15-16],MCP-1 2518G/A多态性可能通过影响MCP-1基因的转录、翻译表达,来参与调控病症发生发展中的炎性反应,最终对病症的发生、发展、转归产生影响。有些刺激因素效用会诱导产生MCP-1的量表现出显著的个体性差异,而MCP-1基因-2518G/A多态性会对此转录启动区域的活性产生影响,并和单核细胞MCP-1的产量个体差异表现出一致性。临床研究发现MCP-1 2518G/A多态性和血浆内的MCP-1水平表现出一定相关性,MCP-1 2518位点基因型为含G(GG,GA)者的血浆内MCP-1的整体水平要高于AA基因型者[19-20]。本研究显示预后良好和预后不良患者相比,CI患者的MCP-1 2518位点有着较高的G等位基因携带频率(GG,GA),表明MCP-1 2518G等位基因可能是影响CI转归和预后的重要因素。由此推测,人体MCP-1基因2518G/A多态性和CI预后存在一定关系。
AT1R位点A1166C及MCP-1基因位点-2518多态性与CI的预后可能存在相关性,这为探索CI的治疗和康复方案、方法的制定提供新的方向和思路。但是因本研究样本量有限,使得某些基因型频率整体较少,再加上缺乏区域性对比,会影响到结论的完整性和可靠性,因而,应加大样本量,选取多区域病例进一步深入研究,以便充实和完善本课题的结论。

