Hippo信号通路在糖尿病及并发症中的作用研究进展
朱兴文 鲁一兵
Hippo信号通路参与维持细胞极性及器官的正常生长,调控细胞及器官的多种生物功能[1]。糖尿病患者存在β细胞分泌下降和胰岛素抵抗,长期的高血糖造成肾小管上皮细胞增殖异常、视网膜血管内皮细胞损伤、心肌细胞凋亡、下肢血管血流减少或闭塞等微血管和大血管并发症。目前的研究表明Hippo信号通路通过多种途径参与糖尿病以及糖尿病并发症的发生发展,现将Hippo信号通路在糖尿病中的研究进展做一综述。
1 Hippo信号通路
Justice等[2]于1995年首次报道Warts可以调控黑腹果蝇的细胞形态以及增殖,其后Harvey等[1]相继发现一条主要由Hippo激酶,Warts激酶以及下游转录调节因子Yorkie等组成的保守的Hippo-Yorkie激酶级联通路。在哺乳动物中,Hippo信号通路主要包括Ste-20样激酶(MST1/2),大肿瘤抑制因子(LATS1/2),以及Yes相关蛋白(YAP)和具有PDZ结合域的转录共活化因子(TAZ)等。其中YAP/TAZ是Hippo信号通路下游的关键分子,二者具有WW域、卷曲螺旋域、SH3结合域、TEAD转录因子结合域等共同的结构域并且功能上部分重叠。YAP/TAZ自身缺乏DNA结合域,需要与TEA结构域1-4(TEAD1-4)形成异二聚体,结合于远端增强子或近端启动子区域,从而调控靶基因的转录[3]。
Hippo通路激活状态下,上游调节因子Merlin等首先促进丝氨酸/苏氨酸激酶MST1/2发生磷酸化,进而激活下游LATS1/2,活化的 LATS1/2可使YAP/TAZ丝氨酸残基 (Ser89-TAZ;Ser127-YAP)磷酸化,磷酸化的YAP/TAZ与 14-3-3蛋白结合、滞留在细胞质中并最终降解,无法进入细胞核发挥转录调控作用。在细胞间连接减少、遭受机械张力以及可溶性因子等刺激的条件下,Hippo通路被抑制,下游效应分子YAP/TAZ被激活,表现为蛋白磷酸化水平降低、稳定性增加、核内聚集增多、YAP/TAZ调控的相关基因(如Ctgf等)的表达增多[4]。Hippo通路的激活与抑制,与细胞周期调节因子CycE、癌基因Myc,以及 Wnt,EGFR等信号通路相互作用,进而影响细胞生长、增殖、存活等[4,5]。
2 Hippo信号通路与糖尿病
糖尿病是以慢性高血糖为特征的代谢性疾病,其发病率逐年递增。据统计,2017年全球糖尿病患者约4.51亿,国际糖尿病联盟(IDF)预测至2045年,糖尿病患者数量将达6.93亿[6]。目前的研究认为糖尿病的发病机制主要包括胰岛β细胞的破坏造成的胰岛素绝对缺乏(1型糖尿病),以及胰岛素抵抗伴随进行性胰岛素分泌不足(2型糖尿病)。持续的高血糖状态除了引起机体代谢紊乱,还影响眼、心脏、肾脏、神经等器官及组织的正常功能[7]。
2.1 Hippo信号通路与胰岛β细胞损伤 胰岛β细胞产生和分泌的胰岛素经由血循环作用于不同组织。研究表明Hippo信号通路在调控胰腺β细胞分化以及存活过程中起着不同的作用。Rosado-Olivieri等发现下调Yap可以促进胰腺内分泌祖细胞的分化以及干细胞来源的产胰岛素β细胞的产生,从而增加胰岛素的分泌。相反,持续的活化YAP会导致产胰岛素β细胞分化异常、胰岛素分泌减少[8]。提示Hippo通路的激活对于维持β细胞的正常分化以及胰岛素的分泌。另外,现有研究也表明Hippo通路参与调控β细胞的存活:Deng等[9]发现,棕榈酸处理β细胞可诱导细胞凋亡,同时YAP1被激活,下游靶基因Ctgf的表达也上调;在细胞系中过表达Yap1则可以抑制棕榈酸诱导的β细胞的凋亡,可见在凋亡发生过程中,YAP激活起到保护作用。此外,Ardestani等还发现在糖尿病模型的β细胞中,MST1明显活化,参与诱导β细胞的凋亡,并且MST1可通过促进胰十二指肠同源框因子-1(PDX-1)的蛋白酶体降解,直接影响胰岛素的分泌[10]。这些结果表明,Hippo信号通路的活化参与β细胞凋亡的发生,而抑制Hippo通路促进细胞存活,维持胰岛素分泌。
因此,Hippo通路对于β细胞的调控具有时空差异性,其激活维持β细胞的早期分化以及生理功能,促进胰岛素的分泌;相反,抑制Hippo信号通路、激活下游的YAP,则可以通过减少β细胞凋亡来维持胰岛素的产生和分泌。
2.2 Hippo信号通路与胰岛素抵抗 胰岛素抵抗是2型糖尿病的主要病理生理学特征,表现为肝脏、脂肪组织、肌肉组织等靶器官及组织对胰岛素的敏感性下降。现有研究认为脂质超载(脂肪细胞增大,血浆游离脂肪酸水平增加)以及炎症细胞(巨噬细胞)和炎症信号分子共同参与胰岛素抵抗的发生。在不同的靶器官或组织内,Hippo信号通路通过不同的机制参与胰岛素抵抗的发生。
2.2.1 脂肪组织胰岛素抵抗:研究表明近80%的2型糖尿病患者超重或者肥胖,过多的脂肪组织堆积以及功能紊乱会造成机体脂质超载,并引起持续低水平的慢性炎症,从而导致胰岛素抵抗的发生[11]。多项研究证实Hippo信号通路参与促进脂肪组织形成:Kamura等[12]报道,Hippo信号通路的效应因子Taz下调可活化过氧化物酶体增殖物激活受体γ(PPARγ),进而参与调控脂肪形成。而Li等[13]在研究利拉鲁肽(Liraglutide)对前脂肪细胞作用时,发现在前脂肪细胞分化为脂肪细胞过程中Hippo信号通路被激活,YAP磷酸化增加,并且YAP靶基因的表达明显降低,可见Hippo信号通路的激活参与调控脂肪细胞的分化成熟。而通过使Mst1基因沉默抑制Hippo信号通路,可以抵消利拉鲁肽促进脂肪形成的作用,这些结果表明活化的Hippo通路可以通过促进脂肪细胞成熟,进而促进脂肪的生成[13]。
以往的研究证实,脂肪组织的慢性炎症,尤其是巨噬细胞浸润可通过分泌炎性因子参与胰岛素抵抗的形成[14],而在脂肪组织内,Hippo信号通路是否可调控巨噬细胞等炎症细胞的功能还不明确。现有的研究表明巨噬细胞内特异性敲除Pdk1基因(编码丙酮酸脱氢酶激酶-1)可促进胰岛素抵抗[15]。而其他研究发现下调Pdk1可以通过抑制Yap-1进而下调胰岛素受体底物2 (Irs2)的表达[16]。因此,在巨噬细胞内,PDK1可能通过YAP-1调控胰岛素受体的表达,从而参与胰岛素抵抗的发生,其中明确的机制以及Hippo信号通路是否通过其他途径参与调控脂肪组织的慢性炎症,还需要更深入的研究。
2.2.2 肝脏及骨骼肌胰岛素抵抗:肝内的脂质堆积以及高糖微环境促进胰岛素抵抗的发生。有研究表明肝内高糖的微环境参与调控Hippo信号通路:Liu等[17]在研究肝脏肿瘤形成时发现高糖可以上调Yap的表达,另外高糖还可以促进血管抑素结合蛋白(AMOT:YAP的交互作用因子)的表达及糖基化修饰,进而增加YAP的核内聚集及靶基因的转录,由此可见,在糖尿病状态下,肝脏内的高糖环境可能通过调节Hippo信号通路进而调节肝细胞的功能。在研究肝性脂肪变性的过程中,研究发现在高糖高脂饮食诱导的糖尿病小鼠中,YAP蛋白表达上调并且去磷酸化,由此促进了YAP蛋白的核内聚集以及活化;通过表达Lats1促进YAP磷酸化及降解,则加重糖尿病小鼠的胰岛素抵抗以及肝性脂肪变性。这些研究提示在高糖高脂状态下,Hippo信号通路激活促进疾病的进展,而Hippo信号通路的抑制则可能具有保护作用,延缓胰岛素抵抗及脂肪变性的发生。此外,该项研究还发现YAP在脂肪酸合成酶(FAS)以及30-羟甲基戊二酰辅酶A还原酶(HMGCR)的启动子上,直接与固醇调节蛋白元件结合蛋白(SREBP-1c及SREBP-2)相互作用,调节他们的转录,进而促进脂肪生成,导致肝细胞内的脂质堆积,加重胰岛素抵抗[18]。由此可见,Hippo信号通路通过调控肝细胞在糖尿病状态下的功能及脂肪的形成参与胰岛素抵抗的发生,通过抑制Hippo通路可减少脂质堆积,延缓疾病进程。
骨骼肌组织因其体积大、胰岛素刺激的葡萄糖转运率高,在胰岛素抵抗的发生发展中起到重要作用。现有研究认为游离脂肪酸在骨骼肌组织内的堆积造成线粒体损伤,并阻断胰岛素信号通路,还可通过葡萄糖转运体4(GLUT4)减少葡萄糖转运。Hwang等[19]发现,在肌肉组织中,TAZ上调Irs1表达,并促进GLUT4调节的葡萄糖摄取,肌肉组织特异性的敲除Taz明显下调Irs1的表达,并降低组织对胰岛素的敏感性。研究还发现TAZ与癌基因C-Jun及TEAD4相互作用,诱导Irs1的转录。可见Hippo信号通路不仅参与调控GLUT4的功能,影响葡萄糖的利用,还通过与其他信号通路的相互作用,在转录水平参与胰岛素信号通路的调控,进而参与胰岛素抵抗的发生。
3 Hippo信号通路与糖尿病并发症
糖尿病肾病(DN)患者临床表现为微量蛋白尿以及肾功能异常,是导致终末期肾病的重要原因之一。Ma等[20]发现在DN患者的肾小球足细胞中,YAP、TEAD 及CTGF都在核内高表达;并且YAP的高表达和患者收缩压、血尿素氮和血肌酐水平的升高,以及血清白蛋白和肾小球滤过率 (eGFR) 的下降相关。提示Hippo信号通路可能参与调控糖尿病状态下的肾功能。在细胞层面:Huang等[21]发现,敲低足细胞内Ras同源基因家族成员A(RhoA)可抑制核内YAP的表达,而Yap的过表达逆转RhoA敲低诱导的足细胞的凋亡,可见YAP的活化促进足细胞的存活。而在糖尿病小鼠肾脏近端小管上皮细胞中,Chen等[22]发现YAP的表达上调,并且 EGFR-PI3K-AKT-CREB信号通路的激活参与调节Yap基因的表达、核内定位以及与TEAD的相互作用;通过敲低Yap表达,还可以抑制高糖以及内源性EGF对小管细胞增殖的促进作用 。可见Hippo通路可通过调控高糖微环境下小管细胞的增殖进而参与DN的发生,而激活Hippo通路可能改善小管细胞参与的病理改变。这些研究表明在糖尿病肾病的发病过程中,Hippo通路在多细胞水平参与肾脏病理生理的调控,进而影响肾功能。
糖尿病并发的心血管病变主要为动脉粥样硬化以及微血管病变造成的糖尿病心肌病,该病主要表现为心脏微血管内皮细胞损伤以及心肌细胞的功能紊乱,可诱发心力衰竭以及心律失常,甚至心脏性猝死[23]。Hu等[24]研究发现在糖尿病心肌病发病过程中,内皮细胞特异性的Mst1转基因小鼠心功能恶化并且胰岛素抵抗加重。而敲除内皮细胞的Mst1对糖尿病小鼠的心功能起到保护作用。此外,该研究还发现,上调Mst1的表达促进高糖诱导的心肌细胞的凋亡,并通过影响Daxx与GLUT4的相互作用,阻止GLUT4的跨膜定位,抑制了糖尿病状态下葡萄糖的摄取[24]。这项研究不仅证实了Hippo通路的重要成员MST1参与调控糖尿病环境心肌细胞的凋亡,也指出MST1对葡萄糖转运及后续的利用的负性调控,从而调节糖尿病心肌病的代谢。
糖尿病视网膜病变是糖尿病另一严重的并发症[25],Hao等[26]发现在链脲霉素诱导的糖尿病大鼠模型中,视网膜组织的TAZ以及上游Hippo信号通路的LATS、下游转录共活化因子TEAD的表达都上调。通过中药血栓通治疗糖尿病时,视网膜网织层MST磷酸化水平下降,并且光感受器层磷酸化的YAP表达下调。由此可见,Hippo信号通路尤其是活化的YAP/TAZ参与了糖尿病视网膜病变的发生[26]。在研究叶酸是否对高血糖状态下视网膜血管内皮细胞起到保护作用时,Wang等[27]发现叶酸显著抑制了高糖诱导的内皮细胞的增殖、迁移以及管腔形成。他们还发现在视网膜血管内皮细胞中,高糖培养使Tead1的mRNA及蛋白水平上调,同时YAP1的蛋白水平以及磷酸化水平也上调;而在叶酸处理后,Tead1的mRNA水平以及TEAD1、YAP1的蛋白水平明显下降。这些发现表明叶酸可以通过调控Hippo信号通路保护视网膜血管内皮细胞的正常功能,减轻高糖诱导的损伤,进而缓解糖尿病造成的视网膜病变[27]。
糖尿病的高糖状态会造成微循环障碍以及神经损伤,导致糖尿病足以及伤口愈合延迟等病变在糖尿病创面愈合延迟的研究中,Yu等[28]发现高糖培养的真皮成纤维细胞与正常培养状态相比,胶原收缩能力下降并且出现线粒体功能紊乱。并且在2型糖尿病模型小鼠的真皮成纤维细胞中,Yap的mRNA水平明显下调。而在研究富血小板血浆(PRP)对于慢性创面的治疗时,Guo等[29]发现在糖尿病小鼠模型的慢性创面中,PRP来源的外泌体可以有效地诱导内皮细胞以及成纤维细胞的的增殖和迁移,从而促进慢性创面的血管生成和上皮再生;此外他们还发现PRP外泌体依赖的成纤维细胞的增殖和迁移依赖于YAP的活化。
Hippo信号通路参与糖尿病的发生发展,通过调控胰岛素生成、分泌以及不同组织胰岛素抵抗等参与糖尿病的发生,并在不同细胞及组织层面参与糖尿病并发症的发展(图1)。虽然已经取得一些研究进展,但是目前对于Hippo通路在糖尿病中作用机制的认识还不够完善。首先,Hippo通路是否调控炎症细胞参与的胰岛素抵抗等问题,还亟需深入的研究。其次,糖尿病的并发症是糖尿病的干预治疗不可忽视的重要部分,Hippo通路在糖尿病神经系统病变、皮肤病变以及口腔病变等并发症中的调控机制还有待发现及完善。最后,针对Hippo通路的小分子药物还需要更多的实验室以及临床试验,从而实现临床转化。综上,对Hippo通路在糖尿病中调控机制的阐明,有助于糖尿病以及并发症的预防及临床治疗,为患者提供新的治疗途径。
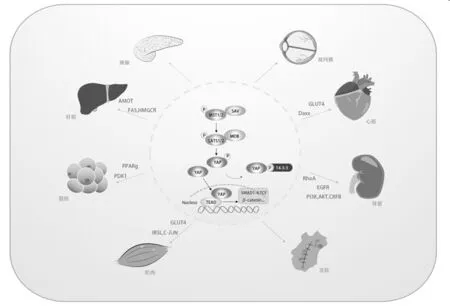
图1 Hippo信号通路参与调控糖尿病状态下多种器官及组织的稳态

