小剂量阿司匹林对子痫前期高危孕妇预防作用的分子机制
孙红霞,蔡娱飞,马 哲,袁 捷,张立梅,杨 贺,马奎丽,沈营营
(1.北华大学药学院,吉林 吉林 132013;2.北华大学附属医院,吉林 吉林 132011)
子痫严重威胁孕妇和胎儿的健康,妊娠期高血压疾病(简称妊高症,HDP)是孕妇最常见的并发症之一.2015年统计表明:HDP在我国发病率为9%~10%,其中20%左右的HDP可发展为子痫,占妊娠所致死亡的10%~16%,是导致产妇死亡的主要原因[1].子痫发病后治疗困难,唯一有效的方法就是终止妊娠,因此,早期筛查干预、预防子痫发生一直是产科学致力解决的重点,因此,本研究针对具有PE前期症状的孕妇,通过LDA干预探讨可能的干预机制,为其临床预防PE发生提供依据.同时采用Western blot技术检测两组PE患者胎盘组织中TRX、NF-κB、TXA-2蛋白的表达情况,以探讨LDA对PE预防作用可能的分子机制.
1 资料与方法
1.1 一般资料
选择2016年10月—2018年12月在北华大学附属医院收治的可能发展为PE的具有高危因素的患者112例,按照随机分组方法将患者分为两组,研究组54例,对照组58例.患者就诊时起始孕周16~22 周,单胎,宫内筛查胎儿结构正常.可能发展成PE的高危因素孕妇最少满足以下1项条件:既往慢性高血压病史;或既往无高血压和肾脏病病史,但本次妊娠20周前血压偏高,收缩压(SBP)>140 mmHg或(和)舒张压(DBP)>90 mmHg,尿蛋白(-);过往有妊娠PE史.将两组患者一般情况进行比较,差异无统计学意义(P>0.05).见表1.所有入选患者均知情且签署知情同意书,该研究经医院医学伦理委员会审核批准.
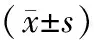
表1 两组患者一般情况
1.2 方 法
临床采用随机、开放、对照的研究方法,两组患者均定期、正规产检.
观察组:从孕16~22周开始口服LDA(拜阿司匹林),75 mg/d,36孕周停药.对照组:不服用LDA,进行孕期指导,合理饮食,进行常规围产期保健,合理安排休息并适当锻炼.一旦发生PE,及时按常规治疗.两组患者定时监测血压(BP)、体质量,同时检测血尿常规、肝肾功能、凝血功能等,监测宫高和腹围增长情况.密切观察孕期情况,并做好胎儿宫内监测,追踪随访两组孕妇分娩情况及新生儿情况.
1.3 观察指标
经过监测和临床观察,收集两组患者PE发生孕周、分娩的孕周、分娩的方式、新生儿出生时体质量及母儿并发症(包括FGR、FD、PA、OGH、心肝肾功能异常、CW、血小板减少及产后出血)等指标,探讨两组患者的临床结局.收集两组患者空腹静脉血3~5 mL 用于检测外周血中SOD活性及MDA、ROS水平,采用酶联免疫吸附法(ELISA)检测对照组和研究组外周血中的ox-LDL、GSH-Px表达水平,实验严格按照试剂盒说明书操作要求进行.Western blot技术检测两组患者胎盘组织中TRX、NF-κB、COX-2蛋白表达水平,同时将结果进行比较.
1.4 统计学分析

2 结 果
2.1 两组患者妊娠PE发病及分娩情况
研究组PE发生率(22.2%)显著低于对照组(62.1%),差异具有统计学意义(P<0.05);研究组的分娩孕周及新生儿出生体质量与对照组比较,差异具有统计学意义(P<0.05).见表2.
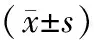
表2 两组患者PE发生率、发病孕周、分娩孕周和新生儿情况
2.2 两组PE患者妊娠结局
通过对两组分娩方式结果比较发现,在剖宫产、顺产及引产方面,两组间比较差异无统计学意义(P>0.05);在围生儿结局方面,研究组早产率(14.8%)显著低于对照组(50.0%),研究组足月产率(51.9%)高于对照组(24.1%),二者差异具有统计学意义(P<0.05).见表3.

表3 两组患者妊娠结局
2.3 LDA对两组患者氧化还原水平的影响
研究结果显示:对照组SOD、GSH-Px活性下降,与研究组比较差异具有统计学意义(分别为P<0.05和P<0.01);对照组MDA水平升高,ROS、ox-LDL含量增加,与研究组比较差异具有统计学意义(P<0.05).见表4.
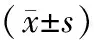
表4 LDA对两组患者血液中SOD、GSH-Px活性、ROS水平、Ox-LDL和MDA含量的影响
2.4 LDA对胎盘组织中TRX、NF-κB和TXA-2蛋白表达的影响
研究结果显示:研究组经LDA干预后,TRX蛋白表达明显提高,与对照组比较,NF-κB和TXA-2蛋白表达明显减少(P<0.01).见图1.
3 讨 论
PE是妊高症最具代表性的疾病,PE发作时全身的小血管持续收缩,导致胎盘出现缺血缺氧等病理改变,并激活氧化应激反应,引起胎盘损伤乃至坏死.机体内正常的氧化还原状态对维持细胞正常生理功能至关重要[2],正常状态下,孕妇体内氧化及抗氧化作用之间保持一种动态的平衡,这种平衡在PE发生时被打乱,产生氧化应激反应,同时PE患者还存在着抗氧化能力下降或不足,抗氧化剂减少或活性下降,抗氧化酶如SOD、GSH-Px、TRX等活性降低.
研究[3]发现:硫氧还蛋白(TRX)系统与PE发生密切相关.TRX系统是机体重要的抗氧化系统,硫氧还蛋白-1(thioredoxin-1,TRX-1)是调节氧化还原的关键蛋白,在胎盘细胞滋养层、蜕膜和基质细胞中均有TRX-1表达,TRX清除体内过氧化物的作用十分强大,能够迅速清除机体产生的活性氧(reactive oxygen species,ROS),保护细胞免受肿瘤坏死因子-α(TNF-α)及H2O2等的损伤,促进细胞增殖和抑制细胞凋亡.TRX-1是诸多底物蛋白中二硫键(S-S)的氧化还原酶,其能结合底物蛋白,并通过巯基/二硫键的氧化还原转换进而调节底物蛋白的生物学活性[4].许多刺激因素如紫外线照射、炎性因子、病毒感染等均能导致氧化应激反应,诱导TRX-1表达,TRX-1一方面通过与ROS反应清除掉ROS,另一方面TRX-1在炎症调控、细胞增殖反应、细胞存活及凋亡进程中均起关键作用[5].TRX活性下降会引起脂质过氧化物的过多产生,并加剧全身炎症反应[6].研究[7]显示:体内局部的缺血再灌注损伤可诱导TRX的表达增加,转基因大鼠中TRX的过表达可明显减少局部的脑组织损伤.这些现象表明:生理状态下,TRX能保护细胞,对抗氧化应激反应引起的损伤,并做出相应调节,以适应外界环境.
核转录因子κB(NF-κB)是一种对氧化还原十分敏感的多亚基转录因子,NF-κB可被生物或化学的还原剂激活[8],并迅速激活相关基因的表达,这些基因常参与炎症反应、免疫反应及急性炎症反应.只有在NF-κB的p50/p65二聚体p65亚单位中出现还原性半胱氨酸时,NF-κB的DNA活性才能表现出来[9].NF-κB是一个由p50和p65亚基组成的异二聚体,在细胞质中抑制蛋白IκB与该异二聚体相结合,使NF-κB失去活性.研究[10]发现:TRX在氧化状态时不能激活NF-κB,只有还原状态的TRX在还原系统(Trx +NADPH +TrxR)中能够降解IκB,并激活NF-κB.在人体中,还发现了过表达的TRX可激活NF-κB,无氧化还原活性的且结构域呈阴性的人体TRX无法激活NF-κB,活化后的NF-κB可以激活下游的靶分子(如COX-2),进一步启动炎症反应,引起氧化还原水平改变,导致TXA2增多.TXA2具有强烈的驱使血小板活化聚集、收缩平滑肌、形成动脉粥样硬化、形成新血管、启动过敏反应及免疫调节等作用[11].研究[12]发现:高表达血栓素A2合成酶(TXS)的滋养层细胞能产生催化作用,导致更多的TXA2产物产生,这可能是PE胎盘血管收缩导致发生氧化应激反应的重要原因.
TRX和TRX受体(TR)存在于胎盘的滋养细胞、蜕膜细胞和绒毛的基质细胞中,细胞质和线粒体中也存在,TRX有保护胎盘免受氧化应激损伤的功能.本研究结果表明:在没有经过LDA处理的对照组PE,ROS含量升高,MDA水平升高,SOD、GSH-Px活性下降,ox-LDL含量升高,与经过LDA预保护的研究组比较有显著性差异(P<0.05).两组胎盘组织中蛋白水平比较显示:TRX在对照组胎盘组织中的表达明显减少,和经过LDA预保护的研究组比较差异显著(P<0.001),说明TRX系统不但能直接清除ROS,而且还能将亚硝基硫醇分解,释放出分解产物一氧化氮(NO)和谷胱甘肽(GSH),TRX的减少可导致过氧化产物的产生增多,过氧化产物进一步氧化产生毒性很强的氧化亚硝酸[9].一方面,TRX生成不足使细胞的抗氧化活性下降,使得过氧化物产生增多;另一方面,PE患者TRX在胎盘的表达减少也会促进细胞凋亡,加剧PE发生[13].有研究[14]发现子痫前期和(或)胎儿生长受限(FGR)的孕妇中,TRX蛋白和mRNATRX表达比正常孕妇低,在维持妊娠过程中TRX系统发挥重要作用,TRX基因敲除可导致自发性流产.本研究结果显示:PE孕妇胎盘TRX的含量及TR活性比同孕周正常孕妇低,而脂质过氧化物含量升高.由上述结果可以推测,TRX系统在子痫前期的发病中具有重要作用.
综上所述,PE的发生导致孕妇机体氧化还原水平平衡被打乱,抗氧化能力(SOD、GSH-Px活性)下降,氧化产物增多(ROS升高),脂质过氧化产物出现堆积(ox-LDL、MDA水平升高),TRX对氧化产物清除能力下降,由此激活下游的炎症信号分子NF-κB,引起TXA-2表达增多,导致炎症反应,加剧PE症状.LDA可能通过提高TRX活性恢复氧化还原平衡,提高机体抗氧化反应能力,阻滞NF-κB信号分子,以减轻或消除高危孕妇PE的发生.

