尾矿中重金属对4种土著植物生理特性的影响
付靖雯, 高天鹏, , , 4,* ,张松林, 万子栋, 王雪莹, 左明博, 刘圆, 李昌明
尾矿中重金属对4种土著植物生理特性的影响
付靖雯1, 高天鹏1, 2, 3, 4,*,张松林1, 万子栋1, 王雪莹3, 左明博1, 刘圆3, 李昌明2
1. 西北师范大学, 地理与环境科学学院, 兰州 730070 2. 兰州城市学院, 甘肃省矿区污染治理与生态修复工程研究中心, 兰州 730070 3. 兰州交通大学, 化学与生物工程学院, 兰州 730070 4. 西安文理学院, 生物与环境工程学院, 兰州 710065
文章以盐生草()、地肤()、碱蓬()、绿藜()4种土著藜科植物为研究对象, 对比分析了农田土(T1)和原生土+尾矿(1:1, T2)大田盆栽试验下, 4种植物幼苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、叶绿素(Chl)、丙二醛(MDA)、可溶性蛋白(SP)、脯氨酸含量(Pro)和抗氧化酶活性等生理指标的变化情况, 为金川尾矿生态修复植物的筛选提供理论依据。结果表明, T2条件下的盐生草、地肤的3个光合指标(Pn、Gs、Tr)均显著下降, 其余6个指标均显著上升; 碱蓬的气孔导度、蒸腾速率、丙二醛、脯氨酸含量和超氧化物歧化酶活性(SOD)显著上升, 过氧化氢酶活性(CAT)、叶绿素含量和净光合速率显著下降; 绿藜的净光合速率、气孔导度和蒸腾速率显著下降, 可溶性蛋白、过氧化物酶活性(POD)显著上升。通过模糊隶属函数综合评价分析得出4种植物幼苗抗重金属性顺序为盐生草>地肤>绿藜>碱蓬。盐生草可作为金川尾矿复垦及原位修复的优势植物。
重金属胁迫; 光合指标; 抗氧化酶活性; 隶属函数分析
0 前言
尾矿是矿物加工后的固体废弃物, 通常存放于没有任何措施的露天场所[1]。尾矿中含有大量铅、汞、铜、镍、锌等重金属, 这些重金属通过降雨、径流和风进入土壤和地下水, 干扰生态系统, 进而威胁粮食和人畜饮水[2]。
植物修复通过固定、提取、挥发重金属和外源化合物来消除土壤污染物, 这种技术既处理了污染物又不破坏土壤上层[3]。而植被再生修复被认为是最适合实现尾矿长期原位修复的技术[4]。植被再生可以有效阻止风携带的污染颗粒物, 并减少径流中沉积物的流动[5]。在重金属背景值较高的区域, 某些植物被驯化且对一种或多种重金属具有很高的耐性, 能够正常生长在高浓度重金属污染土壤上, 这些植物被称为耐性植物, 其中一些还能富集大量重金属。吴道铭[6]研究发现, 芒属植物的抗氧化和光合能力强、根系存在多种共生微生物且代谢能力强, 因此其对重金属的耐性较强; 余光辉[7]通过对生物量的研究得到商陆、苍耳和野茼蒿对重金属耐性较强, 其中商陆长势最佳、耐性最强; Guo等人[8]通过对两种小麦的光合指标、抗氧化酶活性以及MDA含量的测定及影响机制分析, 得到百农160对镉具有更强的耐性。
禾本科、藜科、菊科、蒺藜科是金川矿区相对优势的物种,且藜科植物能够大量富集铜、镍等重金属,更适合用于重金属污染废弃地修复[9]。因此,本文旨在分析盐生草、地肤、碱蓬和绿藜4种金昌土著藜科植物对尾矿中复合重金属的生理响应和耐性机制, 为金川尾矿复垦及原位修复选择植物方面提供数据参考及理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试土壤
供试土壤取自甘肃省金昌市金川矿区北部某废弃镍矿尾矿坝(纬度38°30'57.5", 经度102°09'4.2"), 供试土壤取自尾矿直接作面业矿渣、周边农田土和东面30 km以外未扰动的荒漠原生土。土壤和尾矿样品均采集自土壤表层(0—20 cm)。
试验设置对照组(农田土, T1), 实验组(原生土与尾矿按照1:1混合, T2), 其土壤理化性质由表1所示。两组土壤阳离子交换量基本相同, 且都为碱性土壤(pH>7)。根据《GB15618—2018土壤环境质量农用地土壤污染风险管控(试行)》标准, 在pH大于7.5条件下, T2的铬(Cr)、铜(Cu)、铅(Pb)、锌(Zn)的浓度均显著超过农用地土壤污染风险筛选值。通过计算内梅罗污染指数来评价土壤污染程度, 综合污染指数为29.54, 达到重污染水平。
1.1.2 供试植物
矿区尾矿修复地土壤保水能力较差, 一般不具备灌溉条件, 且多为碱性土壤, 因此我们尽可能选用耐旱性、耐盐碱性相对较强的植物进行研究[10]。2018年8月, 在金川矿区进行样方调查, 并做了标记, 确定了金川矿区周围生长良好的盐生草、地肤、碱蓬和绿藜为矿区主要优势种。11月10—13日, 在标记的样方内采集了上述4种植物种子, 这四种植物均为当地一年生荒漠植物, 并且具有抗逆性强、生长周期短、生物量大等特点[11–14], 是构成河西走廊干旱荒漠景观的重要部分, 生态适应能力强, 在矿区恢复与重建中扮演着重要角色, 具有不可替代的生态功能[15]。4种植物种子均采自当地未受污染区域, 并阴干保存。

表1 两种土壤0—20 cm深度土壤理化性质
1.2 试验方法
试验采用盆栽法, 在甘肃省矿区污染治理与生态修复工程中心金川工作站试验园区和理化实验室内进行。2019年4月26日, 将阴干保存的4种植物的种子分散种植于直径为60 cm×60 cm的花盆中, 浇透水。对照组(农田土, T1)和实验组(原生土与尾矿按照1:1混合, T2)各设置3个重复, 培养50天后, 对4种植物幼苗各项指标进行测定。
1.2.1 光合指标的测定
选取T1处理和T2处理条件下生长健壮均一的植株, 用LI—6400XT便携式光合仪, 于8:30—11:00测定植株中上部叶片的光合指标, 包括光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)。
1.2.2 株高和生理指标的测定
株高: 植株的最高点到露出培养土表面的部位长度。
光合测定的同时, 采集植物中上部健康叶片, 迅速带回实验室低温4℃保存, 用于植物渗透调节物质和抗氧化酶活性测定。试验参照陈建勋[16]的方法测定各项生理指标。采用硫代巴比妥酸比色法测定丙二醛(MDA)含量, 采用分光光度法测定叶绿素(Chl)含量, 采用磺基水杨酸法测定游离脯氨酸(Pro)含量, 采用考马斯亮蓝G-250法测定可溶性蛋白含量, 采用愈创木酚法测定过氧化物酶(POD)活性, 采用NBT(氮蓝四唑)光还原法测定超氧化物歧化酶(SOD)活性, 采用分光光度法过氧化氢酶(CAT)活性, 每个指标测定3次重复。
利用模糊隶属函数[17–18]评价4种植物抗复合重金属的能力。如植物的叶片生理指标与抗重金属性呈正相关, 则将其隶属值累加, 取平均数以评定其抗重金属能力, 公式如下:
R(Xi)=(Xi–Xmin)/(Xmax–Xmin) (1)
式中, R为隶属函数值; Xi为某项指标测定值; Xmin、Xmax为所有参试材料中该项指标的最小值和最大值。
利用公式(2)计算各生理指标的抗重金属系数, 并进行相关性分析, 得到各生理指标的相关系数矩阵。
抗旱系数=处理测定值/对照测定值 (2)
利用公式(3)计算权重。

式中, wi表示第i个公因子在所有公因子中的重要程度, Pi为各品种第i个因子的贡献率。
利用公式(4)计算综合评价值。

式中, D表示植物的抗重金属性综合评价值。
1.3 数据处理
采用SPSS 23.0和Excel 2016软件对数据进行统计学分析。采用双因素方差分析法和LSD法对同一处理下4种植物间的各项指标和同一植物在两种处理下的各项指标进行方差分析和多重比较(P= 0.05)。用Pearson法对各单项指标的抗重金属系数的相关性进行分析。
采用Origin 8.0软件进行数据处理和绘图。
2 结果与分析
2.1 重金属对植物幼苗光合特征的影响
T2处理下, 4种植物的光合指标表现出显著差异, 其中碱蓬和盐生草的净光合速率显著高于地肤和绿藜; 绿藜的气孔导度和蒸腾速率显著高于其他三种植物, 其次是盐生草。盐生草和地肤的气孔导度、蒸腾速率和净光合速率均显著降低; 碱蓬的净光合速率呈显著降低趋势, 而气孔导度和蒸腾速率呈显著上升趋势, 说明测量时碱蓬呼吸作用消耗相对较大; 绿藜的3个光合指标均显著降低。
2.2 重金属对4种植物幼苗叶片叶绿素a+b和MDA含量的影响
丙二醛是膜脂过氧化产物的最终分解产物, 可以反映植物遭受逆境伤害的程度。T2处理下, 碱蓬的丙二醛含量显著高于其他三种植物, 且较T1显著升高, 升高幅度为41.39%。盐生草、地肤和碱蓬的MDA显著升高, 其中盐生草和地肤的MDA升高幅度较大, 分别为171.48%和138.39%。绿藜的MDA含量变化幅度无显著差异, 为9.23%。
T2处理下, 绿藜的叶绿素a+b含量显著高于其他三种植物, 其次为地肤和碱蓬。4种植物的叶绿素a+b含量较T1均显著降低, 碱蓬的降低幅度最大, 为66.86%; 其次为地肤。

不同小写字母表示处理间差异显著,不同大写字母表示植物间差异显著(P<0.05)
Figure 1 Photosynthetic characteristic of four plants under two soil treatments

图2 两种土壤处理下4种植物的丙二醛和叶绿素含量
Figure 2 MDA and Chl content of four plants under two soil treatments
2.3 重金属对4种植物幼苗叶片中渗透调节物质的影响
4种植物的可溶性蛋白含量在T1处理下有显著差异, 在T2处理下绿藜的可溶性蛋白含量显著高于其他3种植物, 地肤次之。T1和T2处理下, 碱蓬的脯氨酸含量显著高于其他三种植物, 且盐生草、地肤和绿藜之间无显著差异。在T2处理下, 4种植物的渗透调节物质含量较T1均有不同程度的升高。其中盐生草和绿藜的可溶性蛋白含量显著高于T1处理, 分别为202.45%和54.87%; 地肤和碱蓬的可溶性蛋白含量在T1和T2处理之间无显著差异。盐生草、地肤和碱蓬的脯氨酸含量显著高于T1处理, 分别为334.75%、134.58%和28.01%; 绿藜的脯氨酸含量在T1和T2处理之间无显著差异。
2.4 对4种植物幼苗叶片中抗氧化酶活性的影响
T1和T2处理下, 4种植物的POD活性均有显著差异, 其中绿藜的POD活性最大, 地肤次之。T2处理下, 地肤和绿藜的POD活性较T1显著升高, 变化幅度分别为89.98%和154.80%, 但盐生草和碱蓬的POD活性在T1和T2处理之间无显著差异, 变化幅度分别为3.50%和6.92%。
地肤的SOD活性在T1处理下显著高于其他三种植物, 且盐生草、碱蓬和绿藜之间无显著差异, 但其较T1处理显著降低, 且降低幅度最大, 为24.73%, 故在T2处理下显著低于其他三种植物; 较T2处理, 盐生草的SOD活性也显著降低。碱蓬的SOD活性较T1显著升高, 且升高幅度最大, 为77.54%, 因此在T2处理下其SOD活性显著高于其他三种植物。
T1处理下, 盐生草的CAT活性显著低于其他三种植物, 但在重金属胁迫下, 其CAT活性显著升高, 且升高幅度最大, 为337.67%。绿藜的CAT活性在T1处理下显著高于其他三种植物, 在重金属胁迫下, 无显著变化。与SOD活性相反, 地肤的CAT活性显著升高, 碱蓬则显著降低, 且降低幅度较大, 为63.05%, 因此碱蓬的CAT活性显著低于其他三种植物。

图3 两种土壤处理下4种植物的渗透调节物质
Figure 3 Osmotic adjustment solutes of four plants under two soil treatments

图4 两种土壤处理下4种植物的抗氧化酶活性
Figure 4 Antioxidant enzyme activity of four plants under two soil treatments
2.5 重金属对4种植物幼苗株高的影响
如图6所示, 重金属胁迫下, 4种草本植物没有表现出显著的毒害效应而导致死亡。碱蓬和绿藜在未受重金属污染的条件下株高显著高于盐生草和地肤, 长势良好; 在尾砂处理下, 参试的4种植物表现出显著差异, 其中碱蓬的株高要显著高于其他植物, 其次是地肤。但在T2处理下, 盐生草、碱蓬和绿藜的株高较对照组显著减少, 特别是碱蓬, 其次是绿藜。
2.6 重金属对4种植物幼苗生理生态适应性的影响
对7个生理指标的抗重金属系数进行因子分析(表3), 按照贡献率大于80%的原则[19], 保留前2项综合指标, 贡献率分别为63.4%和27.2%, 累积贡献率达90.6%, 其余可忽略不计。第1主成分主要包括脯氨酸、过氧化氢酶和丙二醛; 第2主成分主要包括叶绿素和过氧化物酶。根据贡献率大小可知各综合指标的相对重要性。

图5 两种土壤处理下4种植物的株高
Figure 5 Height of four plants under two soil treatments
根据以上表格可计算出重金属胁迫下4种植物所有因子的隶属函数值R(x)、各因子的权重和抗重金属性综合评价值D(表4)。抗重金属性综合评价值D了反映4种植物抗重金属能力的大小, 数值越大抗重金属能力越强。由表5可得到4种土著植物抗重金属性顺序为为盐生草(0.829)>地肤(0.399)>绿藜(0.364)>碱蓬(0.000)。
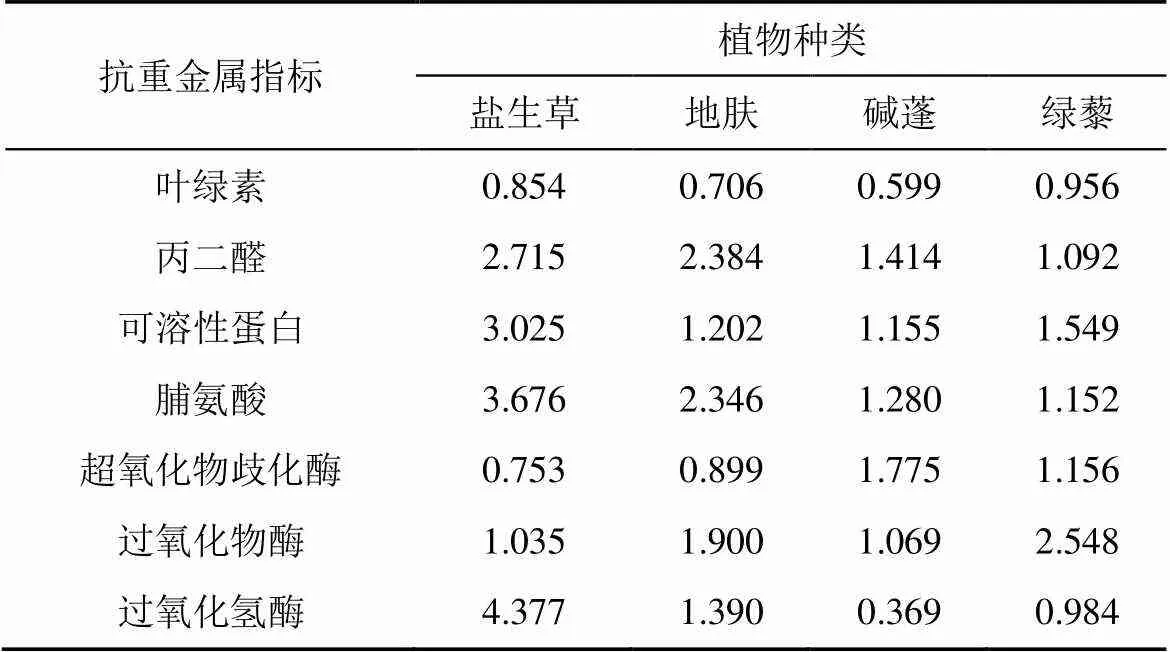
表2 各单项指标的抗重金属系数

表3 各单项指标的相关系数矩阵

表4 各综合指标系数及贡献率

表5 各植物综合指标值、权重、隶属函数值和综合评价值
3 讨论
本研究中, 4种植物的株高受重金属胁迫后均有不同程度的下降, 其中碱蓬的株高较对照组有37.20%的降低, 降低幅度最大; 而盐生草的株高降低幅度最小, 为23.6%。因此, 盐生草较其他三种植物对重金属的耐性更强。
重金属胁迫通过两个方面影响叶绿素含量, 一是破坏叶绿素合成需要的酶, 影响植物合成叶绿素, 进而抑制植物光合作用[20]; 二是对叶绿体结构和细胞膜的破坏[21–23]。在较高浓度重金属处理时, 由于叶绿素酶或氨基酮戊酸脱水酶受到抑制, 植物的叶绿素含量显著降低, 进而抑制植物光合作用[24]。本文通过对4种本地植物光合指标和叶绿素a+b含量的比较, 发现无尾矿处理下盐生草、地肤、碱蓬的净光合速率和叶绿素a+b含量均显著高于尾矿处理, 说明重金属胁迫在一定程度上破坏了叶绿素的形成, 叶绿素的含量也随之降低, 抑制了植物光合作用, Pn显著下降, 且与各重金属相关性达到显著负相关水平(R=-0.851, P<0.001)。本试验中绿藜的气孔导度和蒸腾速率显著降低, 这可能是由于绿藜测试时还处于“休眠”状态, 气孔关闭, 影响CO2的交换和水分的交换, 从而导致绿藜叶片气孔导度和蒸腾速率降低[25]。
MDA是细胞膜被破坏的标志性物质。重金属胁迫可刺激活性氧的形成, 将脂肪酸转化为有毒的脂质过氧化物, 破坏生物膜, 对植物细胞造成损害, 表现为MDA浓度的升高[26–28]。本研究中, T2处理下盐生草、碱蓬和地肤的MDA含量显著高于T1条件, 绿藜的MDA含量无显著差异, 且各重金属(Cr、Cu、Ni、Pb、Zn)与MDA含量为显著正相关水平(R=0.629, P<0.001), 说明盐生草、地肤和碱蓬的细胞膜受损程度加剧, 而绿藜的细胞膜受损程度较小。
高浓度重金属胁迫会诱导植物体内产生大量活性氧并抑制植物正常的新陈代谢, 引起膜脂过氧化并增大质膜通透性[29–30]。SOD、POD和CAT是保护植物的重要酶类, SOD可以有效清除植物体内的O2-, 可将其转化为氧化能力较弱的H2O2, 然后由CAT和POD进一步将H2O2转化为H2O和O2[31]。本试验中, 地肤的CAT和POD活性在重金属胁迫下显著增大, 表明这两种酶同时作用, 将H2O2转化为H2O和O2, 使H2O2不足以对植物产生毒性[32]; 盐生草的CAT活性显著增大, 说明其依靠产生大量的过氧化氢酶清除植物体内H2O2, 并阻止高毒性-OH产生。碱蓬的SOD活性显著增大, 如果从分子机制解释的话, 可能是受到ROS作用时, 存在于介质中的SOD核编码酶被-NH2末端定位顺序运送到细胞并起作用[33], 这有待于下阶段工作继续探索; 有学者发现抗氧化酶对活性氧的清除能力是在其基因转录成mRNA再表达成蛋白质, 并形成一定的空间结构后才表现出的。抗氧化酶活性由于各基因的转录受到抑制而降低, 并且植物受重金属胁迫产生的ROS通过体内抗氧化酶系统的协同作用清除[34]。因此盐生草的SOD活性的显著降低、碱蓬的CAT活性显著降低可能是由于在高浓度复合重金属胁迫下, SOD和CAT对应的基因转录受到抑制, 进而导致ROS无法及时清除, 使细胞受到伤害, MDA含量显著增大, 这与不同重金属浓度下碱蓬的抗氧化酶活性响应一致[35], 而各基因的表达量具体变化值, 还需进一步在后续试验中进行分子机制研究。
在植物应对重金属胁迫时, 会产生大量可溶性蛋白和游离脯氨酸等渗透调节物质来维持细胞内外渗透平衡[36]。高浓度铜、铅复合处理下, 植物幼苗的游离脯氨酸和可溶性蛋白含量显著高于低浓度复合重金属处理, 与本试验植物的渗透调节物质响应一致[37–38]。本试验中, 盐生草和绿藜的可溶性蛋白含量显著增大, 可能是由于Cd、Pb、Ni可以刺激植物细胞内水解酶活性增强或限制合成酶活性, 使结构蛋白转变为可溶性蛋白[39]。盐生草、地肤和碱蓬的游离脯氨酸含量显著增大, 可能通过脯氨酸的积累来消除重金属对细胞的氧化损伤或维持内外渗透压[40]。
重金属胁迫下, 4种土著植物的7个生理指标和3个光合指标均受到不同程度影响。4种植物中, 盐生草的重金属抗性最强, 而碱蓬的重金属抗性最弱。盐生草主要通过产生可溶性蛋白、游离脯氨酸和过氧化氢酶等细胞渗透调节物质来提高自身对重金属胁迫的忍耐, 它更适合用于金川尾矿原位植物修复及废弃地复垦。
[1] Babel S, Chauhan R, Ali N, et al. Preparation of Phosphate Mine Tailings and Low Grade Rock Phosphate Enriched Bio-fertilizer[J]. Journal, 2016, 75: 120–123.
[2] Moreira H, Pereira S I A, Marques A P G C, et al. Selection of metal resistant plant growth promoting rhizobacteria for the growth and metal accumulation of energy maize in a mine soil-effect of the inoculum size[J]. Geoderma, 2016, 278: 1–11.
[3] WANG Li, JI Bin, HU Yuehua, et al. A review on in situ phytoremediation of mine tailings[J]. Chemosphere, 2017, 184(10): 594–600.
[4] Yoon J, Cao X, Ma L Q. Accumulation of Pb, Cu, and Zn in native plants growing on a contaminated Florida site [J]. Science Total Environmental, 2006, 368(2–3): 456–464.
[5] Hector M C, Angel F, Raquel A. Metal extractability in acidic and neutral mine tailings from the Cartagena-La Unión Mining District (SE Spain) [J]. Applied Geochemistry, 2008, 23(5): 1230–1240.
[6] 吴道铭, 陈晓阳, 曾曙才. 芒属植物重金属耐性及其在矿山废弃地植被恢复中的应用潜力[J]. 应用生态学报, 2017, 28(04): 1397–1406.
[7] 余光辉, 云琨, 翁建兵, 等. 湘潭锰矿重金属环境安全及植物耐性研究[J]. 长江流域资源与环境, 2015, 24(06): 1046–1051.
[8] Guo J J, Qin S Y, Zed R, et al. Cadmium stress increases antioxidant enzyme activities and decreases endogenous hormone concentrations more in Cd-tolerant than Cd- sensitive wheat varieties[J]. Ecotoxicology and Environmental Safety, 2019, 172: 380–387.
[9] 廖晓勇, 陈同斌, 阎秀兰, 等. 金昌镍铜矿区植物的重金属含量特征与先锋植物筛选[J]. 自然资源学报, 2007, 22(3): 486–495.
[10] 张海娜, 鲁向晖, 金志农, 等. 高温条件下稀土尾砂干旱对4种植物生理特性的影响[J]. 生态学报, 2019, 39(7): 2426–2434.
[11] 王璐, 蔡明, 兰海燕. 藜科植物藜与灰绿藜耐盐性的比较[J]. 植物生理学报, 2015, 51(11): 1846–1854.
[12] 鲁艳, 李新荣, 何明珠, 等. 矿业废弃地先锋植物盐生草在镍、铜处理下抗氧化酶系统的变化[J]. 中国沙漠, 2013, 33(1): 118–125.
[13] 陈丽丽, 付媛媛, 王艳萍, 等. 镉锌胁迫对小麦和2种杂草种子萌发及幼苗生长的影响[J]. 西南林业大学学报(自然科学), 2019, 39(1): 50–57.
[14] 何洁, 高钰婷, 贺鑫, 等. 重金属Zn和Cd对翅碱蓬生长及抗氧化酶系统的影响[J]. 环境科学学报, 2013, 33(1): 312–320.
[15] 邹慧, 高光耀, 傅伯杰. 干旱半干旱草地生态系统与土壤水分关系研究进展[J]. 生态学报, 2016, 36(11): 3127–3136.
[16] 陈建勋, 王晓峰. 植物生理学实验指导(第二版)[M]. 广州: 华南理工出版社, 2006.
[17] LIU Yibo, XIAO Jingfeng, JU Weimin, et al. Water use efficiency of China′s terrestrial ecosystems and responses to drought[J]. Scientific Reports, 2015, 5: 13799.
[18] 石永红, 万里强, 刘建宁, 等. 多年生黑麦草抗旱性主成分及隶属函数分析[J]. 草地学报, 2010, 18(5): 669–672.
[19] 贺仲雄. 模糊数学及其应用[M]. 天津: 天津科学技术出版社, 1985: 67–70
[20] 李朝阳, 陈玲, 马陶武, 等. 湿地匍灯藓对Pb胁迫的生物标志物响应[J]. 农业环境科学学报, 2012, 31(2): 292– 298.
[21] Choudhury S, Panda S K, et al. Toxic effects, oxidative stress and ultrastructural changes in moss Taxithelium nepalense (Schwaegr. ) Broth under chromium and lead phytotoxicity[J]. Water Air and Soil Pollution, 2005, 167(1–4): 73–90.
[22] Basile A, Sorbo S, Pisani T, et al. 2012. Bioacumulation and ultrastructural effects of C d, Cu, Pb and Zn in the moss Scorpiurum circinatum (Brid. ) Fleisch & Loeske[J]., 166: 208–211.
[23] HUANG Guoyong, Wang Youshao, et al. Physiological and biochemical responses in the leaves of two mangrove plant seedlings(Kandelia obovata and Bruguiera gymnorrhiza) exposed to multiple heavy metals[J]. Journal of Hazardous Materials, 2010, 182(1–3): 848–854.
[24] 池永宽, 熊康宁, 王元素, 等. 贵州石漠化地区灰绿藜和鹅肠菜光合日动态[J]. 草业科学, 2014, 31(11): 2119– 2124.
[25] Rahman M M, Yan C L, Rahman M D M, et al. Effects of copper on growth, accumulation, antioxidant activity, and malondialdehyde content in young seedlings of the mangrove species Kandelia candel (L. )[J]. Plant Biology, 2012, 146(1): 1–11.
[26] Emre I, Kayis, T, Coskun M, et al. Changes in antioxidative enzyme activity, glycogen, lipid, protein, and malondialdehyde content in Cadmium-treated[J]Annals of the entomological society of America, 2013, 106(3): 371–377.
[27] Li Yong, ZHANG Shanshan, Jiang Wusheng, et al. Cadmium accumulation, activities of antioxidant enzymes, and malondialdehyde (MDA) content in Pistia stratiotes L.[J]. Environmental Science Pollution Res, 2013, 20(2): 1117–1123.
[28] Wang Youbao, Yan Aolei, Dai Jie, et al. Accumulation and tolerance characteristics of cadmium in Chlorophytum comosum: a popular orn amental plant and potential Cd hyperaccumulator[J]. Environmental Monitoring & Assessment, 2012, 184(2): 929–937.
[29] Chen Anwei, Zeng Guangming, Chen Guiqiu, et al. Plasma membrane behavior, oxidative damage, and defense mechanism in Phanerochaete chrysosporium under cadmium stress[J]. Process Biochemistry. 2014, 49(4): 589–598.
[30] 史静, 潘根兴, 夏运生, 等. 镉胁迫对两品种水稻生长及抗氧化酶系统的影响[J]. 生态环境学报, 2013, 22(5): 832–837.
[31] Xu Xianghua, Liu Cuiying, Zhao Xiaoyan, et al. Involvement of an antioxidant defense system in the adaptive response to cadmium in maize seedlings[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 93(5): 618–624.
[32] María P B, Susana M, Gallego M. Tomaro Cadmium toxicity in plants[J]. Brazilian Journal of Plant Physiology, 2005, 17(1): 21–34
[33] 肖旭峰, 解庆娓, 蔡玲, 等. 芹菜对镉、铅胁迫的生理响应及抗氧化酶基因表达特性分析[J]. 核农学报, 2017, 31(9): 1864–1871.
[34] ZHANG Xu, LI Min, YANG Huanhuan, et al. Physiological responses of Suaeda glauca and Arabidopsis thaliana in phytoremediation of heavy metals[J]. Journal of Environmental Management, 2018, 223: 132–139.
[35] 杨惠, 翟梅枝, 李丽, 等. 不同核桃品种的耐寒性及其渗透调节机制[J]. 西北植物学报, 2013, 33(10): 2003–2009.
[36] JIANG Kun, WU Bingde, WANG Congyan, et al. Ecotoxicological effects of metals with different concentrations and types on the morphological and physiological performance of wheat[J]. Ecotoxicology and Environmental Safety, 2019, 167: 345–353.
[37] 牟祚民, 姜贝贝, 潘远智, 等. 重金属胁迫对天竺葵生长及生理特性的影响[J]. 草业科学, 2019, 36(2): 434–441.
[38] 陈月, 孙宪芝, 杨景慧, 等. 水分胁迫下嫁接对杭白菊渗透调节物质及相关代谢酶基因表达的影响[J]. 植物生理学报, 2018, 54(5): 895–903.
[39] 李晶, 徐玉玲, 黎桂英, 等. 兰州市交通道路主要乔灌木植物叶片重金属积累及生理特性的分析[J]. 生态环境学报, 2019, 28(5): 999–1006.
[40] 胡国涛, 杨兴, 陈小米, 等. 速生树种竹柳对重金属胁迫的生理响应[J]. 环境科学学报, 2016, 36(10): 3870–3875.
Effects of heavy metals on physiological characteristics of four local plants in tailings
FU Jingwen1, GAO Tianpeng1, 2, 3,4, *, ZHANG Songlin1, WAN Zidong1, WANG Xueying3, ZUO Mingbo1, LIU Yuan3, LI Changming2
1. College of Geography and Environmental Science, Northwest Normal University, Lanzhou 730070, China 2. Research Center of Pollution Control and Ecological Restoration Engineering in Mining Area of Gansu Province, Lanzhou City University, Lanzhou 730070, China 3. College of Chemical and Biological Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China 4.School of Biological and Environmental Engineering, Xi’an, University, Xi’an 710065, China
In this study, four nativeplants of,,andin Jinchang area northwest China are selected to analyze their changes of net photosynthetic rate (Pn), Stomatal conductance (Gs), transpiration rate (Tr), chlorophyll content (Chl), malondialdehyde (MDA), soluble protein (SP), proline (Pro) and antioxidant enzymes activity under the treatment of farmland soil (T1) and sedendary soil mixed with tailing (1:1, T2), which provides the theoretical basis for the selection of eco-restoration plants in Jinchuan mining area. The results showed that under T2 treatment, three photosynthetic indexes(Pn, Gs, and Tr)ofandwere decreased , the other six indexes were increased significantly. Gs, Tr, MDA, Pro, and SOD increased, yet CAT, Chl and Pn ofdecreasedsignificantly, respectively. Pn, Gs, and Tr ofdecreased significantly, while SP, POD increased significantly. Membership function analysis showed heavy metal resistance of four plants was:>>>. A conclusion should be reached thatwas more suitable as a dominant plant for Jinchuan mining area phytoremediation and in-situ remediation.
heavy metal stress; photosynthesis index; antioxidant enzyme activity; membership function analysis
10.14108/j.cnki.1008-8873.2020.04.007
付靖雯, 高天鹏, 张松林, 等. 尾矿重金属对4种土著植物生理特性的影响[J]. 生态科学, 2020, 39(4): 51–59.
FU Jingwen, GAO Tianpeng, ZHANG Songlin, et al. Effects of heavy metals on physiological characteristics of four local plants in Jinchuan tailings[J]. Ecological Science, 2020, 39(4): 51–59.
X53S15
A
1008-8873(2020)04-051-09
2019-12-14;
2020-07-28
国家自然科学基金项目(31860176); 国家自然科学基金项目(31460162); 陕西省重点研发计划(2020ZDLSF0606-06)
付靖雯(1996—), 女, 浙江宁波人, 研究生在读, 主要从事矿区污染治理与修复, E-mail: ffjjww0224@163.com
高天鹏, 男, 博士,教授, 主要从事环境生态工程的教学与研究, E-mail: zkgtp@163.com

