乐伐替尼诱导肝癌耐药细胞株的构建及其生物学特性探析*
杨哲豪,喻超,潘耀振,邓路,郑迪杰,孙诚谊*
(贵州医科大学附属医院 肝胆外科,贵州医科大学 肝胆胰脾重点实验室,贵州省肝胆胰脾疾病研究所,贵州 贵阳 550004)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是肝癌的主要组织学类型,发病占原发性肝癌的85%~90%[1-2]。HCC的发病机制复杂,癌细胞的增殖、侵袭、转移与细胞内的各种级联信号转导通路是息息相关的,而细胞信号转导通路中存在的多个关键性基因或是信号分子,乃是分子靶向治疗的重要潜在作用靶点[3-4]。分子靶向药物在临床应用上虽然具有不良反应少和疗效较为突出等优点,靶向药物还是存在着原发性耐药和继发性耐药的问题[5-6]。乐伐替尼(levatinib)是一种口服的多靶点酪氨酸激酶受体抑制剂,主要以血管内皮细胞生长因子(vascular endothelial growth factor,VEGFR)、酪氨酸激酶受体编码基因(rearranged during transfection,RET)、纤维母细胞生长因子受体(fibroblast growth factor receptor, FGFR)及血小板衍生生长因子受体(platelet-derived growth factor,PDGFR)等为作用靶点[7-10],经3期临床实验证实,乐伐替尼在改善患者无进展生存期(progression-free survival,PFS)和客观缓解率(objective response rate,ORR)等方面展示出优于索拉菲尼的效果[11-12],现已被美国食品及药物管理局(food and drug administration,FDA)批准应用于治疗不可切除的肝细胞癌[9],然而HCC靶向治疗中不可避免出现耐药性[5],目前针对HCC治疗过程中产生乐伐替尼耐药后的治疗方案研究尚比较缺乏。本研究采用药物逐步递增法,于体外建立乐伐替尼作用下HCC的分子靶向药物耐药细胞株SMMC-7721,初步探究耐药细胞对化疗药的敏感性及相关机制,报告如下。
1 材料与方法
1.1材料
1.1.1细胞与药品 肝癌细胞株SMMC-7721由本实验室保存,乐伐替尼(批号S116410,10 mol/L)、阿霉素(批号S120810,10 mol/L)、氟尿嘧啶(批号S1209,100 mg)及顺铂(批号S116010,10 mol/L)购自美国Selleck Chemicals公司。
1.1.2主要试剂与仪器 兔抗人P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multidrug resistance protein,MRP)、肺耐药相关蛋白(lung resistance protein,LRP)、谷胱甘肽S-转移酶pi(glutathione-s-transferase pi,GST-pi)、拓扑异构酶Ⅱɑ(topoisomeraseⅡɑ,TopoⅡɑ)及乳腺癌耐药蛋白(breast cancer resistance protein,BRCP)抗体购自武汉塞维尔生物科技有限公司,DMEM、胎牛血清、胰酶及相关细胞培养耗材购自于美国Gibco公司,细胞计数试剂盒(cell counting kit-8,CCK-8)及Western blot相关试剂均购置于武汉谷歌生物科技公司,逆转录试剂盒及SYBR Premix ExTaq试剂盒均购自日本TaKaRa公司;CFX96 Touch荧光定量PCR仪购自美国Bio-rad公司,ChemiDocTMTouch Bio-rad化学发光成像系统购自美国Bio-rad公司。
1.2方法
1.2.1细胞培养 取人HCC细胞株SMMC-7721培养于含10%胎牛血清的DMEM完全培养基中,置于37 ℃的5%CO2恒温培养箱,待细胞长势良好、密度达到90%时进行消化传代。
1.2.2耐药细胞株的建立及分组 应用药物逐步递增法诱导得到耐药细胞株。取对数生长期的SMMC-7721细胞接种于含初始浓度100 nmol/L乐伐替尼和10%FBS的DMEM培养基中,适时更换加药培养基,初期可见大量细胞漂浮、死亡,待2~3周细胞贴壁稳定生长后,用不加药培养基培育3~5 d后传代,继续倍增浓度重复上述操作,最终诱导浓度为3.6 μmol/L,并于终止最终浓度持续培养1个月,历时8个月构建乐伐替尼耐药HCC细胞株SMMC-7721;后续实验中以未经处理的细胞为对照组,诱导后产生耐药的细胞为耐药组。
1.2.3CCK8法检测细胞对药物的敏感性 取对数期长势良好的对照组和耐药组细胞用胰酶消化、吹打,制备为细胞悬液,计数并稀释;分别以3×103个/孔接种于96孔板中,并预留不含细胞的空白组,置于37 ℃的5%CO2恒温培养箱中培养24 h,加入含相应药物浓度的培养基200 μL/孔,乐伐替尼起始浓度为0.001μmol/L,阿霉素、氟尿嘧啶及顺铂起始浓度均为0.01 μmol/L,每种药物均10倍稀释5个梯度浓度,每个浓度处理5个复孔;继续于培养箱中培养72 h,分别于每孔中加入CCK-8试剂10 μL,避光培养1 h;采用酶联免疫分析仪检测样品在490 nm处吸光值并计算各梯度浓度乐伐替尼、阿霉素、氟尿嘧啶及顺铂作用下的细胞生存率;采用Graphpad prism8.0软件绘图并计算不同药物对细胞的半数抑制浓度(median inhibition concentration,IC50)和乐伐替尼的耐药指数(resistance index,RI)。
1.2.4Real time-PCR检测耐药基因MDR1、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP的表达 取对数生长期的各组细胞经胰酶消化,培养基中和,800 r/min离心5 min,弃上清,加Trizol试剂1 mL裂解细胞,提取总RNA并检测RNA浓度和纯度;依照逆转录试剂盒说明书将样品逆转录为cRNA,以GAPDH作为内参,使用SYBR Premix ExTaq试剂盒进行Real time-PCR实验检测MDR1、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP基因的表达。
1.2.5Western blot 检测P-gp、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP蛋白的表达 取各组细胞用RIPA裂解缓冲液裂解,4 ℃、12 000 r/min离心10 min;使用BCA蛋白测定试剂盒测定蛋白质,将膜用5%脱脂奶封闭1.5 h,并在对应条件下与P-gp、LRP、MRP2、GST-pi、TopoⅡɑ和BCRP一抗、二抗温育,洗膜、曝光后,用Image lab检测条带灰度值,计算各耐药基因相关蛋白的相对表达量。
1.3统计学分析
2 结果
2.1耐药细胞对乐伐替尼的耐药性
用时8个月,在体外诱导出乐伐替尼耐药细胞株SMMC-7721,CCK-8检测结果显示对照组和耐药组细胞的IC50分别为(0.15±0.03)μmol/L和(4.34±0.12)μmol/L,RI为28,两组比较差异均有统计学意义(P<0.05)。见图1。
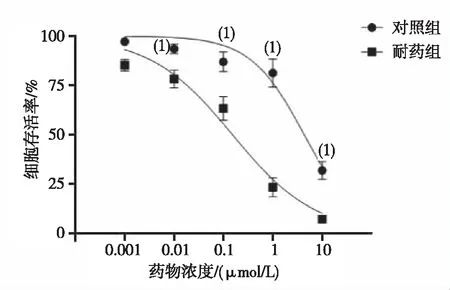
注:(1)与对照组比较,P<0.05。图1 对照组和耐药组细胞的乐伐替尼浓度-细胞存活率曲线Fig.1 Levatinib concentration-cell survival curves of cells of the control and drug-resistant groups
2.2耐药SMMC-7721细胞对不同化疗药物的敏感性
与对照组比较,阿霉素、氟尿嘧啶和顺铂对耐药组SMMC-7721细胞的IC50均降低,差异有统计学意义(P<0.05)。见图2。

注:(1)与对照组比较,P<0.05。图2 不同化疗药物下对照组和耐药组细胞的IC50比较 Fig.2 Median inhibition concentrations of different chemotherapeutic agents in cells of the control and drug-resistant groups
2.3耐药SMMC-7721细胞中MDR1、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP基因的表达
与对照组相比,耐药组SMMC-7721细胞的MDR1、LRP、MRP2、GST-pi、TopoⅡɑ和BCRP耐药基因的相对表达量均下降,差异均有统计学意义(P<0.05或P<0.01)。见图3。
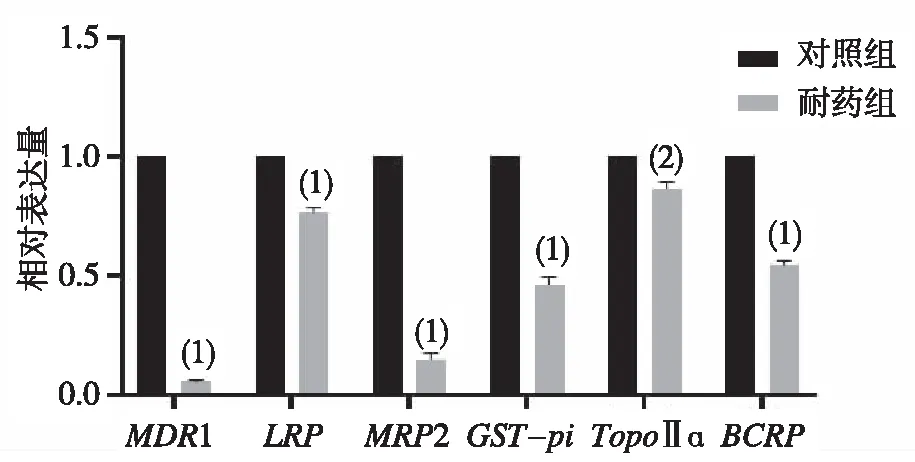
注:与对照组比较,(1)P<0.01,(2)P<0.05。图3 对照组和耐药组SMMC-7721细胞中MDR1、LRP、MRP2、GST-pi、TopoⅡɑ和BCRP耐药基因的表达Fig.3 Experession of drug-resistance genes MDR1,LRP,MRP2,GST-pi,TopoⅡɑ and BCRP in SMMC-7721 cells of the control and drug-resistant groups
2.4耐药SMMC-7721细胞中P-gp、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP蛋白的表达
与对照组比较,耐药组SMMC-7721细胞中P-gp、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP蛋白表达均降低,差异均有统计学意义(P<0.05)。见图4。
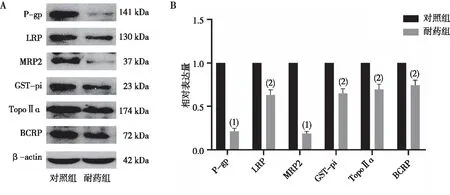
注:与对照组比较,(1)P<0.01,(2)P<0.05。图4 对照组和耐药组SMMC-7721细胞中P-gp、LRP、MRP2、GST-pi、TopoⅡɑ及BCRP蛋白的表达Fig.4 Expression of P-gp,LRP,MRP2,GST-pi,TopoⅡɑ and BCRP protein in cells of the control and drug-resistant groups
3 讨论
靶向治疗是目前晚期HCC治疗的重要手段,索拉菲尼作为第一批应用于晚期HCC治疗的分子靶向药物,但因其反应率低、毒副作用大以及短期获得性耐药等问题,使患者收益大打折扣[5]。近两年,随着临床实验中乐伐替尼治疗晚期HCC疗效和安全性被逐渐证实,为临床上靶向治疗晚期HCC提供更多选择[11]。有研究者发现,在建立非小细胞肺癌奥希替尼耐药细胞株后其对化疗药物敏感性增强[13]。对于HCC产生乐伐替尼耐药后对其他治疗药物的敏感性,尚未有研究报道。目前有研究报道肿瘤细胞对化疗药物敏感性与多药耐药有关[14-16],而产生多药耐药的原因十分复杂,研究报道参与多药耐药的基因主要有:MDR1和MRP可以以跨膜蛋白转运的方式排除化疗药物,MDR1编码的P-gp还可活化抗凋亡通路使细胞对化疗药物耐受[17-19];glutathione-s-transferase,GST以其药物代谢酶作用降低化疗敏感性[20-21];LRP以胞吐作用排出抗肿瘤药物[22-23];TopoⅡ可导致药物靶点不易与DNA形成复合物使得靶点对抗肿瘤药药物敏感性降低[24-25];BCRP可调控细胞毒性物质的排出[26]。大量体外研究表明,MDR1、MRP、GST及BCRP等基因表达与肝癌细胞多药耐药性呈正相关趋势,并且与阿霉素、氟尿嘧啶等药物治疗的敏感性密切相关[14]。
本研究通过药物逐步递增法诱导耐乐伐替尼的SMMC-7721细胞株,CCK-8实验检测乐伐替尼对对照组和耐药组细胞的IC50,并计算出RI值为28,提示成功于体外建立耐乐伐替尼的SMMC-7721耐药细胞株。为了探究乐伐替尼耐药后细胞对化疗药物的敏感性变化,继续通过CCK-8检测耐药细胞对阿霉素、氟尿嘧啶和顺铂的IC50发现较对照组细胞明显降低,即耐药细胞对上述药物敏感性增强。进一步了解产生敏感性变化的潜在机制,通过检测MDR1、LRP、MRP2、GST-pi、TopoⅡα及BCRP的表达后,发现无论在mRNA水平还是蛋白水平,耐药组细胞中表达量均低于对照组。结果表明耐药细胞对化疗药物敏感性增强与上述多药耐药基因的表达量降低有关。
综上所述,本研究成功诱导得到耐乐伐替尼的HCC细胞株SMMC-7721,进一步实验发现其对阿霉素、氟尿嘧啶和顺铂的敏感性增高,可能与耐药细胞中MDR1、LRP、MRP2、GST-pi、TopoⅡα及BCRP基因的表达量下降有关。有望在临床靶向治疗肝细胞癌产生乐伐替尼耐药后提供新的治疗思路。具体作用方式和分子机制还需进一步探究。

