敲低LEF1-AS1对胰腺癌细胞的影响*
杨哲豪,喻超,潘耀振,邓路,郑迪杰,孙诚谊*
(贵州医科大学附属医院 肝胆外科,贵州医科大学 肝胆胰脾重点实验室,贵州省肝胆胰脾疾病研究所,贵州 贵阳 550004)
胰腺癌(pancreatic cancer,PC)是恶性程度极高的消化道肿瘤之一,早期难以发现且预后差。根据近年来的癌症统计数据,PC居癌症死亡率的第六位,五年生存率仅为7%[1]。由于缺乏典型的临床表现和特定的早期诊断标志物,只有15%~20%的PC患者被诊断为肿瘤可切除[2],因此寻找特异性的生物标志物或新靶标成为PC诊断和治疗的突破口[3-4]。长链非编码RNA(long non-coding RNA,lncRNA)在许多生物活动过程中发挥调解作用,包括基因组印迹、表观遗传调控、可变剪接、细胞分化和癌变[5-6]。lncRNA在多种疾病的发病机制中起着重要作用,尤其是在癌症、心血管疾病、神经疾病和免疫介导的疾病中[7-9]。近年的研究证明,lncRNA遗传表达可通过对细胞增殖、凋亡、转移和侵袭的调控来促进多种肿瘤的恶性转化[10-11]。淋巴增强因子1反义RNA1(lymphoid enhancer-binding factor1 antisense RNA1,LEF1-AS1)是近期发现的新lncRNA,Jin等[12]研究发现通过敲低LEF1-AS1后可显著抑制恶性胶质瘤细胞的增殖、侵袭,并促进细胞凋亡;Wang等[13]发现上调LEF1-AS1表达后促进了肺癌细胞的增殖和侵袭;Liu等[14]研究发现敲低LEF1-AS1后调节Wnt/β-catenin通路可抑制成视网膜细胞瘤细胞的增殖、迁移和侵袭。但LEF1-AS1在PC中发挥的作用尚不明确,因此本实验通过敲低LEF1-AS1表达观察其对PC细胞增殖、迁移和侵袭能力的影响,现将结果汇报如下。
1 材料与方法
1.1材料
1.1.1生物信息学资料 使用gene expression profiling interactive analysis(GEPIA)网站分析来源于癌症基因组图谱(the cancer genome atlas,TCGA)数据库中179例PC组织和171例正常组织LEF1-AS1的表达。
1.1.2细胞 正常人胰管上皮细胞株(human pancreatic duct epithelial,HPDE)和PC细胞株Panc-1、Bxpc-3、AsPC-1、Capan-1、CFPAC-1及MIA PaCa-2获赠于华中科技大学附属同济医院胆胰外科实验室。
1.1.3主要试剂 胎牛血清、胰蛋白酶及DMEM培养基购自于美国Gibco公司,Trizol试剂购自美国Invitetrogen公司,细胞计数试剂盒(cell counting kit-8,CCK-8)、Transwell小室和Matrigel购自美国BD公司,B细胞白血病淋巴瘤2(B-cell leukemia-lymphoma-2,BCL-2)、B细胞白血病淋巴瘤相关蛋白(BCL-2-associated X protein gene,Bax)、波形蛋白(Vimentin)及钙黏附蛋白E(E-cadherin)的抗体购自于美国Proteintech公司,siLEF1-AS1和siControl购自广州锐博生物公司,逆转录试剂盒及SYBR试剂盒均购自日本TaKaRa公司。
1.1.4主要仪器 CFX96 Touch荧光定量PCR仪(quantitative real-time PCR,qPCR)购自美国Bio-rad公司,ChemiDocTMTouch bio-rad化学发光成像系统购自美国Bio-rad公司。
1.2方法
1.2.1细胞培养和LEF1-AS1 mRNA的表达 HPDE和PC细胞株Panc-1、Bxpc-3、AsPC-1、Capan-1、CFPAC-1及MIA PaCa-2均培养于10%胎牛血清的DMEM完全培养基,置于37 ℃、体积分数5%CO2的恒温培养箱中培养;取对数生长期的以上各细胞,根据试剂说明书的标准流程,使用TRIzol试剂提取HPDE和PC细胞系的总RNA;使用PrimeScript RT试剂盒合成第一链cDNA,使用SYBR green进行实时PCR检测LEF1-AS1mRNA的表达,GAPDH用作基线表达的管家基因。
1.2.2细胞转染及分组 取对数生长期PC细胞Panc-1和MIA PaCa-2,胰酶消化,吹打为单细胞悬液后进行细胞计数,取相应细胞2×105个分别接种于6孔板中,培养过夜,根据试剂说明使用Lipofectamine 3000用siControl和siLEF1-AS1对细胞进行转染,设置加入siControl的Panc-1和MIA PaCa-2细胞分别为对照组,加入siLEF1-AS1的Panc-1和MIA PaCa-2细胞分别为下调组。
1.2.3CCK-8测定 待对照组和下调组细胞转染48 h后,分别消化计数细胞,将单细胞悬液以1×104个细胞/孔的速度种植在96孔培养板中,分别孵育24、48及72 h,每个时间点设置5个复孔,每孔加入CCK-8溶液10 μL,37 ℃孵育2~4 h,使用酶标仪在450 nm处记录吸光度。
1.2.4平板克隆实验 取对数期长势良好的对照组和下调组细胞,分别消化、计数制备成单细胞悬液,以500个/孔的初始密度接种于6孔板中,置于37 ℃、体积分数5%CO2的恒温培养箱中培养2周,4%多聚甲醛固定细胞,0.1%结晶紫染色,光学显微镜计数细胞集落形成数。
1.2.5划痕实验 取对数期长势良好的对照组和下调组细胞,分别消化、计数,将单细胞悬液以1×105个/孔种植在6孔板中,待细胞生长至密度达90%,使用无菌200 μL移液器吸头每孔划3条相互平行且等宽划痕,更换无血清培养液继续培养;用相差显微镜监测单层的恢复情况(0~72 h),随机选取3个视野拍照,记录划痕宽度并计算细胞相对迁移率[细胞相对迁移率(%)=(0 h划痕宽度-72 h后划痕宽度)/0 h划痕宽度×100%]。
1.2.6细胞迁移及侵袭实验 取对数期长势良好的对照组和下调组细胞用胰酶消化后,用无血清DMEM 培养基制成单细胞悬液,将单细胞悬液以1×107个接种到Transwell上腔室,将含10%FBS的培养基600 μL添加到Transwell下腔室;温育24 h,用棉签除去不能穿透上腔室膜的细胞;将透过下腔室的细胞用4%多聚甲醛于室温固定15 min,0.1%结晶紫染色;洗净后烘干过夜,通过光学显微镜拍照并计数。细胞侵袭实验中Transwell膜用Matrigel包被6 h,其余操作方法同前。
1.2.7Western blot检测 对照组和下调组细胞转染72 h后,提取细胞总蛋白,依照蛋白定量结果经电泳、转膜、洗膜,加入Bcl-2、Bax、E-cadherin及Vimentin蛋白对应一抗4 ℃摇床孵育过夜、二抗室温孵育2 h,洗膜、曝光,用Image Lab检测条带灰度值,计算Bcl-2、Bax、E-cadherin及Vimentin的蛋白表达量。
1.3统计学分析
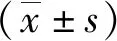
2 结果
2.1LEF1-AS1的表达
TCGA结果显示,LEF1-AS1在PC各细胞株中表达高于正常胰腺组织,差异有统计学意义(P<0.05,图1A);qPCR检测结果显示,与HPDE相比,PC细胞株Panc-1、Bxpc-3、AsPC-1、Capan-1、CFPAC-1及MIA PaCa-2中LEF1-AS1表达水平上调,差异均有统计学意义(P<0.05,图1B)。
2.2敲低LEF1-AS1对PC细胞增殖能力的影响
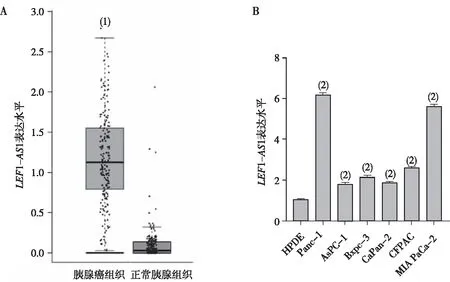
CCK-8实验结果显示,与对照组相比较,下调组Panc-1和MIA PaCa-2细胞24 h、48 h及72 h时OD值均下降(P<0.05,图2A和2B);平板克隆实验结果显示,与对照组比较,下调组Panc-1和MIA PaCa-2细胞集落形成数降低,差异均有统计学意义(P<0.05,图2C和2D)。
注:A为TCGA数据结果(组织),B为qPCR检测结果(细胞);(1)与正常胰腺组织比较,P<0.05;(2)与HPDE细胞比较,P<0.05。图1 LEF1-AS1在正常或PC组织和细胞中的表达Fig.1 Expression of LEF1-AS1 in PC or normal tissues and cells of
注:A、B分别为PANC-1和MIA PaCa-2的CCK-8实验结果,C为平板克隆实验形态学结果,D为平板克隆实验定量分析结果;(1)与对照组比较,P<0.05。图2 敲低LEF1-AS1对各组PC细胞PANC-1和MIA PaCa-2增殖的影响Fig.2 Effect of knockdown LEF1-AS1 on proliferation of PC cells PANC-1 and MIA PaCa-2
2.3敲低LEF1-AS1对PC细胞侵袭和迁移能力的影响
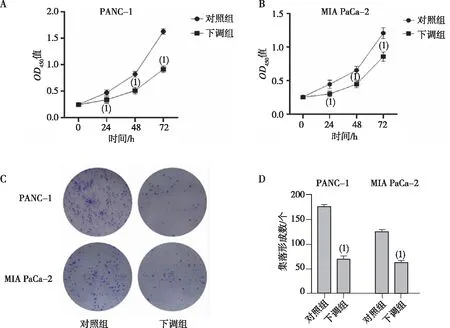
划痕实验结果显示,以0 h为对照,下调组Panc-1和MIA PaCa-2细胞72 h后迁移距离较对照组变短,差异均有统计学意义(P<0.05,图3A和3B);Transwell实验结果显示,与对照组比较,下调组Panc-1和MIA PaCa-2细胞迁移和侵袭能力都降低,差异有统计学意义(P<0.05,图3C和3D)。
注:(1)与对照组比较,P<0.05。图3 敲低LEF1-AS1对PC细胞迁移及侵袭的影响Fig.3 Effect of knockdown LEF1-AS1 on invasion and migration of PC cells
2.4敲低LEF1-AS1后PC细胞Bcl-2、Bax、E-cadherin及Vimentin蛋白的表达
敲低LEF1-AS1表达后,与对照组比较,下调组PANC-1和MIA PaCa-2细胞中Bcl-2、Vimentin蛋白的表达量均下降,Bax和E-cadherin蛋白的表达量均升高,差异均有统计学意义(P<0.05)。见图4。

注:(1)与对照组比较,P<0.05。图4 PC细胞Bcl-2、Bax、E-cadherin及Vimentin蛋白的表达(Western blot)Fig.4 Expression of Bcl-2, Bax, E-cadherin and Vimentin protein in PC cells (Western blot)
3 讨论
近年来,lncRNA在肿瘤发生和发展中的调控已引起广泛关注。研究发现lncRNA广泛参与了肿瘤的发生和转移[15-18]。越来越多的证据表明,lncRNA在各种人类肿瘤中异常表达,在促癌或抑癌基因的调控中起着重要作用,可以作为早期诊断和预后预测的生物学标志物亦或是作为肿瘤靶向治疗的靶标[19-20]。借助微阵列和测序技术的重大进步,在肿瘤中已鉴定出众多失调的lncRNA,并证明它们在多种肿瘤中起着重要的作用,例如PVT1、HOTAIR和MALAT1等长链非编码RNA是PC发生和发展的重要调节剂[21-23]。Zhang等[24]发现LEF1-AS1在大多数肿瘤中都出现高表达,并实验证明敲低其表达后可抑制口腔鳞状细胞癌的增殖、迁移和侵袭。在本研究中,通过分析癌症基因组图谱的数据,发现LEF1-AS1在PC组织中表达明显高于正常组织,进一步实验发现在PC细胞系中高表达。这些证据提示,LEF1-AS1可能参与了PC的发展。为了进一步验证假设,进行了一系列体外实验,发现敲低LEF1-AS1后对PC细胞增殖、侵袭和迁移均有抑制作用。有研究表明Bcl-2是一种癌基因,其过度表达能增强细胞对多数细胞毒素的抵抗性,具有抑制凋亡的作用,而Bax是Bcl-2家族中的促凋亡基因,其过度表达可拮抗Bcl-2的保护效应促进细胞凋亡[25]。另外有研究认为,上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞获得侵袭和迁移能力的重要生物学过程,其特点是细胞粘附分子表达减少、细胞角蛋白骨架转化为Vimentin为主的细胞骨架的特征等,其中E-cadherin表达下降被认为是EMT的重要标志[26]。为了探究敲低LEF1-AS1后PC细胞功能表型变化的是否与上述机制有关,进行相关实验发现敲低LEF1-AS1表达后PC细胞中Bcl-2表达下降,Bax表达升高,提示敲低LEF1-AS1后能促进PC细胞凋亡;而Vimentin表达升高和E-cadherin下降,则提示在敲低LEF1-AS1后抑制PC细胞上皮细胞-间充质转化的发生。
综上,LEF1-AS1在PC组织和PC细胞系中均出现高表达,体外敲低PC细胞PANC-1和MIA PaCa-2中LEF1-AS1的表达可能通过促进细胞凋亡和抑制上皮细胞-间充质转化发生的进程,从而抑制PC细胞的增殖、迁移和侵袭能力。还需做进一步研究,以阐明LEF1-AS1对PC增殖、迁移和侵袭过程中的具体调控机制。该结论有助于为PC早期诊断、临床治疗提供新的依据和理论基础。

