IL-6与上皮性卵巢癌分期进展关系及其作用机制的生物信息学分析
张桐硕,刘金龙,赵 跃,王朵朵,宋姜楠,陈 晓,郭小芹,李艳秋,祝 峰
卵巢癌是致死率高的妇科肿瘤,对患者生理及心理产生巨大的危害。卵巢癌组织来源复杂,包括上皮性、间质性、生殖细胞来源。其中,上皮性卵巢癌(epithelial ovarian cancer,EOC)是最常见的组织类型,占卵巢肿瘤的50%~70%,卵巢恶性肿瘤的90%~95%[1]。EOC发病隐匿,缺少令人满意的肿瘤标志物,制约着EOC预后的改善,近15年我国卵巢癌生存率未见升高[2]。挖掘EOC发生、发展的调控分子,对寻找体外预警和监测方法等转化医学具有重要意义。炎症与肿瘤的关系是近些年的研究热点。炎性微环境在肿瘤的恶性演进中发挥促进作用,这一观点被越来越多的模型证实[3]。天然免疫应答细胞释放的炎性因子以旁分泌和自分泌的方式控制肿瘤的生长。其中,白细胞介素-6(interleukin-6,IL-6)被认为是衔接炎症与肿瘤最为核心的炎症因子。然而,既往关于EOC中IL-6的临床报道多为简单地比较外周血或腹水中IL-6水平的高低差异[4],或用以评估预后表现[5],缺乏与EOC分期整体性的相关性分析,而且对IL-6水平增高的成因阐述薄弱,其生物学意义尚待深入研究。本研究从EOC血清样本出发,初步分析IL-6随分期进展的变化趋势,借助高效的生物信息学分析手段,进一步从基因层面分析IL-6的水平差异,为开发IL-6在EOC中的潜在价值提供新线索。
1 资料和方法
1.1 EOC血清中IL-6的水平检测
1.1.1 研究对象 选取武警特色医学中心妇科2017年2月—2018年6月间收治的原发性EOC患者21例,中位年龄51(25~77)岁。按国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2013年版手术-病理分期标准,Ⅰ期7例,Ⅱ期5例,Ⅲ期6例,Ⅳ期3例。另收集我院同期收治的卵巢良性疾病患者12例作为阳性良性对照组,中位年龄42(17~60)岁,包括卵巢良性粘液性囊腺瘤4例、卵巢单纯囊肿4例、巧克力样囊肿2例及卵巢纤维瘤2例。健康体检妇女30例作为正常对照组,中位年龄44(24~70)岁。所有对象均排除心、肝、肾等重要脏器疾患,不合并自身免疫性疾病,近期无感染。采血前均未行手术、放疗或药物治疗。均与患者签署知情同意书,研究经医院伦理委员会批准。
1.1.2 样本采集及检测 抽取受检者的静脉血3 mL于促凝采血管中,3 000 r/min离心10 min,再取1 mL上清于无酶冻存管中,-80 ℃保存。待所有血样收集完毕后,整批采用ELISA法检测IL-6水平。人类IL-6免疫检测试剂盒购自美国R&D Systems公司,OD值检测使用美国Thermo Scientific公司的全自动酶标仪,具体操作严格按说明书。每个样本以3次检测的平均值作为其血清IL-6的水平。
1.2 EOC病理组织中IL-6基因表达水平及生物信息学分析
1.2.1 基因数据来源 从公共基因表达(gene expression omnibus,GEO)(http://www.Ncbi.nlm.nih.gov/geo/)数据库下载EOC组织芯片数据集:GSE9891(285例)、GSE26193(107例)、GSE54388(16例)。从癌症基因组图谱(the cancer genome atlas,TCGA)数据库(https://tcga-data.nci.nih.gov/tcga/)下载Nature杂志发文总结的卵巢癌mRNA表达RNASEqV2数据集,包含489例高级别浆液性卵巢癌组织,覆盖不同的FIGO分期,其中198例包含脉管浸润的病理信息。
1.2.2 共同差异基因筛选 对各数据集样本的IL-6 mRNA水平由高到低进行排序,前50%的样本作为高表达组,后50%的样本作为低表达组。对于GEO数据库的3个数据集,通过GEO2R分析平台(https://www.ncbi.nlm.nih.gov/geo/geo2r/)提取IL-6高、低分组间的差异基因。对于TCGA的数据集,利用R语言的Limma程序包提取差异基因。按照FDR<0.05,Log2FC>1的标准进一步筛选出各数据集中差异明显的基因绘制Venn图,选取在3个及以上数据集的交集基因用于后续分析。
1.2.3 GO和KEGG通路富集分析 使用DAVID在线生物信息学分析工具(https://david.ncifcrf.gov/)对筛选出的IL-6高、低表达组间的差异基因进行生物学注释和分类,分别完成基因本体(gene ontology,GO)富集分析和京都基因与基因组百科全书通路(the Kyoto encyclopedia of genes and genomes pathway,KEGG)富集分析。GO富集分析又分为生物学过程、细胞组分和分子功能3个类型板块,每个类型取富集程度最高的6个条目作图展示。
1.2.4 构建蛋白互作网络 将筛选出的差异基因和IL-6导入STRING在线数据库(http://string-db.org/),获得差异基因所编码的蛋白质之间的相互作用。利用Cytoscape软件对高度可信(结合系数大于0.7)的互作关系进行可视化处理,生成蛋白互作网络图。再利用Cytoscape的MCODE插件根据节点的拓扑特性对整个网络进行聚类构建子模块,定位IL-6所在的子网络模块,挖掘出与IL-6关系密切的关键节点蛋白。
1.3 统计学处理 应用SPSS 25.0软件进行统计学分析;EOC与2个对照组的血清IL-6数据均呈非正态分布,故IL-6水平以中位数表示;组间比较采用非参数Kruskal-Wallis H检验,两两比较采用Bonferroni校正;TCGA数据库中是否发生脉管浸润的2组IL-6 mRNA比较采用Mann-Whitney U检验;血清IL-6水平与FIGO分期的相关性分析采用Spearman等级相关检验;以P<0.05为差异比较具有统计学意义。
2 结果
2.1 EOC患者血清IL-6的水平以及与FIGO分期的关系 正常对照组、良性对照组与EOC组的血清IL-6水平分别为5.88(3.83~6.87)pg/mL、13.24(8.53~27.70)pg/mL和27.76(14.57~80.92)pg/mL,整体间差异比较具有统计学意义(P=0.035)。经过3组之间的两两比较,只有EOC组高于正常对照组,差异比较有统计学意义(P=0.031),图1A。通过Spearman相关分析发现,血清IL-6与FIGO分期的等级数存在明显正相关(r=0.79,P=0.002),图1B。
2.2 EOC组织IL-6 mRNA与脉管浸润以及FIGO分期的关系 在TCGA数据的EOC样本中,IL-6 mRNA在不同FIGO分期整体间有显著差异(P=0.001),且随FIGO Ⅰ~Ⅲ依次升高(FIGO Ⅰ与Ⅱ:P=0.007,FIGO Ⅱ~Ⅲ:P=0.016)。Ⅳ期的IL-6转录水平出现回落(P=0.039),图2A。IL-6 mRNA的水平在脉管浸润状态下高于非浸润状态(P=0.027),图2B。
2.3 IL-6高、低表达组中的共同差异基因 从GEO和TCGA数据库收集到4个数据集共计897例EOC样本的基因表达谱。GSE9891、GSE26193、GSE54388和TCGA中符合筛选标准的差异基因各自有485个、417个、768个和1 260个,至少3个样本集共有的差异基因有199个。相比于IL-6低表达组,高表达组中有156个表达上调,43个表达下调。
2.4 差异基因的富集分析 GO富集分析显示,199个表达差异基因主要参与了细胞外基质的重塑、细胞粘附能力调控、胶原蛋白的合成以及中性粒细胞趋化作用引发的炎症反应等一系列生物过程;参与合成的胶原蛋白、基底膜等产物多分布于细胞外基质,是肿瘤微环境的重要组分;参与的分子功能除构建细胞外基质外,还包括与调控肝素、整合素、细胞外基质分子与其配体的亲和性,进而影响细胞和外环境的信号传递转导。KEGG通路富集分析显示,这些差异基因涉及的信号通路覆盖细胞外基质受体互作、凝血功能、致癌因子等方面,主要有各类致病菌感染所激活的通路,调节慢性炎症反应的Toll样受体、NF-κB信号通路,以及与增殖和凋亡等生物效应密切相关的PI3K/Akt、TNF信号通路。
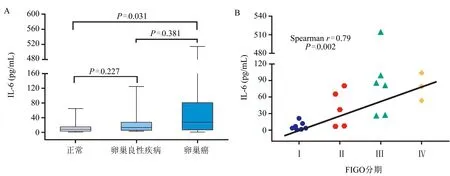
注:A:EOC组与对照组的血清IL-6水平(3组间Kruskal-Wallis H检验 P=0.035);B:血清IL-6水平与FIGO分期的相关性分析图1 EOC患者血清IL-6的水平以及与FIGO分期的关系
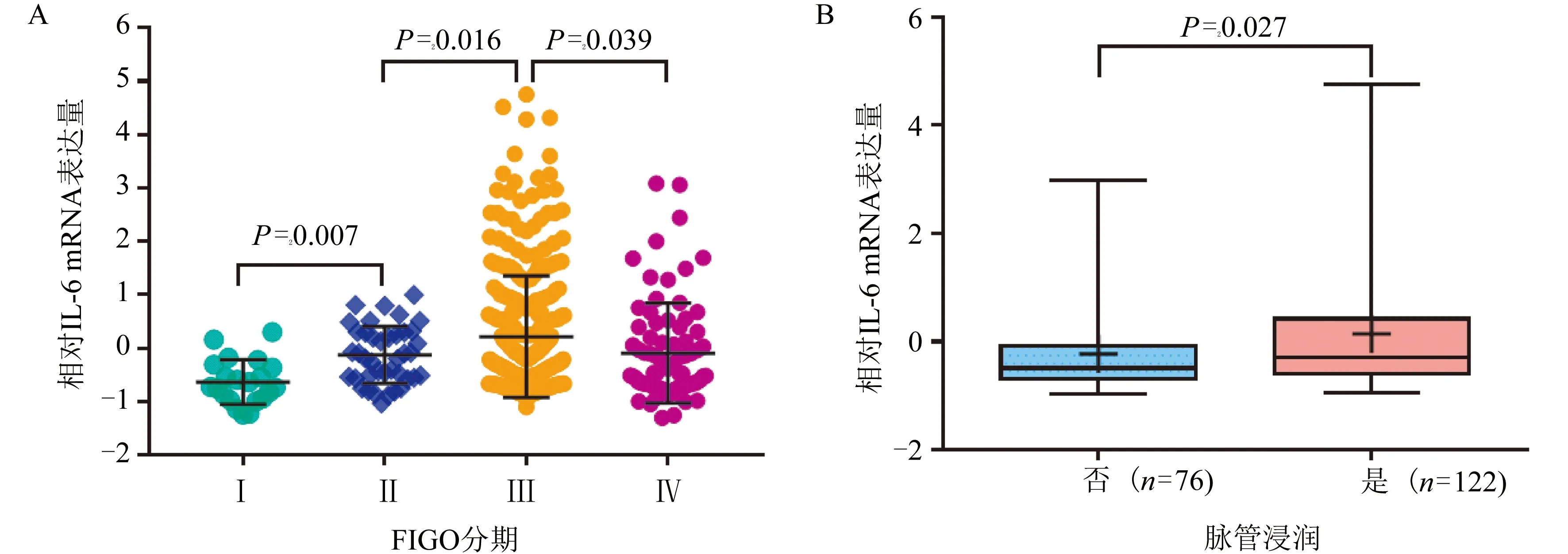
注:A:FIGOⅠ~Ⅳ期的IL-6 mRNA水平(4组间Kruskal-Wallis H检验 P=0.001);B:EOC发生脉管浸润与否的状态下的IL-6 mRNA水平图2 EOC组织IL-6 mRNA与EOC分期进展的关系
2.5 蛋白互作网络分析 图3展示了差异基因所对应蛋白的相互作用关系。IL-6在整个网络中居于核心地位,周边与IL-6结合系数较高的邻接基因有SOCS3、FOS、IL8、CCL2、JUNB、IL7R、PTPRC(图3A)。利用MCODE插件进行更深层的分子功能模块挖掘,挑选出包含IL-6且聚类分值排序最靠前的子模块,其内部节点为CCL2/3、C1QA/B、PTPRC、VSIG4、CD163,可能在IL-6调控的范围内发挥重要作用(图3B)。
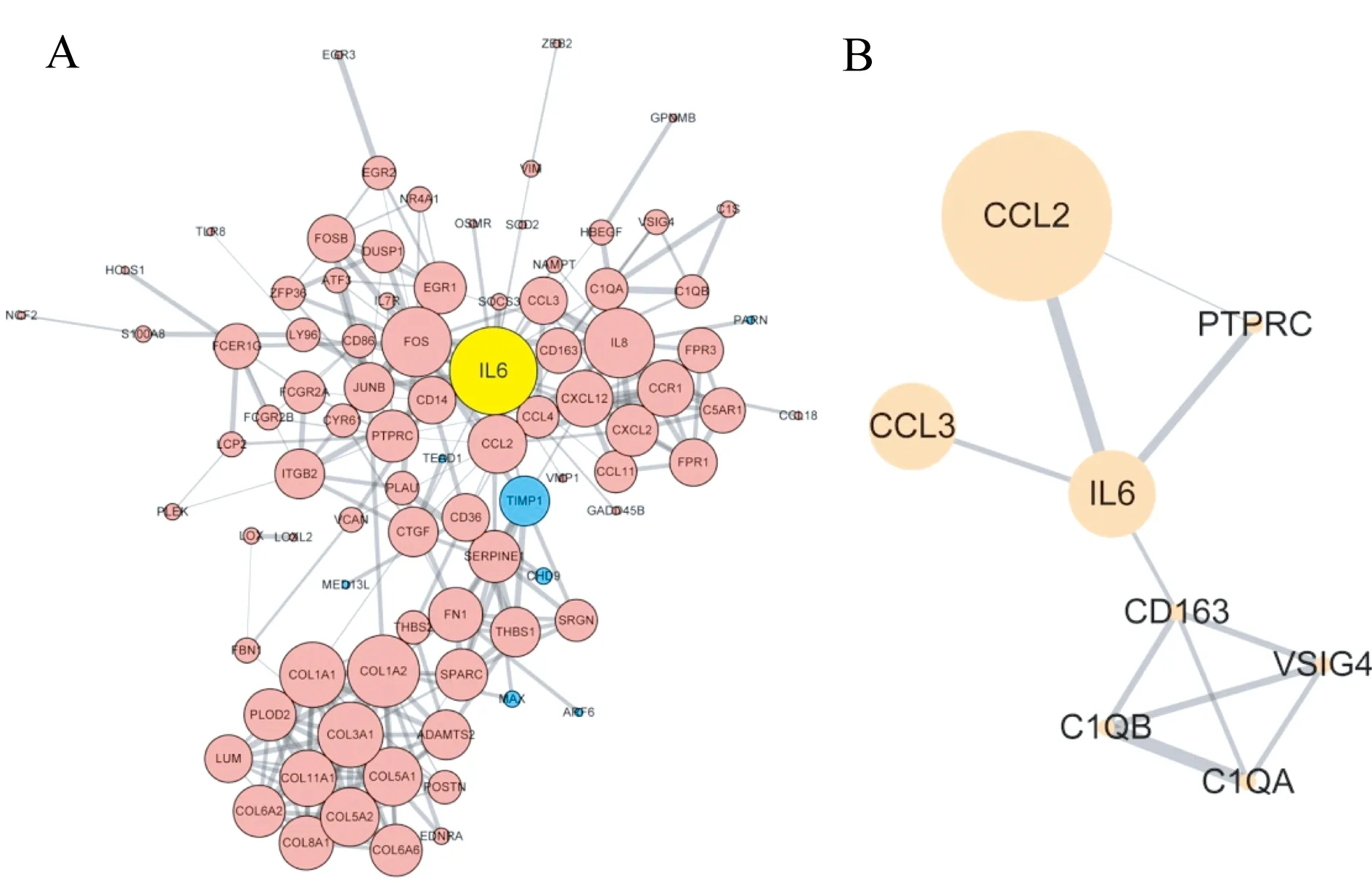
注:基因节点均以圆圈表示,节点大小代表与该基因有直接互作关系的基因数目(连接度越高,圆圈越大);节点之间连线的粗细代表其互作关系的结合系数;红色节点代表上调基因,蓝色代表下调基因图3 卵巢癌IL-6相关差异基因的蛋白互作网络图
3 讨论
IL-6可由单核-巨噬细胞、淋巴细胞、成纤维细胞和部分肿瘤细胞分泌至微环境中,并可以到达血液循环而被检测到。既往绝大多数研究中可观察到卵巢癌患者的血清IL-6高表达,并发现术前较高的血清IL-6水平与较短生存期或不良预后存在关联。本研究亦得到相似结果,正常对照组、良性对照组与EOC组的血清IL-6平均值依次增高。然而,组间两两比较的结果显示,EOC组与良性对照组未见显著差异(P=0.318),考虑是由于IL-6水平的个体差异较大,导致组间的别差不易出现统计学意义。本研究各组内的IL-6水平均呈偏态分布,与先前报道中的IL-6分布特点基本一致,因此,在分析IL-6与FIGO分期的关系时,不宜采取将不同分期拆分对比差异的统计方式,而应选用Spearman相关分析来评估IL-6随分期进展的变化趋势。结果显示,血清IL-6与FIGO分期的相关系数较大,呈正相关。组织中的IL-6 mRNA变化趋势与血清IL-6基本保持了一致。值得注意的是,IL-6 mRNA在脉管浸润状态下上调,而脉管浸润的出现常提示EOC发生潜在转移。可见IL-6与EOC的分期进展密切相关,对监测EOC的进程具备一定的开发应用价值。
探究IL-6在EOC恶性演进中相关基因和通路,有助于理解IL-6与以上病理特征的联系,为IL-6的临床应用提供理论依据。综合GO和KEGG通路富集分析的结果发现,大部分差异基因所参与的功能和通路可归纳到上皮-间质转化(epithelial-mensenchymal transition,EMT)的范畴。细胞重定位是EMT的重要步骤,即卵巢上皮细胞从基底膜转移到胶原纤维构成的细胞外基质中[6],而细胞外基质、细胞粘附能力及其附属类别集中的IL-6相关差异基因数目最多。目前已有研究证实,IL-6可通过上调控基质金属蛋白酶降解细胞外基质和基底膜,从而促进肿瘤细胞侵袭[7]。
KEGG通路富集分析包含多种感染性疾病,只代表IL-6在EOC中介导的慢性炎症与细菌感染引起的炎症启动了相似的信号通路,包括了Toll样受体、PI3K/Akt、NF-κB和TNF信号通路等肿瘤界的明星通路,与IL-6一同构成广泛而复杂的EOC进展调控信号网络。Toll样受体是连接固有免疫和适应性免疫的纽带,可能与肿瘤抗凋亡能力以及免疫逃逸有关。Szajnik等[8]研究发现,Toll样受体相关激动剂可导致卵巢癌的NF-κB通路活性增加,并产生IL-6等炎症因子。Wang等[9]发现IL-6可通过活化PI3K/Akt通路来增强卵巢癌细胞的粘附和侵袭能力。Kulbe等[10]报道,TNF-α可诱发产生血管生成因子,促进卵巢癌细胞的种植和新生血管的形成,而TNF-α基因敲除的卵巢癌细胞则表现出非侵袭性和高凋亡率。
深入分析IL-6相关差异基因的相互作用关系,发现CCL2、PTPRC和CD163不但在整个互作网络中与IL-6的结合系数较高,而且出现在IL-6的功能子模块中,这3个分子可能是IL-6调控卵巢癌的关键靶点。CCL2作为趋化因子家族的重要一员,能招募免疫抑制性白细胞聚集到卵巢癌细胞的周围的微环境中,诱导其浸润转移[11],推测IL-6可能通过升高EOC细胞表面CCL2的浓度从而提高其侵袭和转移能力。CD163也被称血红蛋白清道夫受体,是单核-巨噬细胞活化的标记[12]。有学者认为CD163可以通过炎性因子影响凋亡相关蛋白的水平从而抑制细胞凋亡,还可以通过调节EMT参与肿瘤转移[13]。PTPRC即CD45,免疫细胞如T细胞、B细胞、自然杀伤细胞和巨噬细胞表面均有表达,在Toll样受体的信号转导以及白细胞的粘附和迁移中发挥重要作用[14]。近年来的研究多集中在PTPRC对造血系统肿瘤的靶向治疗,但尚未见PTPRC与卵巢癌的相关报道,其在卵巢癌中的意义还有待探索。
综上所述,本研究发现血清IL-6在EOC中高表达,其升高程度与反映病灶转移扩散情况的FIGO分期呈正相关。继而通过生物信息学分析揭示,IL-6相关差异基因的功能特征主要集中在肿瘤侵袭和转移方面,与IL-6水平随分期进展而升高的规律相吻合,也解释了作为肿瘤转移始动因素的脉管浸润伴发IL-6转录水平上调的现象。鉴于血清IL-6在人群中的基础值范围跨度较大,且特异性不强,虽然不足以用于卵巢癌的早期筛查,但有望作为一种无创的辅助指标追踪卵巢癌的进程,并配合CA125、HE4等经典卵巢癌标志物,改善EOC的诊断与管理。

