旋转式生物反应器培养细胞因子诱导的杀伤细胞研究
许小婷,汪 月,王 琳,曾宪卓
随着世界人口日趋老龄化,癌症正在成为引起人类非正常死亡的最重要原因,目前在全球每年有大约1 000万人死于各种癌症[1]。传统的治疗癌症手段如放疗、化疗和手术治疗等已逐渐进入平台期。近年来,肿瘤免疫疗法研究取得了重要进展,肿瘤免疫细胞治疗受到越来越多的关注,预示着免疫细胞治疗有望成为继手术、化疗、放疗、靶向治疗后恶性肿瘤治疗领域的又一场革新[2]。基于免疫细胞的临床应用越来越广泛,如何有效的大规模培养免疫细胞也显得尤为重要。但目前大多数的免疫细胞培养都是采用传统的实验室培养瓶培养法,具有无法实现单次培养单元满足一个患者的细胞使用量、占地面积大、无法监控导致细胞培养批次产生显著差异、培养周期长、劳动强度大及人力成本高等缺陷。与传统的实验室培养瓶培养相比,使用生物反应器的细胞培养具有自动化、全程条件可控、动态培养可以提供一个更加稳定和均匀的培养环境和具有大规模工业化潜力的优点,可以从根本上解决传统细胞培养数量少、稳定性差、易污染、工作量大及周期长等问题[3]。本研究选用旋转式生物反应器(rotating wall-vessel bioreactor,RWV)培养细胞因子诱导的杀伤(cytokine-induced killer,CIK)细胞,与传统的实验室培养瓶培养法进行比较,验证各培养组CIK细胞的增殖能力、细胞因子分泌情况及肿瘤杀伤活力。
1 材料与方法
1.1 材料
1.1.1 样本采集 8名男性健康成年人志愿者外周血标本,50 mL/份,EDTA抗凝,无菌采集。
1.1.2 RWV RWV(自主研发;专利号:ZL201520729703.8),包括具有容纳凹部的底座以及与该底座相适配的顶盖;底座的容纳凹部内设有可拆卸的细胞培养盒,且细胞培养盒内具有阶梯柱形的细胞培养空间;底座上还设有用于驱动该底座以底座中轴线为轴进行自转的驱动装置。图1。

图1 RWV示意图
RWV可通过培养盒满足不同个性化个体细胞培养的要求,培养过程从小量到大量的过度。常规的电机或马达等驱动装置很容易的使底座进行自转搅拌,RWV避免了常规发酵罐用涡轮式旋流或者是搅拌棒搅拌等方式产生的机械冲击和剪切力造成的细胞损伤[4]。RWV的主要优点是没有搅拌剪切力,可以为细胞的生长提供一个相对温和的三维环境;另一个特点是具有随机化的重力向量,可能直接影响细胞基因的表达,或者间接促进细胞的自分泌/旁分泌,从而影响细胞的增殖分化和组织器官形成。RWV可用于当前十分热门的组织工程研究,也可用于探索微重力环境对细胞生长、分化等的影响[5]。
1.1.3 主要试剂 RPMI-1640、PBS(美国Gibco公司);肝素(美国Sigma-Aldrich公司);Ficoll淋巴细胞分离液(北京索莱宝科技有限公司);IL-2,IFN-γ,TNF-α因子ELISA试剂盒(美国Sigma-Aldrich公司);FITC标记的CD3、CD4、CD8单抗,PE标记的CD56单抗(美国Sigma-Aldrich公司)。
1.2 方法
1.2.1 外周血单核细胞分离 取外周血20 mL(20 mg/L肝素抗凝),按1∶1的比例,用1xPBS稀释外周血。另取一支离心管中加入Ficoll,将血样沿离心管壁缓慢注加于Ficoll表面(Ficoll:稀释血=1∶1),20 ℃,1 500 r/min,离心30 min。吸取外周血单个核细胞(peripheral blood mononuclear cell,PBMC)层(中间白膜层)移入另一支试管,加入5倍体积PBS,1 800 r/min,离心5 min,弃上清,再次加入5倍体积PBS,1 800 r/min,离心5 min,弃上清。RPMI1640洗涤1次5 min。以RPMI-1640培养基和10% AB型血清重悬,37 ℃,5% CO2培养箱培养2 h去贴壁细胞,吸取悬浮细胞,备用。
1.2.2 体外诱导CIK细胞 利用成人外周血提取的PBMC以RPMI1640和10% AB型血清重悬并调节细胞浓度为1×106/mL的细胞悬液,加入IFN-γ 1 000 U/mL,置于37 ℃,5% CO2培养箱培养24 h,第1天加入抗CD3mAb终浓度为50 μg/L的IL-1β和IL-2,终浓度分别为105U/L和3×105U/L,37 ℃、5% CO2培养箱继续培养,隔日进行细胞计数,补充新鲜的培养基以维持适当的细胞密度[(0.5~1.5)×106/mL],培养数天后,在无菌操作的条件下将细胞转入生物反应器中进行培养。
1.2.3 分组 将CIK细胞以0.6×107/mL的密度接种到RWV中,设置反应器的温度为37℃、转速7~10 r/min及培养基的循环率为5 r/min,作为RWV组。同时以相同的密度接种到T-Flask培养瓶中培养(放置于37 ℃,5% CO2饱和湿度培养箱中培养),作为传统实验室培养瓶组(CTRL组)。
1.2.4 培养体系效能评价
1.2.4.1 活细胞计数 分别从T-Flask培养瓶中和RWV取样口中取样1 mL细胞悬液,调整细胞密度为1.0×106/mL,取9滴细胞悬液移入小试管,加入1滴0.4%台盼蓝溶液,混匀。在3 min内用血球计数板分别计数活细胞和死细胞,镜下死细胞被染成淡蓝色,活细胞拒染。在诱导培养后第4、8、10、12、14、17、21和24天取培养的CIK细胞悬液,用台盼蓝拒染法计数活细胞数,除以初始细胞数,得出实际扩增倍数。并绘制各组细胞的生长曲线图,记录各组间的细胞增殖情况。
1.2.4.2 细胞因子分泌水平检测 各实验组在培养的第0、4、8、10、12、14、17、21和24天分别取1 mL CIK细胞悬液,充分洗涤,调整细胞浓度为2×106/mL培养24 h后,收集上清,用ELISA法定量测定免疫细胞培养上清中IL-2,IFN-γ,TNF-α变化情况,设4个平行孔。
1.2.4.3 细胞毒性检测 细胞毒活性的分析,采用乳酸脱氢酶(lactate dehydrogenase,LDH)法。选择K562作为靶细胞,将5 mL/dL小牛血清与RPMI1640混合后的培养液调整靶细胞浓度为1×105/mL;将混合液加至96孔板中,每孔100 μL,每组设定3个复孔,设置阴性对照组(靶细胞自然释放孔不加效应细胞)加100 μL培养液;阳性对照组各加入100 μL 1g/dL NP40;在每孔中加入100 μL效应细胞,效靶比设置为5∶1、10∶1、20∶1;阴性对照组中的3个复孔用100 μL培养液替代效应细胞;将孔板放置于37 ℃,5% CO2培养箱培养4~6 h;用自动生化分析仪检测LDH数值计算细胞杀伤活性。杀伤率(%)=(实验组A值-靶细胞的自然释放A值-效应细胞的自然释放A值)/(靶细胞的最大释放A值-靶细胞的自然释放A值)。

2 结果
2.1 CIK细胞的增殖能力比较 对2组分别在培养的第0、4、8、10、12、14、17、21和24天进行台朌蓝染色后,对活细胞进行计数并绘制生长曲线(图2)。结果显示在第4天以后,RWV组的细胞增殖速度开始超过CTRL组。CTRL组的细胞从第4天开始增殖,增殖高峰在第17天,增殖平台为第14~17天,随后细胞数量减少。RWV组的细胞也在第4天开始增殖,增殖高峰在第21天。从生长曲线中可以看出,在第4天各组的细胞开始出现增殖后,RWV组以后的每个时间段的细胞增殖数量都多于CTRL组。

注:CIK细胞数量增殖变化,与CTRL组比较,在培养的第14天(t=3.55,**P<0.01)、第17天(t=3.451,**P<0.01)、第21天(t=5.197,****P<0.000 1)、第24天(t=4.856,****P<0.000 1);组间比较,F=12.85,P=0.007 1图2 CIK细胞生长曲线变化趋势
2.2 细胞因子分泌水平比较 结果显示(图3),2组细胞在第4天分泌IL-2因子的水平开始升高,RWV组在第21天IL-2因子分泌水平达到高峰(151.27±2.65)pg/mL,CTRL组在第17天达到高峰(138.33±2.10)pg/mL。RWV组在第10天之前与CTRL组的IL-2因子分泌水平无差异。但在第14天以后RWV组的CIK细胞分泌IL-2因子量一直高于CTRL组。
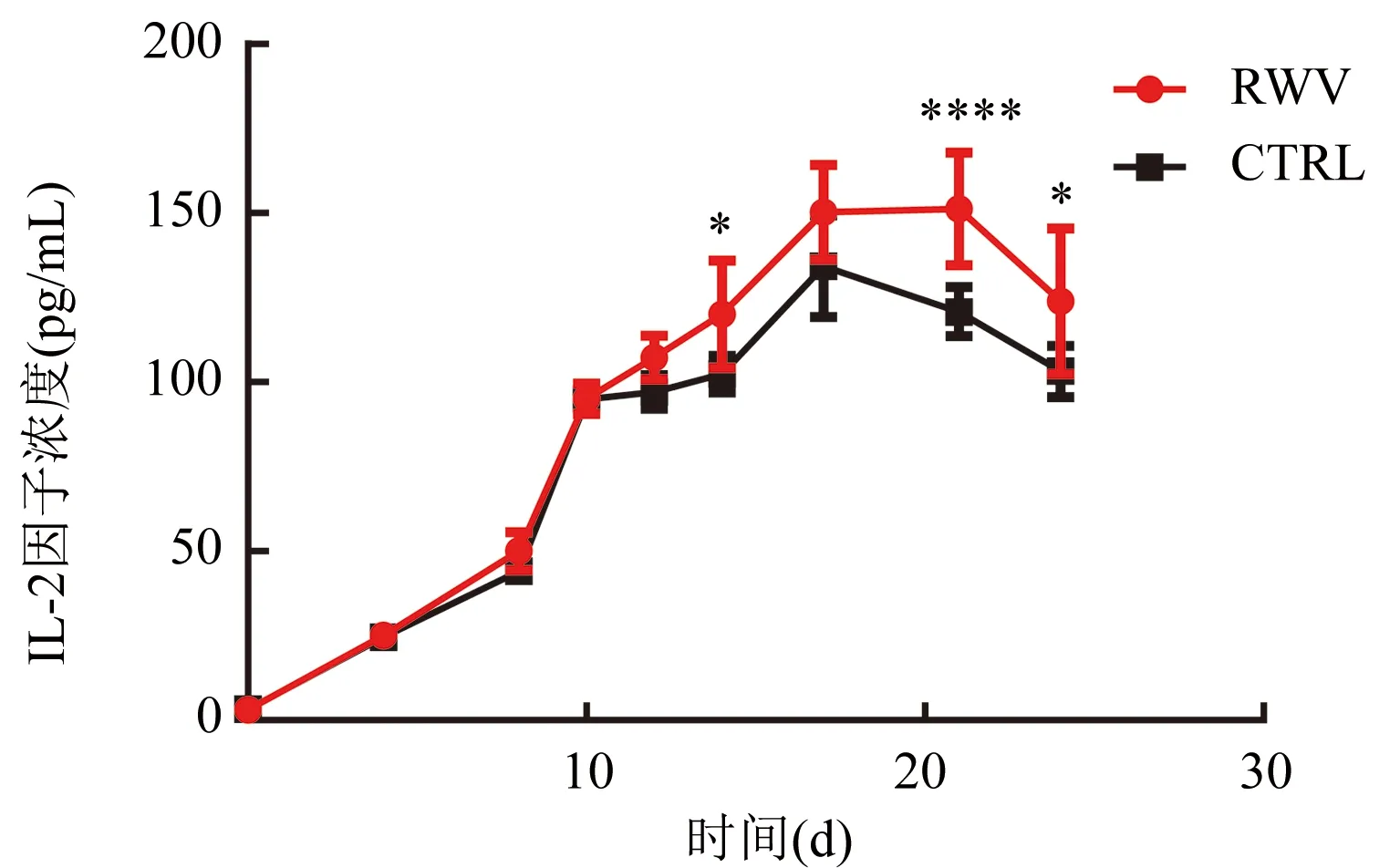
注:CIK细胞分泌IL-2因子浓度,与CTRL组比较,在培养的第14天(t=2.878,*P<0.05)、第21天(t=4.939,****P<0.000 1)、第24天(t=3.358,*P<0.05);组间比较,F=14.87,P=0.004 8图3 CIK细胞分泌IL-2因子水平表达情况
CTRL组CIK细胞分泌的IFN-γ在第21天达到高峰(209.00±2.58)pg/mL,RWV组也是在第21天达到高峰(252.80±4.07)pg/mL。在CIK细胞培养的第10天RWV组的CIK细胞分泌IFN-γ开始高于CTRL组(图4)。
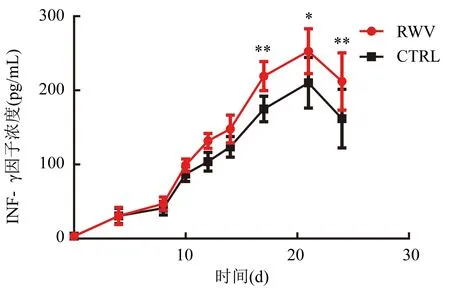
注:CIK细胞分泌IFN-γ因子浓度,与CTRL组比较,在培养的第17天(t=3.514,**P<0.01)、第21天(t=3.371,*P<0.05)、第24天(t=3.973,**P<0.01);组间比较,F=18.27,P=0.002 7图4 CIK细胞分泌IFN-γ因子水平表达情况
CTRL组分泌的TNF-α因子在第17天前都高于RWV组,第20天后则反之。CTRL组的TNF-α因子分泌在第17天达到高峰(251.25±3.02)pg/mL,RWV组则在第21天达到高峰(274.00±4.11)pg/mL(图5)。
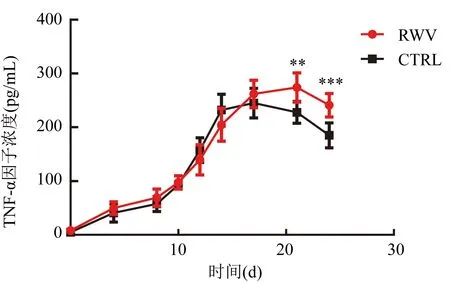
注:CIK细胞分泌的TNF-α因子浓度,与CTRL组比较,RWV组在培养的第21天(t=3.518,**P<0.01)、第24天(t=4.265,***P<0.001);组间比较,F=11.01,P=0.010 6图5 CIK细胞分泌TNF-α因子水平表达情况
2.3 CIK细胞毒性比较 结果显示(表1),在不同效靶比条件下,RWV组的杀伤率明显优于CTRL组,差异比较具有统计学意义(P<0.05)。在不同的效靶比下,2组杀瘤率随着效靶比的增大而加大,但RWV组的杀瘤率都大于CTRL组。
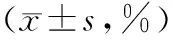
表1 细胞毒性检测结果
3 讨论
随着科学技术的进步,细胞治疗作为继手术、放疗和化疗后发展的第4类肿瘤治疗方法,在各种癌症等难治性疾病的治疗中发挥越来越重要的作用。免疫细胞可通过调控激发机体的免疫反应来对抗、抑制和杀灭癌细胞。多项研究与临床验证表明[6],免疫细胞具有较好的扩增性能和强的杀瘤活性,并对自身组织没有细胞毒性等优势。因此,其应用价值日益受到重视。1986年,Lanier等[7]第一次报道了CIK细胞,具有3种非MHC限制性细胞毒性的细胞亚群,即CD3+CD16-CD56+、CD3-CD16+CD56+和CD3-CD16-CD56bright细胞。CIK细胞在外周血中仅占不到5%。研究发现[8],CIK细胞的免疫表型主要是CD3+CD56+细胞。CIK细胞是将PBMC用多种细胞因子共刺激,体外培养后获得的一群异质细胞[9],能同时表达CD3和CD56两种膜蛋白分子[10],兼有T淋巴细胞强大的抗瘤活性和NK细胞的非MHC限制性杀瘤优点[11]。尤其对手术后或放化疗后患者效果显著,能消除残留微小的转移病灶,防止癌细胞扩散和复发,提高机体免疫力。多项临床试验已经显示[12],CIK细胞能够提高肿瘤患者生活质量,延长患者生存期。
基于免疫细胞的临床应用越来越广泛,如何有效的大规模培养免疫细胞也显得尤为重要。目前免疫细胞体外扩增的难点是如何确保细胞批次间的质量稳定。使用生物反应器扩增免疫细胞技术可以从根本上解决传统细胞培养数量少[13]、稳定性差、易污染、工作量大及周期长等问题[14],有效地降低临床治疗成本。
本研究中使用自主研发的RWV对免疫细胞进行大规模培养研究。以传统的体外扩增培养为对照组,对各组进行细胞增殖检测、细胞因子分泌水平检测和细胞毒性检测。结果都显示了RWV培养具有较长的CIK细胞生长周期,细胞增殖数量大大提高;对于CIK细胞分泌的IL-2、IFN-γ、TNF-α进行浓度检测,2组间差异比较具有统计学意义(P<0.05),RWV组的CIK细胞因子分泌水平明显高于CTRL组。研究结果表明,RWV的CD3+CD56+细胞增殖高峰在培养的第21天,IL-2、IFN-γ、TNF-α因子的表达高峰在第17~21天,这提示在CIK细胞的回输治疗中,应在生物反应器培养的第17天后回输,治疗效果更佳。LDH法检测细胞毒性结果显示经RWV培养后的CIK细胞具有更强的肿瘤杀伤活力。
本研究一定程度上解决了免疫细胞培养中细胞活性丧失、细胞扩增数量不足的难题。除此之外,研究小组还开发了具有高效扩增免疫细胞并有效维持其免疫活性的培养体系,并与RWV相结合应用,实现了大规模自动化细胞培养的雏形,一定程度上满足了临床的细胞质量要求。但因各个生物反应器存在差异,其控制系统还不够稳定,难免培育出的细胞会存在质量上的差异,因此,需要进一步对生物反应器进行调试组装升级,才能实现量产机的生产与使用,加快进入“工厂式”的大规模化自动培养工业级标准化的临床级细胞。
经过几十年来的研究与实践,虽然生物反应器大规模培养细胞的技术还存在着不少问题,但较之前已是质的飞跃,随着这一技术的进一步发展,我们需将不断努力,研制出更理想的生物反应器,以获得更高密度、高活力的细胞;开发新的无血清培养基,使细胞的生长状态更好,生物制品更安全;建立细胞培养与产物分离的涡合系统,充分利用培养液,以降低生产成本等,从而使细胞培养技术在生物制品制备和基因工程等领域得到更广泛的转化应用。

